Адъювантный артрит у крыс
Основной моделью адъювантного артрита является введение убитых прогреванием Mycobacterium tuberculosis, суспендированных в жидком парафиновом или минеральном масле, в заднюю лапу или в хвостовую кость.
После инъекции указанного материала в лапу в течение 3 дней развивается неспецифический воспалительный отек, который сменяется иммунологически индуцированным отеком другой лапы, в которую ничего не вводили. Между 16м и 30-м днем наблюдается максимальный отек, приводящий к срастанию поверхностей суставов. Затухание сильного воспаления происходит через 30-40 дней.
Другие вещества, такие как небольшие фрагменты стенки клеток микобактерий и мурамилдипептид, могут индуцировать заболевание при введении эмульсии, приготовленной на неполном адъюванте Фрейнда, под кожу стопы. СР-20961 [К,К-диоктадецил-№,К-бис(2-
оксиэтил)-пропаредиамин] — неиммунный
синтетический адъювант, суспендированный в парафиновом масле, может индуцировать хронический артрит, аналогичный наблюдаемому при введении других адъювантов.
Животными выбора являются 13-30-дневные крысы. Адъювантные артриты различаются у разных линий, и наиболее удобными являются инбредные крысы Льюис.
Этиология адъювантного артрита неизвестна, но косвенные данные свидетельствуют о наличии неидентифицированных антигенов, которые, активируясь, усиливают Т-клеточный иммунитет и вызывают воспаление в тканях сустава. Это также подтверждается фактом переноса заболевания сенсибилизированными лимфоцитами.
Роль простагландинов установлена при выявлении чувствительности модели к ингибиторам циклооксигеназного пути метаболизма арахидоновой кислоты. Воспаление, индуцированное адъювантами, также эффективно подавляется стероидами. Действие других препаратов в значительной степени зависит от дозо- вого режима. Белки острой фазы, например аггликопротеин, используются в качестве биологического маркера воспаления, индуцированного адъювантами.
Данный показатель снижается при применении нестероидных противовоспалительных препаратов и стероидов.
Артриты крыс, вызванные коллагеном II типа
Данная модель основана на использовании нативного коллагена II типа, полученного из эмбрионов цыплят или человека и тщательно эмульгированного в неполном адъюванте Фрейнда. Эмульсию вводят внутрикожно в несколько мест или подкожно в заднюю лапу или хвост. Коллагениндуцированные артриты также зависят от линии используемых животных. Появление артритов наблюдается через 12-13 дней после разрешающей инъекции, а пик развития воспаления приходится на 21-2 8-й день после сенсибилизации коллагеном. Воспаление
остается на одном уровне или постепенно уменьшается с 28-го по 50-й день.
Точный механизм развития коллагенового артрита неясен, но поскольку в нем участвует процесс иммунизации потенциальными аутоантигенами (коллаген II типа), то представляется вероятным, что в заболевании важную роль играет иммунитет к нативным коллагено-вым молекулам. Артриты, вызванные коллагеном II типа, успешно подавляются нестероидными противовоспалительными препаратами и стероидами.
сустава вызывают моноартрит. Хронические воспалительные реакции индуцируются лишь многократными инъекциями.
Моносуставные артриты
Каррагенан, зимозан и многие другие раздражающие вещества при введении в полость
Еще по теме Адъювантный артрит:
- Артрит
- АРТРИТ
- Ревматоїдний артрит
- Ревматоидный артрит
- ЮВЕНИЛЬНЫЙ ХРОНИЧЕСКИЙ АРТРИТ (ЮХА)
- Значение хлорохина в лечении ревматоидного артрита
- Ревматоидный артрит
- Действие препарата в экспериментальных моделях артрита
- ЛЕЧЕБНАЯ ФИЗКУЛЬТУРА ПРИ ЗАБОЛЕВАНИЯХ СУСТАВОВ. Артриты
- ЮВЕНИЛЬНЫЙ ХРОНИЧЕСКИЙ АРТРИТ И ДИФФУЗНЫЕ ЗАБОЛЕВАНИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
- Ревматоидный артрит (вне фазы обострения)
- Действие хлорохина в экспериментальных моделях
- Лучевая терапия.
- АРТРОПАТИИ (M00-M25) НАРУШЕНИЯ, ПОРАЖАЮЩИЕ ПРЕИМУЩЕСТВЕННО ПЕРИФЕРИЧЕСКИЕ СУСТАВЫ (КОНЕЧНОСТЕ ИНФЕКЦИОННЫЕ АРТРОПАТИИ (M00-M03)
- Эксперименты на животных
- Кисть и межфаланговые суставы пальцев
Источник
Автор
Тема: Артрит у крысы (Прочитано 3051 раз)
Добрый день, я новичок тут и может не в той теме отписалась, но мне нужен совет бывалых. Моей крысе 1,8 и вчера ей поставили диагноз артрит и назначили уколы и диету. Меня интересует вопрос чем еще можно ей помочь, что бы облегчить состояние, может какой-то массаж лап или примочки или ванны. Заранее спасибо.
Записан
кто поставил диагноз, в чем выражается «артрит», какие уколы назначены, какая диета, ВЕС крысы?
Записан
кто поставил диагноз, в чем выражается «артрит», какие уколы назначены, какая диета, ВЕС крысы?
Диагноз поставил врач в ветеринарной клинике, выражается как у всех -ноют суставы, ножки задние болят, она их поджимает, а назначили травматин 0,5 и хондиртрон 0,5 1х10. Диета с пониженным содержанием углеводов и повышенным витаминов, здоровое питание одним словом. А вес — 600гр.
Вы врач?было бы не плохо услышать от профессионала советы
Записан
нет, я не врач.
600г для девочки в ее возрасте — ОЧЕНЬ много. А расскажите-ка, чем крысу кормите — прям распишите, что, когда, в каких об»емах.
Записан
Раньше ела все подряд, ну кроме очень жирного и продуктов которые не рекомендованы. Сложно отказать этим слезливым «голодным» глазкам Сейчас стоит миска с кормом (около 2 ложек) утром может салатный листик погрызть или чуть кефира съесть, а вечером ну может огурчик, курицу вареную ну или 45% сыр(кусочек), яблоко морковку, перец может. Вообще готова все, но уже не даем.
Вопрос даже не в питании, а в сопутствующих действиях помимо лекарств.
Записан
На видео крысу снять сможете? Нужно посмотреть как именно она поджимает ножки. Суставы не опухшие?
Записан
Попеременно может поджимать, и пальчики поджимать. Пользуется в основном передними, не бегает уже, спит по многу
Записан
+1
конечно. такой вес таскать уже никак…
когда эти «голодные» глаза будут смотреть на вас и плакать от боли в спине — отказать сможете?
Сейчас стоит миска с кормом (около 2 ложек) утром может салатный листик погрызть или чуть кефира съесть, а вечером ну может огурчик, курицу вареную ну или 45% сыр(кусочек), яблоко морковку, перец может. Вообще готова все, но уже не даем.
питание — одно из важных «сопутствующих» действий.
утром кефир убираем, вечером сыр убираем(угу, нежирный 45%) курицу убираем. Оставляем зерновой корм и несладкие овощи- фрукты.
Записан
+1
конечно. такой вес таскать уже никак…
когда эти «голодные» глаза будут смотреть на вас и плакать от боли в спине — отказать сможете?
питание — одно из важных «сопутствующих» действий.
утром кефир убираем, вечером сыр убираем(угу, нежирный 45%) курицу убираем. Оставляем зерновой корм и несладкие овощи- фрукты.
Я и отказываю. Про питание: советуете нарушить диету назначенную врачом?
Меня вообще интересует больше всего первоначальный вопрос про сопутствующее лечение — массажи и т.д.
Записан
. Про питание: советуете нарушить диету назначенную врачом?
крыса — это крыса. У нее основное питание — зерновые и овощи. А у вашей крысы еще, наверняка, проблемы с почками, поэтому белковую пищу ей вообще ник чему.
про массаж я вам не скажу, не уверена, что это лучший вариант. ИМХО,нужен антибиотик, активный к микоплазме и похудение.
ждем видео
1г и 8 мес — это еще молодая крыса, у меня в 2и 5 скачут..
Записан
крыса — это крыса. У нее основное питание — зерновые и овощи. А у вашей крысы еще, наверняка, проблемы с почками, поэтому белковую пищу ей вообще ник чему.
про массаж я вам не скажу, не уверена, что это лучший вариант. ИМХО,нужен антибиотик, активный к микоплазме и похудение.
ждем видео1г и 8 мес — это еще молодая крыса, у меня в 2и 5 скачут..
Почему думаете с почками проблемы?
Записан
возраст + ожирение+слабость задних лап.
ждем видео.
Записан
хм, странно, посте осмотра и анализов это назвали артритом.
Но все равно спасибо откликнувшимся.
Записан
Я прошу прощение, что лезу в вет тему. Но если человек новичек, может просто не знать ситуации. Не смогла пройти мимо.
Вы крысу к рекомендованному специалисту возили? На этом форуме есть тема, где указаны рекомендованные специалисты. Обычные веты в крысах не разбираются и, обычно, назначвют неправильное лечение. Нужен родентолог (ратолог).
Сыром же нельзя кормить вообще…. 45% жирности для крысы очень много, и в сыре соль и другие добавки…
Записан
Источник
Yakovleva L.V., Litvinenko G.L., Deeva T.V., Кovaleva E.A.
National University of Pharmacy, Kharkоv, Ukraine
Influence of substance under the code L486-0021
on histomorphometric changes in the joints in the adjuvant arthritis in rats
Резюме. Адъювантный артрит является экспериментальной моделью ревматоидного артрита, который сопровождается развитием морфологических признаков артрита голеностопных суставов у крыс. Результаты исследования показывают, что вещество под шифром L486-0021 снижает воспалительный процесс синовиальной оболочки голеностопных суставов и по эффективности не уступает препарату сравнения «Ксефокам».
Ключевые слова: нестероидные противовоспалительные средства, экспериментальный адъювантный артрит, гистопатология, гистоморфометрия, экспериментальное исследование.
Медицинскиеновости. – 2013. – № 9. – С. 77–79.
Summary. Adjuvant arthritis is an experimental model of rheumatoid arthritis which is accompanied by the development of the morphological signs of arthritis in the ankle joints of rats. The results show that the substance under the code L486-0021 reduces the inflammation of synovial membranes ankles and is as effective as the reference drug «Ksefokam».
Keywords: nonsteroidal anti-inflammatory drugs, experimental adjuvant arthritis, histopathology, histomorphometry, experimental research.
Meditsinskie novosti. – 2013. – N 9. – P. 77–79.
Опорно-двигательная система играет важную роль в функционировании организма, одной из структурных единиц которой является сустав. Поражения суставов у людей относятся к одной из самых распространенных категорий заболеваний [7, 9]. Как правило, это тяжелые хронические процессы, в том числе ревматические, облигатным проявлением которых является развитие аутоиммунного синовита, плохо поддающегося коррекции [8]. Нестероидные противовоспалительные средства (НПВС) оказывают противовоспалительное, анальгезирующее, жаропонижающее действия, фибринолитический и тромболитический эффекты, улучшают реологические свойства крови [3, 13]. Актуальным представляется проведение экспериментальных исследований, направленных на изучение эффектов естественных регуляторов метаболизма на морфофункциональные характеристики суставов, коррекцию регенеративных процессов при экспериментальном моделировании повреждения суставов, среди которых наиболее тяжелые дисфункции связаны с процессами развития аутоиммунного воспаления [1, 5]. Такие модели позволяют вести поиск регуляторных воздействий, корректирующих течение патологических процессов при ревматоидных артритах (РА).
Наиболее близкой к РА человека является экспериментальная модель адъювантного артрита (АА) [10], поэтому для выяснения закономерностей функциональной и структурной организации суставов и поиска главных точек приложения естественных регуляторов метаболических процессов использование данной экспериментальной модели оптимально.
Цель исследования – изучение влияния вещества, производного 5-метил-4-алкилтиено[2,3-d]пиримидин-6-карбоновой кислоты под шифром L486-0021 в сравнении с оригинальным противовоспалительным препаратом «Ксефокам» на гистоморфометрические изменения в соединительнотканных структурах голеностопных суставов при экспериментальном АА у крыс.
Материалы и методы
В эксперименте использовали белых беспородных крыс-самцов массой тела 200–220 г. Исследования проведены с соблюдением правил биоэтики – гуманного обращения с животными в соответствии с положениями Европейской конвенции по защите лабораторных животных (Страсбург, 1986 г.). Для гистологического исследования были взяты отсепарированные голеностопные суставы 28 животных, у которых воспроизводили экспериментальный АА. Далее из них вырезали фрагменты с максимальным сохранением топографии суставов. Проводили фиксацию 10%-ным раствором формалина, декальцинацию кусочков 10%-ной азотистой кислотой, заливали в целлоидин-парафин для изготовления срезов толщиной 6–8 мкм, окрашивали гематоксилином и эозином [6]. С помощью окуляр-микрометра на микропрепаратах определяли толщину хряща, которая измерялась в трех точках – центральная часть головки, верхний и нижний края. Толщину суставного хряща выражали в условных единицах (усл. ед.). Также подсчитывали плотность расположения хондроцитов на условной единице площади. Статистическую обработку полученных цифровых данных проводили с применением непараметрических методов Крускала–Уоллиса и Манна–Уитни [4].
Результаты и обсуждение
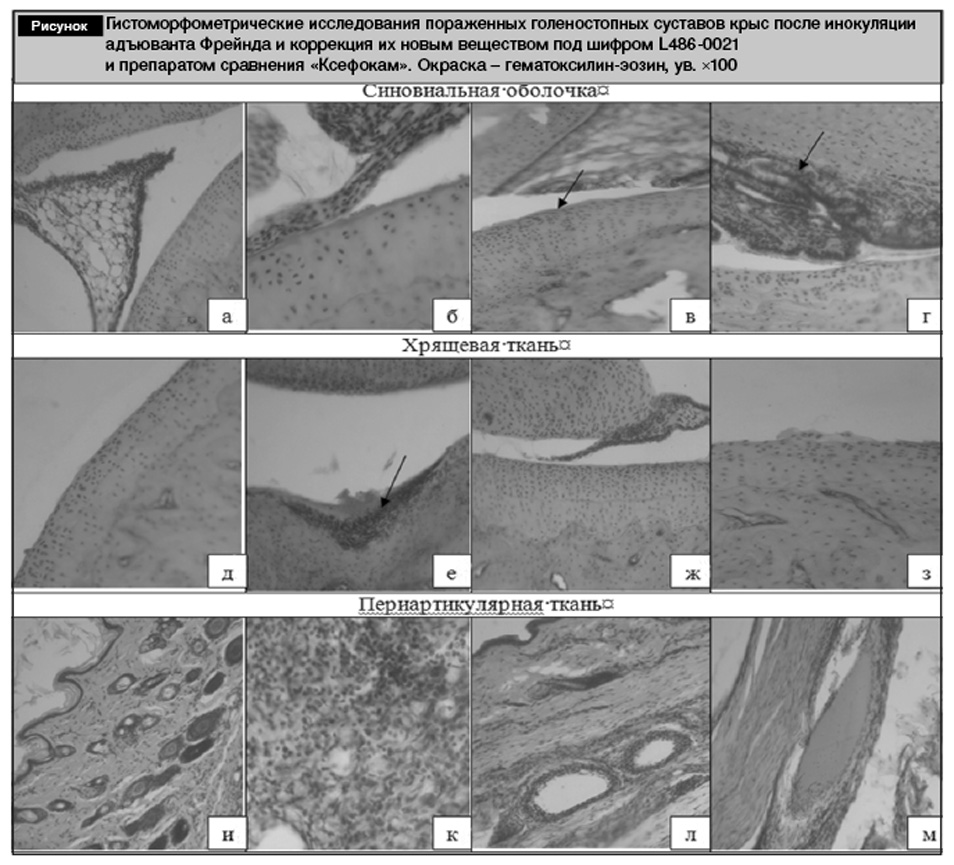
Полученные результаты исследования приведены в таблице и на рисунке.
Суставная поверхность костей голеностопного сустава крыс интактного контроля (ИК) покрыта гиалиновым хрящом, имеющим выраженное зональное строение (см. рисунок, д). В наружной зоне – клетки изолированные, мелкие, уплощенные, в средней – расположены колонками перпендикулярно поверхности. Хондроциты в этой зоне крупные с базофильной цитоплазмой; в глубокой зоне хондроциты мелкие, иногда с пикнотичными ядрами, расположенными в крупных лакунах. Глубокая зона гиалинового хряща без четкой границы переходит в обызвествленную, линия обызвествления слабо контурируется. Средняя толщина суставного хряща интактных крыс составляет 23,06 усл. ед. плотность расположения клеток в нем равна 41,2 экз. на условную единицу площади (см. таблицу).
Таблица. Морфометрические показатели суставного хряща у крыс в условиях экспериментального адъювантного артрита
Группа животных | Толщина хряща | Клеточная плотность на усл. ед. площади | % наблюдений с патологическими изменениями |
ИК | 23,06 ± 1,52 | 41,2 ± 3,8 | |
Контрольная патология | 16,26 ± 1,13* | 33,0 ± 4,01 | 100 |
L486-0021 | 22,06 ± 0,81** | 41,0 ± 2,81 | 40 |
Препарат сравнения «Ксефокам» | 21,8 ± 1,44** | 35,0 ± 4,12 | 40 |
* Отклонение достоверно относительно интактного контроля, р ≤ 0,05; ** отклонение достоверно относительно контрольной патологии, р ≤ 0,05.
Синовиальные оболочки ареолярного типа выступают в суставную полость в виде клинообразных складок (см. рисунок, а). Синовиоциты группируются довольно близко друг к другу, на некоторых участках лежат в 3–4 ряда. Периартикулярная ткань имеет типичное для своей локализации строение, признаки клеточной пролиферации отсутствуют (см. рисунок, и). Мышечные волокна равномерно окрашенные, с выраженной поперечной исчерченностью.
При гистологическом исследовании голеностопных суставов крыс группы контрольной патологии, проведенном на 30-й день после инокуляции адъюванта, обнаруживались признаки хронического неспецифического продуктивно-инфильтративного и экссудативного воспаления различной активности. Поражался не только хрящ, но и мягкотканные структуры – синовиальные оболочки и периартериальные ткани (см. рисунок, б, к). Синовиальная оболочка гиперплазирована, с многочисленными новообразованиями кровенаполненных сосудов (см. рисунок, б). У всех животных этой группы отмечается деструктивно-дистрофическое поражение суставного хряща. Обращает на себя внимание стертость зональной структуры хрящевой ткани: разделение на слои отсутствует, хондроциты расположены беспорядочно, их плотность снижена по сравнению с ИК (33,0 экземпляра на условной единице площади при 41,2 в контроле) (см. таблицу). Суставная поверхность теряет четкость границ, часто неровная, изъеденная, на многих участках имеет разной глубины узуры (см. рисунок, б). Почти во всех исследуемых препаратах хрящей этой группы животных обнаружены признаки формирования паннуса, который полностью инвазирует хрящ, замещая его соединительной тканью (см. рисунок, е). В периартикулярных тканях отмечается массивная клеточная инфильтрация, преимущественно лимфоидная со скоплением плазмоцитов, в сосудах нередки гнойные эмболы и тромбы (см. рисунок, к).

Введение вещества под шифром L486-0021 в лечебных целях существенно снижает выраженность патологических процессов в суставном хряще крыс. У 60% животных суставной хрящ имел ровную поверхность, его строение практически не отличалось от группы ИК: структура хряща сохранена, хрящевая ткань равномерно окрашена без видимых зон деструкции, бесклеточных участков не выявлено (см. рисунок, ж). Хондроциты расположены, как группами, так и поодиночке, плотность их расположения находится на уровне ИК (см. таблицу), дистрофических изменений не выявлено. Толщина хряща также достигает показателей ИК. Синовиальная оболочка не гиперплазирована, клеточный состав представлен синовиоцитами и фибробластами (см. рисунок, в). В околосуставных тканях воспалительный процесс существенно замедлен действием лекарственного средства, строение практически приближено к ИК (см. рисунок, л). Умеренное проявление тех или иных отклонений от нормы выявлено у 40% животных, у которых отмечены фибрилляция и изъеденность суставной поверхности, пролиферация синовиоцитов по краю ворсинок без признаков воспалительного процесса, однако было заметно, что процесс разрушения существенно замедлен по сравнению с контрольной патологией.
В экспериментальной группе животных, получавших препарат сравнения «Ксефокам», патологические изменения хряща и мягких тканей были обнаружены у 40% животных. Было отмечено нарушение характерной зональности, неравномерная окраска, незначительная изрезанность поверхностного контура, бесклеточные участки (см. рисунок, з). Отмечена гиперплазия синовиальной оболочки (см. рисунок, г). Толщина самого хряща составляла 85% от группы ИК (см. таблицу). У животных этой группы признаки воспалительного процесса в периартикулярных тканях проявляются в значительно меньшей мере, чем у крыс ИК, однако еще встречаются гнойные эмболы в просветах сосудов (см. рисунок, м).
Результаты проведенного гистологического и морфометричного исследования фрагментов пораженных суставов у крыс на фоне экспериментального адъювантного артрита свидетельствуют о том, что в тканях пораженных суставов выявлены патологические изменения (снижение клеточной плотности, вакуолизация цитоплазмы хондроцитов, патологическая оссификация хряща, снижение его толщины), что характерно для хронического инфильтративно-продуктивного воспаления с иммунным компонентом и соответствует литературным данным [2, 11, 12]. Воспалительные и дистрофически-деструктивные процессы наиболее выражены в тканях суставной капсулы. Качественные признаки патологического процесса подтверждены морфометрическими показателями (снижение толщины хряща).
Выводы:
1. Инокуляция адъюванта Фрейнда крысам приводит к развитию морфологических признаков артрита голеностопных суставов. Морфологические изменения характеризуются пролиферативным синовитом; формированием паннуса, разрушающего хрящ; дегенеративно-дистрофическими изменениями хрящевой ткани (снижение клеточной плотности, вакуолизация цитоплазмы хондроцитов, патологическая оссификация хряща, снижение толщины). В периартикулярных тканях отмечается массивная воспалительная инфильтрация.
2. Применение вещества под шифром L486-0021 в лечебных целях способствовало замедлению деструкции суставного хряща; снижению выраженности воспалительных процессов в синовиальной оболочке и периартикулярных тканях.
3. Нормализующее влияние препарата сравнения «Ксефокам» на морфологические изменения в суставах крыс при экспериментальном адъювантном артрите выражено в меньшей степени по сравнению с веществом под шифром L486-0021.
Л И Т Е Р А Т У Р А
1. Алякна В., Мацкявичус З., Черемных Е. // Проблемы остеологии. – 1999. – № 2 (1). – С. 28–31.
2. Дедух Н.В., Батура И.О. // Ортопед. травматол. –2001. – № 3. – С. 133–138.
3. Насонов Е.Л. Ревматология: клинические рекомендации. – М.: Гэотар-Медиа, 2005. – 288 с.
4. Лапач С.Н., Чубенко А.В., Бабич П.Н. Статистические методы в медико-биологических исследованиях с использованием Excel. – Киев: Морион, 2001. – 320 с.
5. Макаров С.А., Макаров М.А., Павлов В.П. // Науч.-практ. ревматология. – 2006. – № 1. – С. 63–67.
6. Меркулов Г.А. Курс патологогистологической техники. – М.: Медицина, Ленингр. отд., 1969. – 424 с.
7. Мирзаханова М.И., Каримов М.Ш., Арипове Т.У. // Иммунология. – 2005. – Т. 26, № 6. – С. 362–364.
8. Митрофанов В.А., Федотова М.В., Позднякова Б.Я., Гладкова Е.В. // Травма. – 2009. – Т. 10, № 3. – С. 277–281.
9. Олюнин Ю.А. // Рус. мед. журн. Ревматология. – 2008. – № 10. – С. 548.
10. Саратиков А.С., Венгеровський А.И., Прищеп Т.П. Адъювантная болезнь (морфология, патогенез, экспериментальная терапия). – Томск: Изд-во Том. ун-та. – 1983. – 102 с.
11. Hale L.P., Haynes B.F. Pathology of Rheumatoid Arthritis and associates disorders // Arthritis and allied condition. – 14th ed. – Lippincott, Williams and Wilkins, Philadelphia. – 2001. – Vol. 1. – P. 1103–1127.
12. Kirwan J.R. // J. Rheumatol. – 2001. – Vol. 28, N 4. – Р. 881–886.
13. Wislowska M., Jakubics D., Stepien K. et al. // Rheumatol. Int. – 2009. – Vol. 29, N 12. – Р. 1403–1409.
Медицинские новости. – 2013. – №9. – С. 77-79.
Внимание! Статья адресована врачам-специалистам. Перепечатка данной статьи или её фрагментов в Интернете без гиперссылки на первоисточник рассматривается как нарушение авторских прав.
Источник
