Актемра от ревматоидного артрита
Комментарии
Пресс-релиз
Базель, 9 мая 2008 г.
Результаты исследования LITHE — пятого исследования III фазы по препарату Актемра, подтвердили ранее полученные данные о том, что применение этого инновационного препарата является революционным прорывом в лечении ревматоидного артрита
9 мая 2008 г., компания Рош объявила, что Актемра (тоцилизумаб) может значительно замедлять процесс структурного поражения суставов у больных ревматоидным артритом (РА), что является основным показателем эффективности лечения этого заболевания. Актемра также улучшает физическое состояние больных по истечении одного года терапии, т.е. способствует повышению качества жизни.
Результаты исследования LITHE1 показали, что применение препарата Актемра, в комбинации с метотрексатом (МТКС), в течение 12 месяцев терапии приводит к значительному подавлению структурного поражения суставов у большего процента больных по сравнению с группой пациентов, получавшей только МТКС. Этот результат имеет огромное значение для больных РА, т.к. поражение суставов, обусловленное этим заболеванием, приводит к потере трудоспособности и является основной причиной возникновения болевых ощущений. Кроме того, Актемра расширяет возможности больных по самостоятельному выполнению различных действий, необходимых в повседневной жизни и оцениваемых по опроснику оценки состояния здоровья (HAQ)2.
В ходе исследования LITHE препарат Актемра в целом хорошо переносился больными, при этом общий профиль безопасности за 12 месяцев лечения соответствовал зарегистрированным ранее данным за 6-ти месячный период исследования.
Результаты проведенного исследования являются обнадеживающей новостью для больных РА, т.к. виды и средства лечения этого заболевания, которыми располагают в настоящее время врачи, во многих случаях не дают адекватного эффекта или не переносятся больными. Для того, чтобы облегчить жизнь больных РА и остановить процесс поражения суставов, необходимо разрабатывать новые терапевтические подходы, в частности, методы, предусматривающие воздействие на разные патологические механизмы развития заболевания.
«Данные исследования LITHE подтвердили перспективность препарата Актемра как эффективного и хорошо переносимого средства лечения больных, страдающих от инвалидизирующих последствий РА» — заявил председатель совета директоров подразделения Фарма компании Рош Уильям М. Бернс. «Подавляя процесс поражения суставов и улучшая физическое состояние пациентов, Актемра не только оказывает положительное влияние на течение заболевания, но также способствует повышению качества жизни больных.»
Исследование LITHE является пятым глобальным исследованием III фазы по изучению эффективности и безопасности применения препарата Актемра у больных со среднетяжелым и тяжелым РА, успешно достигшим первичных критериев эффективности. Данные, полученные по результатам первого года этого двухлетнего исследования, будут представлены на предстоящих международных научных конференциях в области ревматологии.
Актемра — первый представитель нового класса инновационных препаратов, обладающих принципиально новым механизмом действия. Актемра является гуманизированным моноклональным антителом к рецептору интерлейкина-6 (ИЛ-6), подавляющим активность ИЛ-6 — важного фактора в развитии воспалительного процесса. Новый механизм действия приводит к снижению активности воспалительных процессов в суставах, а также снижению интенсивности системных проявлений РА.
Ревматоидный артрит — важная нерешенная медицинская проблема
По оценкам специалистов ревматоидным артритом в мире страдают более 21 млн. человек. Это прогрессирующее аутоиммунное заболевание характеризуется воспалением оболочек всех суставов человека. Воспаление приводит к деформации и нарушению функции суставов; оно сопровождается болью, тугоподвижностью и отечностью суставов, приводит к необратимому разрушению суставных тканей и, как следствие всего вышеперечисленного, потере трудоспособности. Системные проявления РА включают анемию, остеопороз, общую утомляемость. Оказывая негативное влияние на основные органы и системы, заболевание приводит к сокращению продолжительность жизни пациентов с РА. После 10 лет болезни менее 50% больных сохраняют трудоспособность и могут выполнять обычные повседневные действия.
Информация об исследовании LITHE
Исследование LITHE является международным — в нем принимают участие 15 стран и 1196 больных со среднетяжелым и тяжелым РА с отсутствием адекватного ответа на терапию МТКС. По условиям протокола больных распределяют случайным образом для получения Актемры (4 мг/кг или 8 мг/кг, одна инфузия каждые четыре недели) в комбинации с метотрексатом или только одного метотрексата. Цель исследования — продемонстрировать подавление процесса структурного поражения суставов по изменениям валидированных радиографических показателей. Также в цели исследования входит оценка изменения физического состояния больных на основании данных опросника HAQ.
Информация о препарате Актемра
Препарат Актемра — результат научных исследований компании Chugai. При участии этой компании также осуществляется и глобальная разработка препарата. Актемра является первым гуманизированным моноклональным антителом к рецептору интерлейкина-6 (ИЛ-6). Для оценки клинической эффективности препарата разработана обширная исследовательская программа, включающая пять клинических исследований III фазы. Все эти исследования успешно достигли первичных критериев эффективности. В ближайшее время ожидается регистрация Актемры в США и странах Евросоюза. В Японии Актемра появилась на фармацевтическом рынке в 2005 г. как препарат компании Chugai для лечения болезни Кастельмана. В апреле 2008 г. Актемра была зарегистрирована в Японии также по следующим показаниям: ревматоидный артрит, ювенильный идиопатический артрит и ювенильный идиопатический артрит с системным началом.
Препарат Актемра в целом хорошо переносится больными: общий профиль безопасности Актемры был одинаковым во всех глобальных клинических исследованиях. Чаще всего из нежелательных явлений регистрировали инфекции верхних дыхательных путей, назофарингит, головную боль и артериальную гипертензию. Как и при использовании других биологических препаратов для лечения РА, у больных, получавших Актемру, отмечались случаи возникновения серьезных инфекций и реакций гиперчувствительности, в том числе несколько случаев анафилаксии. У некоторых больных наблюдалось повышение активности печеночных трансаминаз (АЛТ и АСТ); это повышение в основном расценивалось как незначительное, носило преходящий характер и не сопровождалось поражением печени или снижением печеночной функции.
Информация о разработках Рош в области лечения ревматоидного артрита
Специалисты Рош считают, что одним из важнейших направлений развития в следующие несколько лет будут разработки в области лечения аутоиммунных заболеваний, первым и основным из которых является ревматоидный артрит. После выпуска на рынок препарата МабТера (ритуксимаб) в процессе разработки находится еще ряд проектов, которые могут открыть новые возможности для компании. МабТера является первым и единственным препаратом для лечения РА, селективно воздействующим на В-лимфоциты. МабТера представляет абсолютно новый терапевтический подход, при котором в качестве мишени выступают В-лимфоциты, играющие ключевую роль в патогенезе развития РА.
Актемра является вторым инновационным препаратом компании Рош. Актемра — гуманизированное моноклональное антитело к рецептору интерлейкина-6 (ИЛ-6), подавляет активность ИЛ-6 — белка, который является основным фактором воспаления при РА. Осуществляются дополнительные проекты по изучению целого ряда соединений в клинических исследованиях I, II и III фаз.
Следует также особо отметить начало III фазы клинических исследований препарата окрелизумаб — гуманизированного моноклонального антитела к CD20 рецепторам В-лимфоцитов, также предназначенного для лечения РА.
Информация о компании Рош
Группа компаний Рош, штаб-квартира которой расположена в Базеле, Швейцария, занимает лидирующее положение среди корпораций, работающих в сфере здравоохранения и ориентированных на собственные исследования в разработке лекарственных и диагностических препаратов. Как ведущая мировая биотехнологическая компания и разработчик инновационных средств для раннего выявления, профилактики, диагностики и лечения заболеваний, Группа компаний Рош вносит важный вклад в дело улучшения здоровья и качества жизни населения по широкому спектру направлений. Рош является мировым лидером в производстве средств диагностики in vitro, препаратов для лечения рака и сопутствующей терапии при трансплантации органов и тканей, занимает лидирующее положение на рынке противовирусных препаратов. Группа компаний Рош также ведет активную работу в других важных терапевтических областях, таких как аутоиммунные и воспалительные заболевания, метаболические нарушения и заболевания центральной нервной системы. В 2007 г. объем продаж подразделения «Фарма» составил 36,8 млрд. швейцарских франков, подразделения «Диагностика» — 9,6 млрд. франков. Рош имеет соглашения о научно-исследовательском сотрудничестве и стратегическом партнерстве с различными компаниями, в том числе, является основным акционером компаний Genentech и Chugai. Инвестиции в научно-исследовательские разработки в 2007 г. составили 8 млрд. швейцарских франков. В Группе компаний Рош в разных странах мира работают около 79 000 человек.
Дополнительную информацию о Группе компаний Рош можно получить в Интернете на www.roche.com.
Все товарные знаки, использованные или упомянутые в данном пресс-релизе, защищены законом.
Дополнительная информация:
— Рош и аутоиммунные заболевания: www.roche.com/med_events_mb1106
— Chugai: www.chugai-pharm.co.jp
1LITHE — TociLIzumab safety and THE prevention of structural joint damage trial (Исследование по оценке безопасности тоцилизумаба и возможности предупреждения структурного поражения суставов)
2 HAQ (Health Assessment Questionnaire Disability Index — Опросник для оценки состояния здоровья, трудоспособности) — опросник для самостоятельной оценки больными функционального статуса (трудоспособности), который используется для определения оценки показателей функциональной способности и дискомфорта за последнюю неделю. Этот инструмент широко используется во многих медицинских областях, в том числе и при РА.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
Как утверждают итальянские врачи проводящие лечение в стране, лекарство Тоцилизумаб (Актемра®) более эффективно чем гидроксихлорохин при лечении пациентов с коронавирусом COVID-19.
Последние две недели весь мир говорит о гидроксихлорохине как о чудодейственном препарате в борьбе с коронавирусом. Действительно, после контролируемого клинического исследования, проведенного врачами во Франции, было показано, что комбинация 2-х препаратов гидроксихлорохин и азитромицин (Z-Pak) излечивает пациентов с коронавирусом в течение 6 дней лечения.
ОБНОВЛЕНИЕ МАТЕРИАЛА 15 мая:
- Лечение коронавируса сегодня в мире: какие есть действующие лекарства от Covid-19, какие разрабатываются вакцины? В настоящее время в мире вакцин от коронавируса еще нет, они в разработке, но медицина стран мира уже применяет ряд лекарств от Covid-19 — это Фавипиравир, Актемра, Ремдесивир, Кевзара. Эти препараты показывают эффективность лечения пациентов с Covid-19 на основе клинических исследований в разных странах, некоторые лекарства одобрены.
- В Италии произошла удивительная история выздоровления человека от вируса COVID-19 : итальянский мужчина в возрасте 101 год, переживший пандемию испанского гриппа 1918 года и Вторую мировую войну, выздоровел от коронавируса COVID-19 и вернулся домой к семье.
Однако, как утверждают врачи, лечащие пациентов с коронавирусом в Италии, Тоцилизумаб (Tocilizumab) оказался более эффективным, чем гидроксихлорохин.
Лекарство с трудным названием — Тоцилизумаб выпускается под торговой маркой Актемра® (Actemra® ), это препарат, используемый для лечения ревматоидного артрита средней и тяжелой степени. Тоцилизумаб (Актемра) оказался настолько эффективен при лечении пациентов в Италии, что FDA дает зеленый свет для III фазы испытания этого препарата для вируса COVID-19.
 Лекарственный препарат Тоцилизумаб (Актемра)
Лекарственный препарат Тоцилизумаб (Актемра)
В другом сообщении ученые сообщают, что тоцилизумаб применяется в Китае, как было ранее показано, он помогает вылечить 95 процентов критически больных пациентов с коронавирусом. Тоцилизумаб, который продается как Актемра, принимается пациентами с ревматоидным артритом для уменьшения воспаления.
Китайские врачи во время пика эпидемии коронавируса дали лекарство Актемра 20-ти пациентам с целью исследования вируса. Девятнадцать из 20-ти пациентов выздоровели и были выписаны в течение 14 дней, несмотря на их тяжелое заболевание коронавирусом. На основании этого, лекарство Actemra® было одобрено для использования в Китае и для испытаний в США.
Клинические испытания Актемра в Китае, Италии
Актемра изучается как лечение COVID-19 в 2-х активных китайских клинических исследованиях, согласно китайскому Регистру Клинических испытаний:
- Испытание на 150 пациентах с оценкой Актемры в сочетании с фавипиравиром, антивирусным агентом широкого спектра действия ( ChiCTR2000030894 ), проведенное Хонг Чжао из Первой больницы Пекинского университета. В Китае Актемра продается как тоцилизумаб принадлежащей компании Roche Chugai Pharmaceutical, в то время как фавипиравир продается Zhejiang Hisun Pharmaceutical; Fujifilm продает этот препарат в США как Avigan ® .
- Испытание на 188 пациентах с оценкой только Актемры ( ChiCTR2000029765 ), проведенное Донгшенгом Вангом из Первой дочерней больницы Университета науки и технологии Китая (провинциальная больница Аньхой).
Третье клиническое исследование, в котором оценивалась Актемра в составе COVID-19, было отменено его исследователем с 14 марта. В этом исследовании с участием 100 пациентов ( ChiCTR2000030442 ), зарегистрированном 2 марта, Ма Сяорон, доктор философии, из Второй дочерней больницы Университета Сианя Цзяотун, должен был руководить исследовательской группой по оценке Актемры в сочетании с внутривенным иммуноглобулином (ИВИГ) и препаратом Continuous. Заместительная почечная терапия (CRRT) у пациентов с тяжелой пневмонией COVID-19.
В Италии Актемра является объектом исследования фазы II до 30 пациентов ( NCT04315480 ), предназначенного для изучения препарата в виде разовой дозы 8 мг / кг у пациентов, страдающих тяжелой пневмонией, коррелирующей с SARS-CoV2.
Исследование, проведенное исследователями из Università Politecnica delle Marche и Azienda Ospedaliera Ospedali Riuniti Marche Nord, имеет две основные меры оценки: остановка при ухудшении легочной функции и улучшение легочной функции.
 Клинические исследования препарата Актемра (tocilizumab)
Клинические исследования препарата Актемра (tocilizumab)
Обсуждение в Твиттере лекарств от коронавируса
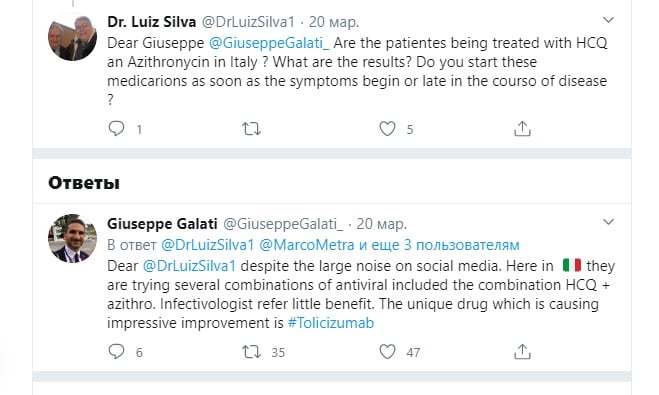
Итальянский доктор @DrLuizSilva1 задал вопрос в Твиттер: «Являются ли пациенты, получающие лечение HCQ Азитромицином в Италии? Каковы же результаты? Принимаете ли вы эти лекарства сразу же после появления симптомов или в конце течения болезни?»
В ответ на вопрос доктора о гидроксихлорохине доктор Джузеппе Галати @GiuseppeGalati_ итальянский врач, сказал в Твиттере следующее:
«Уважаемый @DrLuizSilva1, несмотря на большой шум в социальных сетях. Здесь, в Италии, они пробуют несколько комбинаций противовирусных препаратов, включая комбинацию HCQ + азитро. Инфекционисты ссылаются на малую пользу. Уникальный препарат, вызывающий впечатляющее улучшение, — это Tocilizumab». Прим.: Но написал название лекарства итальянец с ошибкой.
 Ответ в Твиттере доктора Джузеппе Галати
Ответ в Твиттере доктора Джузеппе Галати
Что известно о лекарстве Тоцилизумаб (Актемра)
Tocilizumab (Актемра®, также известный как атлизумаб, является иммунодепрессивным препаратом, главным образом для лечения ревматоидного артрита (РА) и системного ювенильного идиопатического артрита, тяжелой формы артрита у детей. Это гуманизированное моноклональное антитело против рецептора интерлейкина-6 (IL-6R).
Производителем лекарственного препарата Актемра (actemra.com) является американская биотехнологическая компания Genentech (https://www.gene.com/) Roche Group базирующаяся в Сан-Франциско, Калифорния.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, агентство Министерства здравоохранения и социальных служб США — FDA одобрило двойное слепое рандомизированное клиническое исследование III фазы препарата тоцилизумаба (Актемра) для использования в сочетании со стандартами лечения госпитализированных взрослых пациентов с тяжелой пневмонией COVID-19.
В исследование будет включено около 330 пациентов по всему миру, включая США, при этом набор пациентов должен начаться в начале апреля.
Компания Genentech также работает с Отделом перспективных исследований и разработок в области биомедицины (BARDA), входящим в состав Офиса помощника министра по вопросам готовности и реагирования в области здравоохранения и социального обеспечения США (ASPR), для оценки тоцилизумаба в сочетании со стандартом лечения.
По словам Genentech, в период исследования у пациентов будет проводиться 60-дневное рандомизированное обследование, и будет проведен промежуточный анализ для выявления ранних доказательств эффективности.
«Мы начинаем клиническое испытание для изучения Актемры для лечения людей, госпитализированных с пневмонией COVID-19, чтобы мы могли лучше определить потенциальную роль Актемры в борьбе с этим заболеванием» — Леви Гарравей, доктор медицинских наук, главный врач Genentech и глава Global Product Development.
Из заявления доктора: «В эти беспрецедентные времена сегодняшнее объявление является важным примером того, как отрасль и регулирующие органы могут быстро сотрудничать в борьбе с пандемией COVID-19, и мы поделимся результатами как можно скорее».
В пресс-релизе Genentech говорится, что компания предоставляет 10000 флаконов тоцилизумаба для национального стратегического запаса США для потенциального будущего использования, как определено Министерством здравоохранения и социальными службами США.
 Биотехнологическая компания Genentech производит лекарство Актемра
Биотехнологическая компания Genentech производит лекарство Актемра
«Мы благодарим FDA за быстрое ускорение утверждения этого клинического испытания для оценки Актемры у критически больных пациентов, страдающих пневмонией после коронавирусной инфекции, и мы движемся вперед, чтобы зарегистрироваться как можно быстрее», — говорит Александр Харди, генеральный директор Genentech. сказано в пресс-релизе.
«Проведение этого клинического испытания в партнерстве с BARDA и предоставление Actemra для поддержки национальных запасов усилиями секретаря Азара и HHS являются важными примерами того, как правительство США, биотехнологическая отрасль и сообщества здравоохранения работают вместе в ответ на это общественное здравоохранение. кризис», добавил Харди.
«На сегодняшний день в мире началось несколько независимых клинических испытаний для изучения эффективности и безопасности Актемры для лечения пациентов с пневмонией COVID-19. Тем не менее, это новое исследование является жизненно важным, потому что нет хорошо контролируемых исследований и ограниченных опубликованных данных о безопасности или эффективности Актемры при лечении пациентов, страдающих от COVID-19».
Источник
