Амиотрофия при ревматоидном артрите

Мышцы поражаются у большинства больных РА. Мышечная слабость и атрофия отмечаются не менее чем у 75% больных. Причиной этих симптомов служит уменьшение мышечной активности в связи с болью в суставах и особенно их контрактурами. Эта причина, однако, не может считаться единственной. Еще в 1873 г. J. Paget писал, что мышечная атрофия при РА пропорциональна не столько ограничению движений, сколько выраженности боли.
Спустя почти столетие J. De Andrade (1968) доказал в эксперименте, что атрофия мышц у животных с артритами выражена сильнее, чем вызванная иммобилизацией. О том же свидетельствуют частые клинические наблюдения, касающиеся быстро развивающейся амиотрофии при тяжелом РА. Темпы ее развития при этом более быстрые, чем при обычной иммобилизации, тем более что в подобных случаях общий объем движений часто остается немалым.
Поэтому основными причинами мышечной патологии у больных РА следует считать как ограничение мускульной активности, так и катаболическое влияние воспалительного процесса (возможно, опосредуемое эффектом интерлейкина-1 и фактором некроза опухоли, вырабатываемых макрофагами). Последнее может значительно усугубляться сопутствующей лихорадкой, частым ухудшением аппетита, нерациональным питанием (в частности, бедным белками).
Несомненно, что у ряда больных возникает и собственно ревматоидный миозит, имеющий, однако, в большинстве подобных случаев весьма малое клиническое значение. Для его диагностики определяющую роль играет сочетание мышечных самостоятельных болей (особенно в сочетании с болью при пальпации соответствующих мышц), нарастание в крови уровня «мышечных» ферментов (трансаминаз, альдолазы и особенно креатинфосфокиназы) и воспалительных изменений при гистологическом исследовании мышечных биоптатов.
Трактовка данных биопсий вне связи с клиническими и биохимическими показателями должна быть очень осторожной. Микроскопический анализ мышечной ткани нередко обнаруживает сосудистые изменения и клеточные инфильтраты, формально соответствующие представлениям о воспалении, у лиц без какой-либо мышечной патологии. Возможно, что речь идет о реакции на транзиторные физиологические сдвиги (большее накопление молочной кислоты и т. д.).
Не подтвердилось также мнение об относительной специфичности для РА так называемого узелкового полимиозита, представляющего собой узелковые клеточные инфильтраты диаметром 1—2 мм, обильно рассеянные в эндомизии и перимизии и состоящие из скоплений лимфоцитов и плазматических клеток, в редких случаях — тучных клеток, нейтрофилов и эозинофилов. L. Sokoloff и соавт. (1950) показали, что подобные изменения наблюдались у 56% больных РА, у 29% больных неревматическими заболеваниями и у 23% здоровых.
Повышение уровня мышечных ферментов в крови имеет большое значение для диагноза ревматоидного миозита. Однако необходимо принимать во внимание, что содержание этих ферментов у больных РА может повыситься также вследствие внутримышечных инъекций, мышечной биопсии, индивидуальных реакций на некоторые лекарства (хлорохин, ацетилсалициловая кислота, D-пеницилламин) и даже значительной физической нагрузки. В связи с этим диагностика ревматоидного миозита надежна лишь при сочетании клинических симптомов с ферментемией и гистологическими воспалительными изменениями или (что менее убедительно) при комбинировании двух компонентов этой триады.
Четко очерченный синдром миозита у больных РА редок. Относительно чаще он встречается при ревматоидном васкулите, однако и в этих случаях (при локализации васкулита в мышцах) его клиническое значение обычно невелико. Поэтому особый интерес вызывает наблюдение Г. Н. Жуковской (1987) больного классическим серопозитивным и эрозивным РА (без васкулита), у которого миозит в течение длительного времени настолько превалировал над суставными проявлениями, что правильный диагноз был поставлен более чем через год.
Необходимо иметь в виду, что заметная мышечная патология у больных РА в редких случаях может быть связана с влиянием некоторых лекарств. Так, глюкокортикостероиды (прежде всего содержащие фтор — триамцинолон, дексаметазон), особенно при их длительном назначении в больших дозах, вызывают у отдельных больных так называемую стероидную миопатию. Ее симптомы обычно развиваются постепенно и относятся преимущественно к проксимальным мышцам ног, а затем и рук (боли, быстрая утомляемость, затруднения при подъеме на лестницу и при вставании с низкого стула).
Эти симптомы нередко оцениваются как признаки обострения основного заболевания, что ведет к увеличению дозы стероидов и тем самым к усугублению миопатических проявлений. Уровень сывороточных мышечных ферментов при стероидной миопатии нормален. Ценный лабораторный признак — повышенное выделение креатина с мочой. При гистологическом исследовании мышц не обнаруживают достоверных воспалительных изменений; отмечаются лишь неспецифические дистрофические симптомы — потеря поперечной исчерченности, атрофия волокон и т. д. После уменьшения дозы гормональных препаратов и особенно полной отмены их признаки стероидной миопатии исчезают, чему способствует лечебная физкультура, направленная на упражнения для соответствующих мышц.
Назначение D-пеницилламина у некоторых больных может вызвать патологию мышц двух различных типов. Относительно чаще встречается синдром миастении (myasthenia gravis). Он проявляется в постепенном нарастании слабости различных мышечных групп с соответствующими функциональными нарушениями (слабость, утомляемость, диплопия, нарушения глотания и речи, птоз, затруднения при выполнении простых движений).
Повышения уровня мышечных ферментов в крови и гистологической картины миозита не наблюдается. У некоторых больных . определяются антитела к тканевым компонентам мышечных поперечных полос и к ацетилхолиновым рецепторам мышц (последнее обстоятельство может быть непосредственной причиной мышечной слабости). После отмены D-пеницилламина симптомы миастении постепенно исчезают; при недостаточном восстановлении мышечной силы назначают прозерин.
У единичных больных при назначении D-пеницилламина описано развитие истинного полимиозита с миалгиями, слабостью проксимальных мышц конечностей, нарастанием уровня мышечных ферментов и характерной гистологической картиной (инфильтрация лимфоцитами и макрофагами, участки дегенерации и регенерации мышечных волокон). Для лечения этого осложнения необходимо отменить D-пеницилламин, в серьезных случаях — назначить глюкокортикостероиды.
Хлорохиновая миопатия также представляет собой очень редкое лекарственное осложнение. Она характеризуется постепенно прогрессирующей слабостью проксимальных мышц ног, затем — рук, позже — более дистальных мышечных групп. Уровень мышечных ферментов в крови может быть повышен. Характерный гистологический признак — вакуолизация мышечных волокон. Отмена хлорохина приводит к полному, но медленному выздоровлению.
Назначение гидроксихлорохина (плаквенила) не вызывает миопатии. Таким образом, в основе изменений мышц при РА могут лежать принципиально различные причины: миозит, атрофия вследствие недостаточных упражнений, вызванные воспалительным процессом катаболические сдвиги в обмене веществ, недостаточное белковое питание и, наконец, редкие и сугубо индивидуальные (возможно, генетически обусловленные) реакции на определенные лекарственные препараты.
Поэтому в каждом конкретном случае явной мышечной патологии у больного РА необходим соответствующий клинический и анамнестический анализ с определением в крови уровня мышечных ферментов; по показаниям проводят биопсию наиболее пораженных отделов мышц.
Сигидин Я.А.
Опубликовал Константин Моканов
Источник
Ревматоидный артрит представляет собой системное
иммуновоспалительное заболевание соединительной ткани, проявляющееся
хроническим эрозивно-деструктивным полиартритом с преимущественно
симметричным поражением суставов кистей и стоп и сопровождающееся у
большинства больных образованием особого вида аутоантител (ревматоидный
фактор). Женщины болеют в 3–4 раза чаще мужчин, причем заболевание у
них начинается обычно в возрасте 35–45 лет.
Болезненные, тугоподвижные суставы не только мешают выполнять самые
простые повседневные движения, но и значительно нарушают ритм
нормальной жизни.
Ревматоидный полиартрит — тяжелое системное заболевание, которое
проявляется прогрессирующим воспалительным синовитом, симметрично
поражающим периферические суставы конечностей.
В соответствии с рекомендациями Американской ревматологической
ассоциации (1987) при диагностике ревматоидного артрита целесообразно
придерживаться следующих критериев:
- утренняя скованность суставов или вблизи суставов длительностью не менее 1 ч до ее полного исчезновения;
- опухание
мягких тканей (артрит) трех суставов или более, наблюдаемое врачом (т.
е. в период осмотра или в анамнезе под наблюдением врача); - опухание (артрит) проксимальных межфаланговых, пястно-фаланговых или запястных суставов;
- симметричное опухание (артрит) как минимум в одной паре суставов;
- ревматоидные узелки;
- наличие ревматоидного фактора;
- обнаружение при рентгенологическом исследовании эрозий и (или) периартикулярного остеопороза в суставах кистей и стоп.
При длительно текущем заболевании деформируются пораженные суставы.
Помимо суставов, при ревматоидном полиартрите нарушаются околосуставные
структуры (связки, сухожилия и др.), развиваются ревматоидный васкулит
(поражение мелких сосудов), остеопороз, происходит поражение внутренних
органов.
В пользу иммунопатологического/аутоиммунного характера
воспалительного процесса при ревматоидном артрите свидетельствует
обнаружение у большинства больных в сыворотке крови и синовиальном
выпоте из пораженных суставов аутоантител — ревматоидного фактора.
Большое значение в развитии ревматоидного артрита имеет генетическая
предрасположенность. Это подтверждается выраженной семейной агрегацией
заболевания, наличием у части больных ревматоидным артритом антигенов
II класса главного комплекса гистосовместимости HLA DR4 и Dw4 (с
носительством которых связывают тяжелое течение артрита и быстрое
прогрессирование эрозивных изменений суставов). Рассматривается роль
наследственных или приобретенных нарушений Т-супрессорной регуляции
иммунных реакций, недостаточной функции моноцитарно-макрофагальной
системы. Пусковую роль в развитии ревматоидного артрита могут играть:
хронические очаги инфекции, гормональная перестройка организма, пищевая
аллергия, предшествующие травмы суставов, длительное воздействие
влажного холода и физическое перенапряжение.
При хроническом воспалении у края суставного хряща в месте
прикрепления к эпифизам суставной капсулы происходит разрушение и
замещение паннусом участков субхондральной костной ткани с образованием
эрозий. Иногда разрастающиеся грануляции проникают через субхондральную
замыкательную пластинку в костную ткань. Продукты костно-хрящевой
деструкции, в свою очередь, оказывают раздражающее воздействие на
синовиальную оболочку, что способствует поддержанию в ней
воспалительного процесса. Одновременно возникают воспалительные
изменения в капсуле сустава, связках, синовиальной выстилке сухожилий и
синовиальных сумках с последующим их склерозированием, приводящему к
стойкому ограничению подвижности пораженных суставов, подвывихам и
контрактурам. Иногда наблюдается некроз и разрыв сухожилий,
синовиальных сумок. Нередко отмечается развитие вторичного
остеоартроза.
Воспалительный процесс при ревматоидном артрите характеризуется
неуклонным прогрессированием, темпы которого зависят от активности
воспалительного процесса. Даже в периоды клинической ремиссии в
синовиальной оболочке сохраняются признаки воспаления. Постепенно
паннус разрушает хрящ на значительной поверхности эпифиза, а замещающая
его грануляционная ткань соединяет между собой противоположные
суставные поверхности и в последующем трансформируется вначале в
фиброзную, а затем в костную ткань, что приводит к образованию
соответственно фиброзного и костного анкилоза, обусловливающего полную
неподвижность пораженных суставов.
При рентгенологическом исследовании суставов отмечается
асимметричность эрозивных изменений с частым и ранним анкилозированием
суставов запястий.
Течение серонегативного ревматоидного артрита менее тяжелое, в
прогностическом плане более благоприятное, чем при серопозитивной форме
заболевания: слабее выражены деструктивные (эрозивные) изменения и
функциональные нарушения суставов, реже наблюдаются ульнарная девиация
пальцев кистей, контрактуры и анкилоз (за исключением анкилоза суставов
запястья). Вместе с тем серонегативный ревматоидный артрит хуже, чем
серопозитивный, поддается терапии базисными и иммуносупрессивными
препаратами. Чаще развивается вторичный амилоидоз.
При лечении ревматоидного артрита используются НПВП, в тяжелых
случаях применяются глюкокортикостероиды, иммуносупрессоры, с целью
профилактики остеопороза обычно назначают комбинацию препаратов кальция
и витамина D.
Несмотря на все успехи фармакологии, ревматоидный артрит до настоящего
времени остается тяжелым заболеванием с неблагоприятным прогнозом.
Приведем пример из личного опыта ведения больной с ревматоидным артритом, представляющим, по мнению автора, научный интерес.
Больная В., возраст — 71 год, обратилась к неврологу в августе 2006
г. с жалобами на боли в суставах кистей, коленных суставах, в пояснице.
Боль в суставах беспокоила днем и ночью, обычно была выраженной,
нередко мигрирующей, обусловливала ограничение всех активных и
пассивных движений в пораженных суставах. Артралгия зачастую сочеталась
с выраженной миалгией, оссалгией, болями в сухожилиях. Из анамнеза:
проявления полиостеоартроза в течение 15 лет, дебют суставного синдрома
воспалительного характера в июне 2002 г. (отек и воспаление в области
суставов, фебрильная лихорадка, подтвержденная лабораторно активность
воспалительного процесса). Амбулаторно (сначала периодически, в
последние 3 года постоянно) получала НПВП (ибупрофен, индометацин,
диклофенак, ацеклофенак). С 2004 г. регулярно принимала кальций D3 (1 г
кальция в сутки).
 |
| Рис. 1. Рентгенограмма кистей больной В. 2003 г.: проявления полиостеоартроза, явных эрозий нет. Рис. 2. Рентгенограмма кистей больной В. 2006 г.: множественные кисты и эрозии, отрицательная динамика с 2003 г. |
Стационарно проходила лечение в городском ревматологическом центре
г. Санкт-Петербурга (апрель 2003 г., июнь–июль 2006 г.) с диагнозом:
ревматоидный артрит, серопозитивный, с системными проявлениями
(субфебрилитет, амиотрофия, миалгии), активность 2-й степени,
функциональная недостаточность суставов 1–2-й степени. Сопутствующая
патология: ишемическая болезнь сердца, стенокардия II ФК.
Гипертоническая болезнь 3-й степени, ОНМК (декабрь 2002 г.).
Хронический бронхит вне обострения. Диффузный зоб второй стадии.
Эутиреоз. Полиостеоартроз. Желчно-каменная болезнь.
С 2003 г. постоянно получает метотрексат в дозировке 2,5 мг 2 раза в
неделю. Несмотря на проводимое лечение, суставной болевой синдром
нарастал, учащались обострения, ухудшалось состояние костей
(остеопороз, эрозии). Показательна рентгенография кистей (рис. 1–2).
 |
| Рис. 3. Рентгенограмма кистей больной В. 2007 г.: проявления полиостеоартроза, положительная динамика с 2006 г. |
С августа 2006 г. на фоне лечения метотрексатом неврологом был
дополнительно назначен Структум в дозировке 500 мг 2 раза в день.
Больная ориентирована врачом на длительный, до полугода, прием
препарата. Некоторое уменьшение интенсивности (непрекращающегося в
течение 2 последних месяцев) болевого синдрома наступило через 3 нед.
Эпизоды обострений ревматоидного артрита были в течение 4 мес. К концу
5-го месяца комбинированной терапии (метотрексат + Структум) болевой
синдром значительно снизился, уменьшилась утренняя скованность, спала
отечность лучезапястных и коленных суставов.
В феврале 2007 г. была сделана рентгенография кистей (рис. 3).
Результат сравнения с предыдущими рентгенографиями оказался более чем
положительным (уменьшились эрозии костей). Прием структума продлен на 3
мес. По состоянию на май 2007 г. обострений суставного синдрома не
наблюдалось в течение 4 мес, сохранялась небольшая отечность на
лучезапястных (больше слева) и коленных суставах. С целью коррекции
противоревматической терапии (снижение дозы метотрексата) больной
рекомендована консультация в городском ревмоцентре.
И. Н. Бабурин
СПбНИПНИ им. В. М. Бехтерева, Санкт-Петербург
Источник
Ревматоидный артрит (РА) – хроническое системное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу эрозивно-деструктивного полиартрита, с возможным развитием полиорганного поражения и тяжелых осложнений, таких как вторичный амилоидоз. РА представляет собой наиболее распространенное аутоиммунное заболевание, регистрируется во всех странах мира и во всех климатогеографических зонах, во всех возрастных, расовых и этнических группах, поражая 0,5–2% взрослого населения в наиболее работоспособном возрасте – 35–55 лет [1–3]; женщины болеют чаще чем мужчины (соотношение женщин и мужчин 3:1). По данным 2012 г., заболеваемость РА в РФ составляет 241,3 на 100 тыс. населения [4].
Основными клиническими проявлениями РА являются суставные поражения в виде эрозивного артрита с болью и припухлостью пораженных суставов, утренняя скованность, образование ревматических узелков. В развернутых стадиях заболевания возникают деформации пораженных суставов, повреждения связочного аппарата и синовиальной сумки. Помимо поражения суставов для пациентов с РА характерно развитие системных внесуставных проявлений, таких как ревматоидный васкулит, плеврит, перикардит, синдром Фелти, периферическая полиневропатия, поражение глаз, гломерулонефрит [5].
Наиболее характерным проявлением заболевания, наряду с прогрессирующим поражением суставов, потерей подвижности, утомляемостью, внесуставными проявлениями, является хронический болевой синдром, локализованный обычно в области суставов. Именно хронический болевой синдром служит ведущей жалобой пациентов и оказывает решающее влияние на снижение качества жизни. Боль рассматривают как показатель активности болезни, и в то же время активность заболевания не всегда является предиктором интенсивности боли и нарушения функции суставов.
Неврологические нарушения при РА
В настоящее время существует ряд клинико-экспериментальных исследований, демонстрирующих роль неврогенных механизмов в патогенезе болевого синдрома при РА [6–8]. Наряду с клиническими признаками воспаления у пациентов с РА наблюдаются специфические сенсорные феномены, характерные для невропатической боли [9–11].
Среди неврологических нарушений при РА наиболее часто выявляется поражение периферической нервной системы (ПНС) [12]. Американскими ревматологами было проведено клиническое, электрофизиологическое и патоморфологическое исследование ПНС у 108 больных РА. У 62 обследованных (57,4%) выявлены электрофизиологические доказательства наличия невропатии. Среди них 53 (85,5%) имели чисто сенсорную или сенсомоторную аксональную невропатию, а 9 (14,5%) – демиелинизирующую полиневропатию. Синдром запястного канала выявлен у 11 из 108 больных. Поражения ПНС имели разнообразную клиническую картину: боль, парестезии, моторные и сенсорные нарушения. Авторы обращали внимание на то, что эти симптомы могут имитировать суставную боль или сопровождать ее. Однако не было получено данных о взаимосвязи неврологических проявлений с длительностью заболевания, наличием эрозий, деформаций суставов и приемом противовоспалительных препаратов [13].
В целом, по данным литературы, частота неврологических осложнений у больных РА имеет большой разброс (от 0,5 до 85%) и представлена преимущественно полиневропатией (сенсорной, моторной или сенсомоторной), а также множественными мононевропатиями, шейной миелопатией или туннельным синдромом [14–18].
Полиневропатия, при которой поражаются как двигательные (моторные), так и чувствительные (сенсорные) волокна, выявляется более чем в 50% случаев. На сегодняшний день трудными для диагностики остаются моторные нарушения, поскольку имеющиеся деформации суставов с ограничением активных и пассивных движений, сопутствующей мышечной атрофией зачастую препятствуют определению причины пареза: патология суставов или патология периферических нервов. Полиневропатия характерна больше при длительном течении болезни [11, 13, 18].
Основной причиной поражения ПНС являются васкулит и ишемия сосудов, питающих периферические нервы. Диагностика поражения ПНС основывается на чувствительных нарушениях в дистальных отделах конечностей, снижении поверхностной и глубокой чувствительности, данных стимуляционной электронейромиографии (ЭНМГ) (снижение скорости распространения возбуждения по моторным и сенсорным волокнам и М-ответа в дистальных отделах конечностей).
В 2012 г. нами проведено исследование с целью выявить нейропатический компонент боли (НКБ) у больных с РА. Обследовано 183 пациента с достоверным РА, (средний возраст 46,5±11,7 года) с длительностью заболевания от 3-х месяцев до 30 лет (в среднем 9,1±7,6 года) [19]. По данным опросника DN4 для диагностики вида боли, 73 пациента (43%) набрали 4 и более баллов, что свидетельствует о нейропатическом характере боли (рис. 1).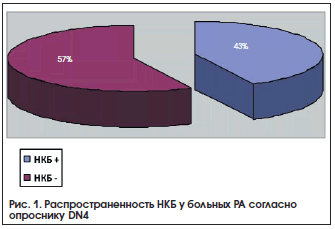
Статистический анализ 2-х групп пациентов – с НКБ (НКБ+) и без НКБ (НКБ–) – показал, что с увеличением возраста больного, длительности заболевания, клинической стадии и снижением функциональных возможностей возрастает вероятность наличия НКБ у больного. Причем индекс DAS28, позволяющий определить активность болезни и эффективность терапии при РА, и СОЭ не являются предикторами боли.
Анализ болевого синдрома с помощью наиболее популярного в России опросника DN4 [20] выявил различные качественные характеристики хронического болевого синдрома у пациентов с РА. Наиболее частыми дескрипторами невропатической боли были прострелы, похожие на удар током (51%), ползание мурашек (40%), покалывание (54%) и онемение (57%).
Исследование неврологического статуса выявило у пациентов с НКБ в 96% случаев поражение ПНС, которое было представлено дистальной сенсомоторной полиневропатией (55%), туннельным синдромом (14%), мононевропатией (19%), шейной миелопатией (4%), сочетанием полиневропатии с туннельным синдромом (4%). Лишь у 4% поражение ПНС отсутствовало [21]. Полиневропатия чаще выявлялась у пациентов более старшего возраста, длительно болеющих РА, что подтвердило данные зарубежных коллег (рис. 2).
Для подтверждения полиневропатии пациентам проведена стимуляционная ЭНМГ, которая выявила преимущественное снижение скорости распространения возбуждения и амплитуды М-ответа в дистальных отделах конечностей, что позволило говорить о наличии у них смешанного типа поражения ПНС – аксонального и демиелинизирующего.
Основные принципы терапии невропатической боли при РА
Проведенное нами исследование показало, что хронический суставной болевой синдром при РА носит смешанный характер. Наряду с ноцицептивным компонентом, обусловленным воспалением, у 43% пациентов преобладает НКБ, что требует комплексной терапии. Наряду с НПВП, базисной противовоспалительной, глюкокортикостероидной и генно-инженерной биологической терапией, направленной на основное заболевание и ноцицептивный компонент, необходимо рассмотреть терапию нейропатического компонента. Согласно международным рекомендациям, наряду с вышеуказанными препаратами, для лечения НКБ необходимо использовать препараты центрального действия (анктиконвульсанты и антидепрессанты) и витамины группы В.
В течение многих лет ученые занимаются клиническими исследованиями применения при различных неврологических заболеваниях витаминов группы В, прежде всего витаминов В1 (тиамин), В6 (пиридоксин) и В12 (цианокобаламин), обладающих определенным механизмом действия.
• Тиамин (В1) оказывает репаративное действие на пораженные нейроны, а также замедляет прогрессирование поражения сосудистого русла.
• Пиридоксин (В6) оказывает нейротропное действие (активируя синтез миелиновой оболочки нервного волокна и транспортных белков в аксонах, ускоряет процесс регенерации периферических нервов) и противоболевое действие.
• Цианокобаламин (В12) активно влияет на энергообеспечение клеток, синтез белка, регенерацию нервной ткани [22–24].
На сегодняшний день уже не ставится под сомнение анальгетический эффект этих витаминов [22, 25, 26] и целесообразность их использования в лечении болевых синдромов с сенсорными нарушениями, а также в комплексной терапии невропатической боли с применением Габапентина [27, 28]. В 2016 г. A. Mimenza и S. Aguilar провели исследование с применением антиконвульсантов и витаминов В1 и В12 у больных с диабетической полиневропатией. В течение 12 нед. пациентам с болевой формой диабетической полиневропатии проводили терапию по 2-м схемам: 1) Габапентин 300–3600 мг + В12 (20 мг) и В1 (100 мг); 2) Прегабалин 75–600 мг. Достоверное снижение выраженности болевого синдрома получено в обеих группах, однако комбинация Габапентина с витаминами В1 и В12 позволила использовать меньшие дозы антиконвульсанта, что является немаловажным аспектом.
Спектр заболеваний нервной системы, при которых патогенетически обосновано применение витаминов группы В, разнообразен. Полиневропатия как основной этиологический фактор периферической нейропатической боли у больных с РА – один из основных показаний к применению витаминов группы В.
Оригинальным препаратом, содержащим комплекс витаминов В1, В6, В12, является Нейробион (МЕРК), он оказывает тройное действие на нейроны: нормализует обмен углеводов (за счет витамина В1); увеличивает синтез нейромедиаторов (за счет витамина В6); стимулирует синтез защитной миелиновой оболочки (за счет витамина В12). Препарат выпускается в 2-х формах: инъекционной и таблетированной, при этом отсутствие в препарате лидокаина снижает риск развития аллергии.
Показания к применению препарата Нейробион (МЕРК):
• нейропатическая боль при полинейропатии;
• болевой синдром при заболеваниях позвоночника (люмбоишиалгия, плексопатия, корешковый синдром, вызванный дегенеративными изменениями позвоночника);
• невриты и невралгии (невралгия тройничного нерва, неврит лицевого нерва, межреберная невралгия).
Схемы применения препарата Нейробион (МЕРК) различаются в зависимости от интенсивности болевого синдрома. При выраженном болевом синдроме лечение целесообразно начинать с внутримышечного введения 3 мл/сут (1 ампула) до снятия острых симптомов. После уменьшения выраженности симптомов или при умеренной их тяжести назначают по 3 мл (1 ампула) 3 р./нед. в течение 2–3-х недель. В целях профилактики рецидива рекомендуется поддерживающая схема: внутрь по 1 таблетке 1–3 р./сут в течение 1–1,5 мес. или по назначению врача.
Следует обратить внимание, что при длительном курсе терапии (18 нед.) диабетической полиневропатии витаминами группы В не наблюдалось побочных эффектов, которые могли бы свидетельствовать о передозировке препарата [29].
Синергическое взаимодействие препаратов с различными механизмами действия обусловливает больший болеутоляющий эффект при меньших неблагоприятных явлениях.
Источник
