Антитела днк ревматоидный артрит
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Сабирзянова А.З. 1 Невзорова Т.А. 1
1 ГОУ ВПО «Казанский (Приволжский) федеральный университет», Казань, Россия
В работе показано, что положительно заряженные низкоаффинные и высокоаффинные антитела класса IgG к нативной ДНК (IgG-АТ к нДНК) доноров и больных системной красной волчанкой (СКВ) на стадии обострения заболевания оказывают сходное генотоксическое воздействие на лимфоциты здоровых лиц in vitro. АТ к ДНК больных СКВ на стадии обострения, обладающие ДНК-гидролизующей активностью, проявляют более выраженную генотоксичность в культуре лимфоцитов. Обнаружено, что спектр генотоксичных субфракций в сыворотке крови больных ревматоидным артритом шире, чем в норме и при СКВ, и представлен высокоаффинными IgG-АТ к нДНК. В статье обсуждаются возможные причины генерации патологических АТ класса IgG к нДНК и их биологическая роль в организме.
антитела к ДНК
лимфоциты
системная красная волчанка
ревматоидный артрит
генотоксичность
1 Акберова Н.И. Сравнение данных. II Непараметрические критерии значимости : методическое пособие. — Казань : Издательство КГУ, 2004. — 50 с.
2. Анисимов А.Г. Обработка синхронизированных клеток К562 тетрафторалюминатом не модулирует флуоресценцию бромистого этидия и 4,6-диамидино-2-фенилиндола при связывании с нуклеоидной ДНК / А.Г. Анисимов, И.А. Болотников // Цитология — 1999. — Т. 41. — № 8. — С. 680-684.
3. Арлеевская М.И. Диагностические и прогностические маркеры ревматоидного артрита с точки зрения патофизиолога / М.И. Арлеевская, А.Г. Габдулхакова, А. Цибулькин. — Казань : Шип, 2010. — 128 с.
4. Невзорова Т.А. Происхождение и биологическая роль аутоантител к ДНК / Т.А. Невзорова, В.Г. Винтер // Учен. зап. Казан. ун-та. Сер. Естеств. науки. — 2006. — Т. 148. — Кн. 3. — С. 35-52.
5. Сабирзянова А.З. Влияние антител класса IgG к нативной ДНК на моноциты человека in vitro / А.З. Сабирзянова, Т.А. Невзорова // Учен. зап. Казан. ун-та. Сер. Естеств. науки. — 2008. — Т. 150. — Кн. 2. — С. 186-200.
6. Ardoin S.P. Developments in the scientific understanding of lupus / S.P. Ardoin, D.S. Pisetsky // Arthritis Re & Therapy. — 2008. — Vol. 10. — № 5. — Р. 218-225.
7. Gabibov A.G. Catalytic autoantibodies in clinical autoimmunity and modern medicine // Autoimmun Rev. — 2006. — Vol. 5. — № 5. — Р. 324-330.
8. Kubota T. Enhancement of oxidative cleavage of DNA by the binding sites of two anti-double-stranded DNA antibodies // J. Biol. Chem. — 1996. — Vol. 271. — № 11. — P. 6555-6561.
9. Rivadeneyra-Espinoza L. Cell-penetrating anti-native DNA antibodies trigger apoptosis through both the neglect and programmed pathways / L. Rivadeneyra-Espinoza, A. Ruiz-Argüelles // J Autoimmun. — 2006. — Vol. 26. — № 1. — Р. 52-56.
10. Yang R. Autpreactive murine Th1 and Th2 cells kill syngeneic macrophages and induce autoantibodies // Lupus. — 2001. — Vol. 10. — P. 539-541.
Лимфоциты — основные клетки иммунной системы, обеспечивающие гуморальный иммунитет и регулирующие взаимодействие и функционирование клеток в сложном многоклеточном организме в процессе иммунного ответа.
Нарушение функциональной активности Т- и В-лимфоцитов отражается в развитии разнообразных форм иммунонедостаточности.
Системная красная волчанка (СКВ) и ревматоидный артрит (РА) — это хронические аутоиммунные заболевания (АИЗ) с неясной этиологией и обширной картиной иммунопатогенеза, снижают качество и продолжительность жизни населения, поэтому входят в число важных биомедицинских и социальных проблем современности [4; 3].
Для больных СКВ характерно повышение уровня IgG-АТ к нДНК, которые обладают ДНК-гидролизующей активностью [4; 5] и, вероятно, являются участниками патологического процесса. Но на сегодняшний день среди исследователей нет единого мнения о вкладе АТ к нДНК в развитие и течение АИЗ.
При РА также наблюдается повышение уровня ДНК-гидролизующих АТ, но клинические признаки отличаются от СКВ [3; 7]. Следовательно, течение патологического процесса может определяться не только уровнем АТ к ДНК, но и их свойствами, различающимися при разнообразных АИЗ.
Исследования последних лет показали, что некоторые АТ к ДНК проникают внутрь клеток и влияют на внутриклеточные процессы [9].
Можно высказать предположение, что IgG-АТ к нДНК, взаимодействуя с ДНК клеток и изменяя структуру хроматина, приводят к нарушению апоптоза иммунокомпетентных клеток, следствием чего является увеличение апоптотического материала и времени его циркуляции в кровотоке, что наблюдается при СКВ и усугубляет течение аутоиммунного процесса.
Целью работы явилось исследование генотоксичности антител класса IgG к нативной ДНК в первичной культуре лимфоцитов здоровых лиц.
Материалы и методы исследования
Выделение IgG-АТ к нДНК из сыворотки крови человека
Все этапы очистки выделения и очистки IgG-АТ к нДНК из сывороток доноров и больных СКВ и РА проводили по ранее разработанной методике [4]. В работе использовали АТ к ДНК сывороток крови лиц женского пола — 20 сывороток здоровых доноров, 7 сывороток больных СКВ и 20 сывороток больных РА в период обострения заболевания, полученные в медицинских учреждениях г. Казани. Диагноз СКВ и РА был поставлен квалифицированными ревматологами ГОУ ДПО «Казанская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию».
Выделение лимфоцитов из цельной крови здоровых лиц проводили по стандартной методике на фиколл-верографине — плотность 1.077 мг/мл [10].
Культивирование лимфоцитов в присутствии IgG-АТ к нДНК
К клеткам (2•104 клеток/лунку), разведенным полной средой RPMI-1640 рН 7.4 (Gibco, Scotland), содержащей 10% инактивированной эмбриональной бычьей сыворотки, 2 мМ глутамина («Serva», Germany), 100 ед/мл пенициллина (Россия), 100 мкг/мл стрептомицина (Россия), добавляли очищенные субфракции IgG-АТ к нДНК до конечной концентрации 1 мкг/мл. Каждый опыт повторяли трижды. Клетки инкубировали при 37 ºС, 0.5% СО2 в течение 72 часов.
Общее количество и количество жизнеспособных лимфоцитов после выделения из цельной крови и инкубации с субфракциями IgG-АТ к нДНК определяли методом исключения трипанового синего.
Определение уровня повреждения ядерной ДНК клеток после культивирования с субфракциями IgG-АТ к нДНК проводили методом флуоресцентной спектрофотометрии по изменению интенсивности флуоресценции комплекса ЭБ-ДНК хроматина лимфоцитов [2].
Определение уровня повреждения ядерной ДНК методом гель-электрофореза лизированных единичных клеток — «ДНК-комет»
Использовали 1%-ный раствор легкоплавкой агарозы («Fermentas», Canada) в ФСБ. На предметное стекло, покрытое полилизином («ApexLab», Россия), наносили 60 мкл агарозного геля с клетками (2•104 — 5•104), равномерно распределяли и оставляли на 30 минут при +20 °С. Лизис клеток (10 мM Tris-HCl pH 10, 2.5 M NaCl, 100 мM EDTA-Na2, 1% Triton X-100, 5% DMSO, +4 °С) проводили в течение 1 часа. Затем стекла переносили в электрофорезный буфер (300 мM NaOH, 1 мM EDTA-Na2, pH>13, +4 °С) и оставляли на 20 минут. Электрофорез проводили 20 минут при 1 В/см и 300 мА. По окончании препараты переносили в раствор для фиксации (70%-ный этиловый спирт) на 15 минут, после чего высушивали при +20 °С (1-2 часа). В качестве положительного контроля для визуализации деградации ДНК использовали клетки, инкубированные в течение 5 минут при -20 °С в присутствии 100 мкМ Н2О2. Препараты окрашивали акридиновым оранжевым (20 мкг/мл) в течение 30 минут и анализировали на флуоресцентном микроскопе (AxioScope A1, «Сarl Zeiss», Germany) с соответствующими фильтрами (возбуждающий фильтр 490 нм, дихроичное зеркало 510, отсекающий фильтр 530 нм), увеличение 40х.
Статистическая обработка данных
Из полученных данных изменения жизнеспособности и интенсивности флуоресценции ЭБ-ДНК клеток вычисляли медиану, 97,5 и 2,5 перцентили, используя стандартный пакет программ Excel Office 2003, дополнительно использовали критерий Даннета [1].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Повышение уровня ДНК-гидролизующих АТ наблюдается при СКВ и РА, но клиническая картина заболеваний отличается [4; 7]. Предположительно, IgG-АТ к нДНК являются индукторами и участниками воспалительного процесса при АИЗ, но что определяет их патогенетический потенциал и каким образом он реализуется в организме, до конца не выяснено.
Поэтому для более глубокого понимания роли АТ к нДНК в индукции и течении аутоиммунного синдрома была оценена зависимость генотоксичности IgG-АТ к нДНК от их физико-химических и иммуно-химических свойств.
Из каждой сыворотки было получено по 4 субфракции свободных от иммунных комплексов IgG-АТ к нДНК, различающихся зарядом (фракции I, характеризующиеся общим положительным зарядом, и фракции II с общим отрицательным зарядом) и аффинностью к нДНК — субфракции а, элюированные с нДНК-целлюлозы буфером, содержащим 1М NaCl, и субфракции б, элюированные с сорбента буфером Gly-HCl с рН 2.3, что позволяет сделать предположение об их большей аффинности к антигену.
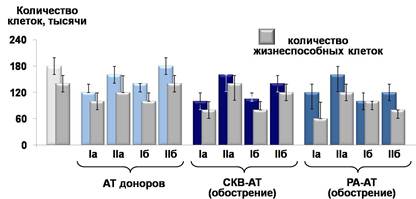
Показано, что в присутствии положительно заряженных IgG-АТ к нДНК доноров снижается общее количество и количество жизнеспособных лимфоцитов по сравнению с контролем (ФСБ) (рис 1). IgG-АТ к нДНК больных СКВ на стадии обострения заболевания оказывают сходное с АТ доноров влияние на лимфоциты здоровых лиц, но их воздействие более выражено, что, вероятно, связано с их высокой ДНК-гидролизующей активностью.
Отсутствие у доноров клинических признаков заболевания при аналогичном воздействии на клетки IgG-АТ к нДНК доноров и больных СКВ на стадии обострения заболевания объясняется тем, что уровень IgG-АТ к нДНК в крови здоровых людей значительно ниже, чем у больных СКВ. Кроме того, большая часть IgG-АТ к нДНК в крови здоровых лиц находится в составе иммунных комплексов с антиидиотипическими АТ [4] или отрицательно заряженными биополимерами сходной с ДНК конформации.
В процессе выделения IgG-АТ к нДНК из сывороток происходит разрушение иммунных комплексов АТ-ДНК с образованием свободных АТ к нДНК, а в опытах на лимфоцитах мы использовали равные концентрации всех исследуемых АТ, получив таким образом возможность наблюдать потенциальный негативный эффект на клетки in vitro АТ доноров.

Рис. 1. Изменение общего количества и количества жизнеспособных лимфоцитов здоровых лиц после 72 часов инкубации при 37 °С в присутствии субфракций IgG-АТ к нДНК:
Iа — положительно заряженные низкоаффинные IgG-АТ к нДНК;
IIа — отрицательно заряженные низкоаффинные IgG-АТ к нДНК;
Iб — положительно заряженные высокоаффинные IgG-АТ к нДНК;
IIб — отрицательно заряженные высокоаффинные IgG-АТ к нДНК.
Вероятно, патологические СКВ-АТ к нДНК могут происходить от естественных АТ, выполняющих в организме защитные функции, но вопрос о причинах подобного аномального переключения остается открытым.
Впервые показано, что спектр цитотоксичных субфракций IgG-АТ к нДНК в сыворотках крови больных РА отличается от нормы и СКВ. Наряду с положительно заряженными низкоаффинными АТ к ДНК, характерными для доноров и больных СКВ, высокоаффинные положительно и отрицательно заряженные субфракции IgG-АТ к нДНК больных РА приводят к заметному снижению пролиферации и количества жизнеспособных лимфоцитов здоровых лиц in vitro.
Изменение конденсации хроматина лимфоцитов после воздействия субфракций IgG-АТ к нДНК было исследовано методом флуоресцентной спектрофотометрии. Образование разрывов в ДНК приводит к декомпактизации хроматина, увеличению мест связывания ЭБ с нуклеиновой кислотой и усилению флуоресценции комплекса ЭБ-ДНК [2].
Дополнительно генотоксичность IgG-АТ к нДНК была оценена методом «ДНК-комет». При наличии разрывов в ДНК нарушается структурная организация хроматина и утрачивается сверхспирализация, что приводит к релаксации молекул. В электрическом поле релаксированные петли и фрагменты ДНК вытягиваются по направлению к аноду, что и придает наблюдаемым объектам вид «комет». По длине и структуре «хвоста комет» можно судить о степени деградации ДНК клеток.
Повышение интенсивности флуоресценции комплекса ЭБ-ДНК в образцах, инкубированных с положительно заряженными IgG-АТ к нДНК (Iа, Iб) доноров, свидетельствует об изменении структуры ДНК хроматина клеток — снятии суперспирализации и возможном образовании разрывов (таблица 1). На типичных микрофотографиях объектов после инкубации клеток с положительно заряженными IgG-АТ к нДНК обнаружено образование «хвостов комет» (рис 2В), что не наблюдается в отрицательном контроле ФСБ (рис. 2А) и является отражением генотоксичности АТ к ДНК. Вероятно, некоторые ДНК-связывающие АТ доноров, проникая в клетки, могут достигать ядра, связываться с ДНК и изменять ее конформацию. Например, показано, что АТ в сайте связывания с ДНК значительно усиливают её разрушение гидроксил-радикалами [8]. Вероятно, АТ к нДНК способствуют окислительному разрушению нДНК, изменяя её структуру, делая доступным для гидроксил-радикалов сайты рестрикции.
Таблица 1 — Изменение уровня флуоресценции ЭБ-ДНК хроматина лимфоцитов после 72 часов инкубации при 37 °С с субфракциями IgG-АТ к нДНК
Субфракции IgG-АТ к нДНК | Интенсивность флуоресценции комплекса ЭБ-ДНК, единиц/клетку | |||
Доноры | СКВ | РА | Контроль (ФСБ) | |
Положительно заряженные низкоаффинные | 7.85 (6.75; 8.32) | 9.52 (9.27; 11.06) | 8.51 (8.40; 8.91) | 6.67 (5.75; 6.85) |
Отрицательно заряженные низкоаффинные | 5.56 (5.04; 6.80) | 6.95 (6.49; 7.12) | 5.98 (5.53; 6.19) | |
Положительно заряженные высокоаффинные | 9.10 (8.94; 9.15) | 9.82 (9.25; 9.94) | 9.52 (9.24; 9.64) | |
Отрицательно заряженные высокоаффинные | 6.40 (5.64; 7.07) | 6.64 (6.46; 7.67) | 7.60 (6.96; 9.33) | |
Негативное воздействие на структуру ДНК хроматина лимфоцитов положительно заряженных субфракциями IgG-АТ к нДНК (Iа, Iб) больных СКВ на стадии обострения заболевания более выражено по сравнению с АТ доноров, что отражается в резком повышении флуоресценции комплекса ЭБ-ДНК. На типичной микрофотографии «ДНК-комет» отмечено образование широкого диффузного «хвоста кометы» (рис. 2Г), что является свидетельством высокой степени деградации ДНК лимфоцитов под воздействием АТ к ДНК больных СКВ. Генотоксичность IgG-АТ к нДНК больных СКВ в период обострения заболевания сравнима с действием перекиси водорода, использованной в данном эксперименте в качестве положительного контроля (рис. 2Б). Предположительно, наряду с ДНК-связывающими, ДНК-гидролизующие СКВ-АТ [5] в клетках, достигая ядра, сами могут выступать в качестве биокатализаторов гидролиза фосфодиэфирных связей ДНК и таким образом проявлять генотоксичность.
Рис. 2. Микрофотографии «ДНК-комет» после 72 часов инкубации при 37 °С лимфоцитов здоровых лиц с субфрациями IgG-АТ к нДНК:
А — отрицательный контроль (ФСБ); Б — положительный контроль (Н2О2);
В — типичные ДНК-кометы, наблюдаемые после воздействия на лимфоциты субфракций Iа и Iб IgG-АТ к нДНК доноров;
Г — типичные ДНК-кометы, наблюдаемые после воздействия на лимфоциты субфракций Iа и Iб IgG-АТ к нДНК больных СКВ;
Д- типичные ДНК-кометы, наблюдаемые после воздействия на лимфоциты субфракций Iа, Iб и IIб IgG-АТ к нДНК больных РА.
На основании полученных результатов можно заключить, что для АТ доноров и СКВ-АТ при воздействии на клетки in vitro большее значение имеет заряд молекул IgG-АТ к нДНК, нежели аффинность их к антигену.
Обнаружено, что при РА спектр генотоксичных субфракций шире, чем в норме и при СКВ — повышение флуоресценции комплекса ЭБ-ДНК хроматина клеток наблюдается после инкубации лимфоцитов с положительно заряженными низкоаффинными субфракциями (Iа), а также высокоаффинными субфракциями IgG-АТ к нДНК больных РА в период обострения заболевания, как положительно, так и отрицательно заряженными (Iб, IIб). При воздействии данных субфракций IgG-АТ к нДНК на клетки после электрофореза наблюдается формирование широких диффузных «хвостов комет» (рис. 2Д), свидетельствующее об образовании разрывов в ДНК лимфоцитов, что является следствием высокой генотоксичности АТ к ДНК при РА. На основании полученных результатов можно заключить, что при РА патогенетический потенциал IgG-АТ к нДНК определяется не зарядом молекулы, а аффинностью АТ к антигену — нативной ДНК. Это позволяет выдвинуть предположение об исходно иной природе формирования патологических IgG-АТ к нДНК при РА.
Вероятно, аномальное повышение уровня в крови естественных АТ к ДНК в определенных условиях способно привести к повреждению клеток иммунной системы, изменению их функциональной активности и экспрессии генов, что может отразиться нарушением иммунного статуса и индукцией аутоиммунного синдрома за счет интенсификации апоптоза здоровых клеток и накопления модифицированных В-лимфоцитов, продуцирующих патологические IgG-АТ к нДНК. Таким образом, IgG-АТ к нДНК являются одним из ключевых звеньев иммунной системы, отражают изменение иммунного статуса и принимают участие в сохранении гомеостаза в многоклеточном организме.
Рецензенты:
- Чиков В.И., д.б.н., профессор, Учреждение Российской академии наук Казанский институт биохимии и биофизики Казанского научного центра РАН, г. Казань.
- Габдрахманова Л.А., д.б.н., с.н.с., начальник Учебного управления ФГБОУ ВПО «Казанский государственный энергетический университет», г. Казань.
Работа получена 03.10.2011
/p
Библиографическая ссылка
Сабирзянова А.З., Невзорова Т.А. АНТИТЕЛА К ДНК СЫВОРОТОК КРОВИ БОЛЬНЫХ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКОЙ И РЕВМАТОИДНЫМ АРТРИТОМ ПРОЯВЛЯЮТ ГЕНОТОКСИЧНОСТЬ В ПЕРВИЧНОЙ КУЛЬТУРЕ ЛИМФОЦИТОВ ЗДОРОВЫХ ЛИЦ // Современные проблемы науки и образования. — 2011. — № 5.;
URL: https://science-education.ru/ru/article/view?id=4811 (дата обращения: 25.04.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Антиядерные (антинуклеарные) антитела, ANA — (от англ. anti-nuclear antibodies; в России широко распространен менее удачный синоним — АНФ, антинуклеарный фактор, который не отражает давно установленную биологическую природу явления) — антитела против основных компонентов ядра клетки (нуклеопротеиды, белки хроматина и др.).
При системных аутоиммунных заболеваниях, а также в процессе развития многих других патологических состояний происходит сенсибилизация лимфоцитов к собственным белкам организма и вырабатываются аутоантитела, направленные против антигенов компонентов клеточных ядер и цитоплазмы. Образующиеся иммунные комплексы аутоантиген-аутоантитело откладываются на базальных мембранах различных тканей и органов (кожа, почки, синовиальные, серозные оболочки, мозг и т. п.), а также снабжающих их кровью сосудов, активируя систему комплемента и вызывая воспаление и повреждение тканей. При этом повышается лизосомальная активность, выделяются медиаторы воспаления. Цитотоксическое действие оказывают фиксируемый иммунными комплексами комплемент и сенсибилизированные лимфоциты. Поражение сосудов на уровне микроциркуляторного русла лежит в основе системного повреждения соединительной ткани и паренхиматозных органов.
Исследование на антиядерные антитела проводят, если возникает подозрение на аутоиммунное заболевание или присоединение аутоиммунного компонента, играющего существенную роль в патогенезе многих нозоформ. Тест на ANA высокочувствителен (до 98%) при системной красной волчанке, однако положительные результаты могут наблюдаться при других коллагенозах и иммунокомплексных заболеваниях, а также при прочих заболеваниях, протекающих с развитием аутоиммунного компонента.
Результаты теста, полученные в разных лабораториях, могут отличаться вследствие особенностей использующихся методов. Поэтому полноценный лабораторный ответ при исследовании антинуклеарных антител обязательно должен включать описание использованного метода. Очень обширный перечень антигенов, объединенных в понятие «ядерные», требует также обязательного уточнения, антитела к каким из них могут быть выявлены используемым методом, а к каким — не могут. Иммунофлюоресцентные методы, в которых в качестве субстрата используются животные клетки, позволяют, помимо антиядерных антител, выявлять и дифференцировать также антитела к некоторым компонентам цитоплазмы, что расширяет их возможности.
Показания к назначению анализа: диагностика и дифференциальная диагностика системных заболеваний соединительной ткани (особенно СКВ), аутоиммунного гепатита, вирусного гепатита с аутоиммунным компонентом (индуцированным вирусами или лечебными вмешательствами), первичного билиарного цирроза, рассеянного склероза; выявление аутоиммунного компонента при различных заболеваниях, в патогенезе которых может играть роль аутоагрессия. Материал для исследования: сыворотка крови.
Для определения антинуклеарных антител используется методика непрямой иммунофлюоресценции с использованием в качестве субстрата клеток культивируемой линии Нер-2.
Образец (исследуемая сыворотка крови) инкубируется с субстратом, если в сыворотке присутствуют аутоантитела к ядерным или цитоплазматическим антигенам, они связываются с соответствующими компонентами субстрата с образованием комплекса антиген-антитело, который выявляется конъюгатом — антителами против иммуноглобулинов человека, меченными ФИТЦ. В результате при изучении с помощью люминесцентного микроскопа выявляется специфическая флюоресценция соответствующих ядерных или цитоплазматических структур клеток.
Использование в качестве субстрата клеток злокачественной культивируемой линии благодаря их особенностям (высокое ядерно-цитоплазматическое соотношение, крупные размеры, наличие большого количества митозов) позволяет оценить различные типы свечения, характерные для присутствия в образце крови широкого спектра антител к различным антигенам, имеющих различные клинические ассоциации.
Следует иметь в виду, что часть из определяемых типов свечения является высокоспецифичной, четко ассоциирована с определенными заболеваниями и имеет вполне определенную диагностическую значимость, в особенности при выявлении в высоких титрах; однако некоторые антитела к различным антигенам могут давать сходные типы свечения, в таких случаях может требоваться дальнейшее обследование для уточнения конкретного антигена, к которому направлены аутоантитела. С другой стороны, определенный тип антител может встречаться при нескольких нозологических формах. Существуют также антитела (они встречаются редко), реагирующие исключительно с компонентами веретенного аппарата клеток; обычно они не связаны с аутоиммунными заболеваниями, и их обнаружение расценивается как ложнопозитивный, не имеющий клинических ассоциаций результат.
Все вышеперечисленные особенности обязательно отражаются в лабораторном заключении, где, помимо указания типа свечения и соответствующего ему наиболее вероятного типа антител, даются также рекомендации по трактовке результатов в смысле возможной ассоциации с конкретными нозоформами или синдромами, а также необходимые дополнительные лабораторные исследования.
Достоинством метода иммунофлюоресценции с использованием клеток злокачественных культивируемых линий является также возможность выявления антител к некоторым антигенам цитоплазматической локализации: митохондриям, актину, лизосомам и др.
Некоторые из выявляемых антиядерных и антицитоплазматических антител с характерными для них видами свечения и клиническими ассоциациями приведены ниже:
- ядерный гомогенный тип — антитела (АТ) к ДНК (двух- и односпиральной), антитела к ДНП (дезоксинуклеопротеид — комплекс ДНК с гистонами), антитела к гистонам, антитела к другим компонентам хроматина (протамины и т.д.); клинические ассоциации — СКВ (анти-ДНК, антитела к гистонам — в высоких титрах); лекарственная волчанка, ревматоидный артрит (антитела к гистонам);
- ядерный периферический тип — АТ к двухспиральной ДНК, гистонам; клинические ассоциации — СКВ, лекарственная волчанка);
- ядерно-мембранный ламиновый тип — АТ к ламинам (фибриллярным белкам мембраны ядра); клинические ассоциации — СКВ, линейная склеродермия, ревматоидный артрит, сочетанный синдром гепатит/тромбопения/анемия;
- ядерно-мембранный кольцеобразный тип с крапчатым свечением цитоплазмы — антимитохондриальные антитела к компонентам митохондрий М2 (пируватдегидрогеназный комплекс), М3, М6; клинические ассоциации см. митохондриальный тип;
- ядерные каналы — АТ к белкам комплекса канальцев ядерной мембраны; клинические ассоциации — полимиозит;
- перихроминовый тип — АТ к перихромину; клинические ассоциации — СКВ;
- гетерогенный ядерный РНП (рибонуклеопротеин) — АТ к различным компонентам матрикса ядра; клинические ассоциации — смешанное заболевание соединительной ткани (СЗСТ);
- Sm/РНП — АТ к ядерному РНП или Sm-комплексу; клинические ассоциации — СКВ, СЗСТ (антитела к Sm); синдром Шегрена, склеродермия, ревматоидный артрит, СКВ, дискоидная волчанка, вызванная прокаинамидом (антитела к РНП);
- центромерный тип — АТ к центромере (кинетохору); клинические ассоциации — синдром CREST (кальциноз, феномен Рейно, дисфункция пищевода, склеродактилия, телеангиэктазия), склеродермия, первичный билиарный цирроз
- ядерный крапчатый тип (NSP1) — АТ против слабо охарактеризованных белков, часто сочетающиеся с антителами к актину или митохондриям; клинические ассоциации — первичный билиарный цирроз (NSP1 + митохондриальный тип), хронический активный гепатит (NSP1 + актин);
- ядрышковый гомогенный тип — АТ к нуклеолину и другим компонентам ядрышек; клинические ассоциации — сочетанный синдром полимиозита/склеродермии, склеродермия в основном с поражением почек;
- ядрышково-кластерный тип — АТ к фибриллярину (7-2-РНК), антитела к рибонуклеопротеину U3РНП; клинические ассоциации — склеродермия, обнаруживаемая в основном у молодых мужчин;
- ядрышково-крапчатый тип — АТ к Scl-70 (АТ к топоизомеразе 1); клинические ассоциации — склеродермия;
- митохондриальный (цитоплазматический) тип — АТ к М2 (пируватдегидрогеназный комплекс), М3, М6 компонентам митохондрий (антитела к М1 и М5 на клетках Hep-2 не выявляются); клинические ассоциации — первичный билиарный цирроз, лекарственная СКВ (антитела к М3, М6), хронический активный гепатит, синдром Рейнольдса, синдром Шегрена, ревматоидный артрит;
- мелкокрапчатый (цитоплазматический) тип — АТ к различным цитоплазматическим белкам, например, SPR (al recognition particle — частица, распознающая сигнал); клинические ассоциации — миозит;
- перинуклеарный тип — АТ к антигенам Jo-7, PL1, PL7, PL12; клинические ассоциации — полимиозит, в основном в сочетании с соединительнотканным заболеванием легких; дерматомиозит;
- рибосомальный тип — АТ к антигенам рибосом; клинические ассоциации — СКВ, в основном с неврологической симптоматикой, ревматоидный артрит, синдром Шарпа;
- актин — АТ к актину (антитела к гладкой мускулатуре); клинические ассоциации — хронический активный гепатит, первичный билиарный цирроз;
- тубулин — АТ к тубулину; клинические ассоциации — алкогольный цирроз, тиреоидит Хашимото, склеродермия, синдром CREST, феномен Рейно;
- цитокератин — АТ к цитокератину; клинические ассоциации — ревматоидный артрит, склеродермия, СКВ.
ТРАКТОВКА РЕЗУЛЬТАТОВ.
У здоровых лиц моложе 60 лет следует ожидать отрицательных результатов на антитела к компонентам ядра и цитоплазмы; в низком титре (слабоположительный результат) эти антитела все же обнаруживаются у 2-3% (по некоторым данным, до 10%) практически здоровых людей, однако никогда нельзя предсказать, не разовьется ли у этих людей аутоиммунное заболевание в будущем (так, по данным некоторых авторов, антитела к ДНК начинают выявляться задолго до начала клинических проявлений СКВ, латентный период может продолжаться годами). После 60 лет частота слабоположительных результатов с возрастом постоянно растет. Клиническая значимость этих результатов остается неясной; как правило, они выявляются только в первичном (скрининговом) разведении 1:40. Исходя из этого, при выявлении положительного результата в скрининговом титре 1:40 всегда необходимо титрование, как минимум до диагностического титра 1:80. В любом случае представляется целесообразным последующее регулярное клинико-лабораторное наблюдение лиц, у которых выявлены ANA в низком титре.
ОГРАНИЧЕНИЯ МЕТОДА Положительный результат предполагает наличие определенных заболеваний (см. ниже), однако, как и результат любых лабораторных исследований, может нуждаться в подтверждении или уточнении с помощью других методов, а также в установлении клинико-лабораторных корреляций.
Надо иметь в виду, что различные лекарственные препараты могут вызывать образование аутоантител (гидралазин, прокаинамид, фенитоин, карбамазепин, изониазид, хлорпромазин, пеницилламин, леводофа, пенициллин, фенилбутазон, пероральные контрацептивы, хинидин). Наиболее частыми мишенями для этих ятрогенных аутоантител являются ядерные гистоны, что приводит к развитию гомогенного или гомогенного периферического типа свечения.
ЗАБОЛЕВАНИЯ, ПРИ КОТОРЫХ ЧАЩЕ ВСЕГО ВЫЯВЛЯЮТСЯ
АНА ИЛИ АНТИЦИТОПЛАЗМАТИЧЕСКИЕ АНТИТЕЛА
- Системные поражения соединительной ткани:
— системная красная волчанка (СКВ),
— ревматоидный артрит,
— синдром Шегрена,
— склеродермия,
— дерматомиозит,
— узелковый периартериит и др.;
- Инфекции (туберкулез, инфекционный мононуклеоз, острый и особенно хронический вирусный гепатит, подострый инфекционный эндокардит, ВИЧ-инфекция и др.);
- Хронический аутоиммунный гепатит, первичный билиарный цирроз печени;
- Сахарный диабет (инсулинзависимый);
- Множественный склероз;
- Легочной фиброз;
- Системные васкулиты.
Антинуклеарные антитела также могут выявляться при острых и хронических лейкозах, приобретенной гемолитической анемии, болезни Вальденстрема, малярии, хронической почечной недостаточности, тромбоцитопениях, лимфопролиферативных заболеваниях, миастении и тимомах.
Титры антинуклеарных антител при узелковом периартериите могут достигать 1:100, при дерматомиозите — 1:500, СКВ — 1:1000 и выше. При СКВ тест на выявление антинуклеарных антител методом непрямой иммунофлюоресценции обладает высокой степенью чувствительности (до 98% по данным разных авторов), но умеренной специфичностью (78%), так как антинуклеарные антитела могут встречаться и при других, указанных выше, заболеваниях. Для сравнения, тест определения антител к нативной ДНК с помощью ИФА в диагностике СКВ обладает значительно меньшей чувствительностью — 38% (т.к. патогенетическую роль в развитии СКВ могут играть не только антитела к ДНК, но и антитела к гистонам, дезоксирибонуклеопротеину и многим другим ядерным антигенам); однако специфичность определения антител к нативной ДНК для диагноза СКВ является почти абсолютной (98%). Клиническая интерпретация этих различий в чувствительности и специфичности разных лабораторных тестов в диагностике СКВ выглядит следующим образом: отрицательный результат обнаружения антител к нативной ДНК с помощью ИФА не исключает диагноз СКВ, обнаружение же этих антител практически со 100% вероятностью подтверждает диагноз. Другая ситуация имеется в отношении АНФ: отрицательный (особенно многократный) результат обнаружения антинуклеарных антител методом непрямой иммунофлюоресценции делает диагноз СКВ (во всяком случае, активной формы) весьма сомнительным (т.к. метод обнаруживает практически все аутоантитела, встречающиеся при СКВ), обнаружение же антинуклеарных антител не всегда будет достаточным основанием для постановки диагноза СКВ, оно подтверждает наличие феномена аутоиммунитета и обычно требует для установления окончательного диагноза дальнейшей клинико-лабораторной дифференциации с учетом типа свечения, титра антител, проведения дополнительных уточняющих или подтверждающих тестов, рекомендованных лабораторией, сопоставления результатов с клинической картиной.
При СКВ корреляция между величиной титра ANA и клиническим состоянием обычно отсутствует, хотя сохранение высоких титров в течение длительного времени является неблагоприятным прогностическим признаком. Снижение уровня антител предвещает ремиссию, но иногда — летальный исход (феномен потребления антител: при нарастающем аутоиммунном повреждении тканей темп высвобождения ядерных антигенов, с которыми связываются наработанные антиядерные антитела, превышает скорость синтеза новых аутоантител).
При склеродермии частота выявления антител к ядерным антигенам составляет 60-80%, их титр обычно ниже, чем при СКВ. При ревматоидном артрите часто встречаются СКВ-подобные формы течения, поэтому довольно часто выявляются ANA. При дерматомиозите антитела к ядерным антигенам в крови встречаются в 20-60% случаев, при узелковом периартериите — в 17% (титр до 1:100), при болезни Шегрена — в 56% в сочетании с артритом и в 88% случаев — при комбинации с синдромом Гужеро-Шегрена. При дискоидной (кожной) красной волчанке антинуклеарный фактор выявляется у 50% больных.
Частота обнаружения антинуклеарных антител при ревматических
заболеваниях и у здоровых лиц (Насонова В.А. и др., 1997)
| Заболевание | Частота выявления ANA, % | Титры |
| СКВ — активная форма | 98-100 | +++ |
| Дискоидная красная волчанка | 40 | ++, +++ |
| Лекарственная волчанка | 100 | ++ |
| Системная склеродермия | 70 | ++, +++ |
| Синдром Шегрена | 60 | ++, +++ |
| Смешанное заболевание соединительной ткани | 100 | ++, +++ |
| Болезнь Рейно | 60 | ++, +++ |
| Ревматоидный артрит | 40 | +, ++ |
| Ювенильный хронический артрит | 20 | +, ++ |
| Полимиозит и дерматомиозит | 30 | + |
| Узелковый периартериит | 17 | + |
| Здоровые лица до 40 лет | 3 | + |
| Здоровые лица после 40 лет | 25 | + |
Источник
