Артериальная гипертензия ревматоидный артрит

 Ревматоидный артрит (РА) – заболевание с доказанно высоким кардиоваскулярным риском. Основными причинами высокой смертности от сердечно-сосудистых осложнений (ССО) у таких больных являются ускоренное прогрессирование атеросклероза, развитие хронической сердечной недостаточности и внезапной сердечной смерти. Риск ишемической болезни сердца (ИБС) и инфаркта миокарда при РА выше в 2 раза, мозгового инсульта – в 1,9 раза, сердечной недостаточности – в 1,8 раза, чем в общей популяции, причем его резкое увеличение отмечается уже в дебюте заболевания. Повышение кардиоваскулярной летальности при РА обусловлено накоплением традиционных факторов риска (ТФР) сердечно-сосудистых заболеваний (ССЗ): артериальной гипертензии (АГ), дислипидемии, курения и т. д.; хроническим воспалением, аутоиммунными нарушениями, составляющими основу патогенеза этого заболевания; побочными эффектами противоревматической терапии и недостаточным вниманием к профилактике ССО со стороны врачей и пациентов. Поэтому разработка эффективных мер по снижению кардиоваскулярного риска у больных РА – актуальная задача современной медицины.
Ревматоидный артрит (РА) – заболевание с доказанно высоким кардиоваскулярным риском. Основными причинами высокой смертности от сердечно-сосудистых осложнений (ССО) у таких больных являются ускоренное прогрессирование атеросклероза, развитие хронической сердечной недостаточности и внезапной сердечной смерти. Риск ишемической болезни сердца (ИБС) и инфаркта миокарда при РА выше в 2 раза, мозгового инсульта – в 1,9 раза, сердечной недостаточности – в 1,8 раза, чем в общей популяции, причем его резкое увеличение отмечается уже в дебюте заболевания. Повышение кардиоваскулярной летальности при РА обусловлено накоплением традиционных факторов риска (ТФР) сердечно-сосудистых заболеваний (ССЗ): артериальной гипертензии (АГ), дислипидемии, курения и т. д.; хроническим воспалением, аутоиммунными нарушениями, составляющими основу патогенеза этого заболевания; побочными эффектами противоревматической терапии и недостаточным вниманием к профилактике ССО со стороны врачей и пациентов. Поэтому разработка эффективных мер по снижению кардиоваскулярного риска у больных РА – актуальная задача современной медицины.
Доказано, что АГ является важнейшим модифицируемым фактором риска не только в общей популяции, но и у больных РА. Наличие АГ в 3–6 раз увеличивает риск развития ССО при РА. Частота АГ при РА в среднем на 50% выше, чем в общей популяции. Отмечено раннее формирование изолированной систолической АГ, наиболее неблагоприятной в плане развития ССО. К возможным причинам повышения АД при РА относят наличие хронического воспаления и аутоиммунных нарушений, составляющих основу патогенеза заболевания, метаболические нарушения, гиподинамию, генетические факторы и использование противоревматических препаратов с потенциально гипертензивными эффектами. Диагностика АГ должна соответствовать рекомендациям Российского кардиологического общества (РКО). Важно учитывать, что проведение суточного мониторирования АД (СМАД) значительно улучшает диагностику АГ у больных РА. Так, по нашим данным, диагноз АГ на основании опроса, медицинской документации и измерения АД на двух руках был установлен у 20% больных ранним РА, тогда как с учетом результатов СМАД – у 64%. При этом у подавляющего большинства больных уже была АГ II стадии (с поражением органов-мишеней) или III стадии (с наличием ассоциированных клинических состояний: ИБС, инфаркт миокарда/мозговой инсульт в анамнезе). Такая катастрофическая разница между обычным осмотром больного и результатами СМАД может быть связана с особенностями суточного профиля АД при РА. К ним относят увеличение пульсового АД, рост вариабельности АД и повышение частоты таких прогностически неблагоприятных типов суточного профиля АД, как «нон-диппер» (АД не снижается в ночные часы) и «найт-пикер» (АД в ночные часы выше, чем днем), особенно на фоне высокой активности заболевания и лечения глюкокортикоидами (ГК), нестероидными противовоспалительными препаратами (НПВП).
АГ в качестве единственного фактора риска встречается лишь у 7% больных РА. У подавляющего же большинства пациентов она выявляется в сочетании с другими факторами риска (дислипидемией, висцеральным ожирением, курением и др.), что повышает вероятность поражения органов-мишеней (атеросклероз, гипертрофия и ремоделирование миокарда левого желудочка), поэтому необходимо проводить одновременный скрининг всех ТФР ССЗ.
С одной стороны, эффективная противовоспалительная терапия занимает важное место в профилактике ССО и АГ, с другой – большинство препаратов, рутинно используемых для лечения РА, могут вызывать АГ или препятствовать ее эффективному контролю (НПВП, ГК, некоторые базисные противовоспалительные препараты). Использование лефлуномида при РА ассоциируется со снижением вероятности ССО, но риск их развития в 2 раза выше, чем при лечении метотрексатом. АГ, ассоциированная с лефлуномидом, выявляется у 2–10% больных РА. К механизмам повышения АД на фоне приема лефлуномида относят усугубление гиперсимпатикотонии и повышение влияния НПВП на почечный кровоток. Необходимо учитывать, что длительное (более 2 лет) применение даже низких доз ГК (4–6 мг) увеличивает риск развития АГ на 30%, более 5 лет – на 37%, а инфаркта миокарда – на 16%. Доказано 5-кратное возрастание риска ССО у больных, получающих ГК в дозе >7,5 мг/сут. Нужно сказать о генноинженерных биологических препаратах: все препараты этой группы могут вызывать инфузионные реакции в виде гипо- и гипертонии. Наши клинические наблюдения свидетельствуют о том, что в некоторых случаях повышение АД на фоне инфузий инфликсимаба, ритуксимаба и тоцилизумаба бывает очень выраженным, сопровождается ангинозными приступами и требует проведения интенсивной терапии.
Как обстоят дела с лечением АГ у больных РА? Процент больных РА, информированных о наличии у них АГ, получающих гипотензивную терапию и эффективно контролирующих АД, в 1,5 раза ниже, чем в общей популяции. Отсутствие эффективного контроля АГ при РА вдвойне печально, так как пациентов регулярно госпитализируют, они часто посещают ревматолога, т. е. имеют возможность следить за АД. Крайне важно, что АГ чаще не диагностируется у молодых больных РА, у которых как раз можно ожидать наибольшую пользу от ранней идентификации АГ и ее лечения. А эффективный контроль АД, как правило, отсутствует у пожилых больных, вероятно, в связи с наличием коморбидных состояний и низкой приверженностью лечению вследствие полипрагмазии.
 Согласно рекомендациям EULAR, лечение АГ при РА должно проводиться ревматологом, и только в сложных ситуациях (наличие хронической сердечной недостаточности, инфаркта миокарда и/или инсульта в анамнезе, сахарного диабета, хронической почечной недостаточности) показана консультация кардиолога. При ССЗ тактика ведения аналогична таковой у пациентов без ревматического заболевания. Если у больного РА нет доказанных ССЗ, то необходимо оценить суммарный кардиоваскулярный риск по шкале SCORE. По рекомендациям EULAR, при использовании шкалы SCORE у больных РА определяют соотношение уровня холестерина (ХС) и ХС липопротеинов высокой плотности. Модели подсчета должны быть адаптированы для больных РА: риск увеличивается в 1,5 раза при наличии 2 из 3 перечисленных факторов: длительность заболевания более 10 лет; ревматоидный фактор/антитела к антицитруллинированному пептиду – позитивность; наличие внесуставных проявлений (www.scardio.org). К сожалению, шкалы, основанные на учете ТФР, даже при введении поправочного коэффициента, не всегда позволяют объективно оценить кардиоваскулярный риск у больных РА. Поэтому систему стратификации риска ССО по шкале SCORE целесообразно использовать как предварительную с последующим уточнением величины риска после проведения дополнительного обследования (оценка поражения органов-мишеней).
Согласно рекомендациям EULAR, лечение АГ при РА должно проводиться ревматологом, и только в сложных ситуациях (наличие хронической сердечной недостаточности, инфаркта миокарда и/или инсульта в анамнезе, сахарного диабета, хронической почечной недостаточности) показана консультация кардиолога. При ССЗ тактика ведения аналогична таковой у пациентов без ревматического заболевания. Если у больного РА нет доказанных ССЗ, то необходимо оценить суммарный кардиоваскулярный риск по шкале SCORE. По рекомендациям EULAR, при использовании шкалы SCORE у больных РА определяют соотношение уровня холестерина (ХС) и ХС липопротеинов высокой плотности. Модели подсчета должны быть адаптированы для больных РА: риск увеличивается в 1,5 раза при наличии 2 из 3 перечисленных факторов: длительность заболевания более 10 лет; ревматоидный фактор/антитела к антицитруллинированному пептиду – позитивность; наличие внесуставных проявлений (www.scardio.org). К сожалению, шкалы, основанные на учете ТФР, даже при введении поправочного коэффициента, не всегда позволяют объективно оценить кардиоваскулярный риск у больных РА. Поэтому систему стратификации риска ССО по шкале SCORE целесообразно использовать как предварительную с последующим уточнением величины риска после проведения дополнительного обследования (оценка поражения органов-мишеней).
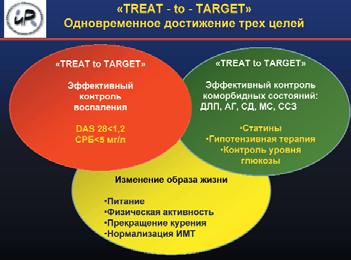
Основная цель лечения больных АГ – максимальное снижение риска развития ССО и смерти от них. Для этого требуется снижение АД до целевого уровня, коррекция всех модифицируемых факторов риска (курение, дислипидемия, гипергликемия, ожирение), предупреждение, замедление темпа прогрессирования и/или уменьшение поражения органов-мишеней, лечение ассоциированных и сопутствующих заболеваний (ИБС, сахарный диабет).
При необходимости коррекции АД у больного РА на первом месте, как и в общей популяции, стоят немедикаментозные меры профилактики, которые включают отказ от курения; нормализацию массы тела (поддержание индекса массы тела на уровне 20–23 кг/м2, объема талии <80 см для женщин и <94 см для мужчин); увеличение физической активности; изменение режима питания. Немедикаментозная профилактика способствует также более эффективному контролю воспалительной активности при РА.
 Коррекция АГ с достижением целевого уровня АД должна проводиться согласно рекомендациям РКО. Но, учитывая высокий риск развития ССО при РА, целесообразно раннее назначение гипотензивной терапии. Как известно, основная польза гипотензивной терапии – снижение АД, независимо от класса используемых препаратов. Согласно рекомендациям EULAR, ингибиторы ангиотензинпревращающего фермента (иАПФ) и антагонисты рецепторов ангиотензина II (АРА) являются препаратами первой линии для лечения АГ при РА. Помимо эффективности при лечении АГ, хронической сердечной недостаточности и почечной патологии, иАПФ и АРА способны замедлять прогрессирование атеросклероза, оказывать противовоспалительное действие, уменьшать гиперсимпатикотонию. АРА повышают чувствительность периферических тканей к инсулину. Но в настоящее время получены данные о наличии плеотропных эффектов и у других классов гипотензивных препаратов. Так, β-адреноблокаторы (БАБ) 3-го поколения не только уменьшают гиперсимпатикотонию, но и улучшают эндотелиальную функцию, снижают перекисное окисление липидов, уровень общего ХС, триглицеридов и глюкозы. Но следует помнить о снижении гипотензивного эффекта БАБ, иАПФ и АРА на фоне одновременного приема с НПВП. Антагонисты кальция также занимают важное место в лечении АГ у больных РА. Они метаболически нейтральны, что позволяет назначать их при метаболическом синдроме и/или сахарном диабете, способствуют уменьшению симптомов при болезни/синдроме Рейно и не взаимодействуют с НПВП.
Коррекция АГ с достижением целевого уровня АД должна проводиться согласно рекомендациям РКО. Но, учитывая высокий риск развития ССО при РА, целесообразно раннее назначение гипотензивной терапии. Как известно, основная польза гипотензивной терапии – снижение АД, независимо от класса используемых препаратов. Согласно рекомендациям EULAR, ингибиторы ангиотензинпревращающего фермента (иАПФ) и антагонисты рецепторов ангиотензина II (АРА) являются препаратами первой линии для лечения АГ при РА. Помимо эффективности при лечении АГ, хронической сердечной недостаточности и почечной патологии, иАПФ и АРА способны замедлять прогрессирование атеросклероза, оказывать противовоспалительное действие, уменьшать гиперсимпатикотонию. АРА повышают чувствительность периферических тканей к инсулину. Но в настоящее время получены данные о наличии плеотропных эффектов и у других классов гипотензивных препаратов. Так, β-адреноблокаторы (БАБ) 3-го поколения не только уменьшают гиперсимпатикотонию, но и улучшают эндотелиальную функцию, снижают перекисное окисление липидов, уровень общего ХС, триглицеридов и глюкозы. Но следует помнить о снижении гипотензивного эффекта БАБ, иАПФ и АРА на фоне одновременного приема с НПВП. Антагонисты кальция также занимают важное место в лечении АГ у больных РА. Они метаболически нейтральны, что позволяет назначать их при метаболическом синдроме и/или сахарном диабете, способствуют уменьшению симптомов при болезни/синдроме Рейно и не взаимодействуют с НПВП.
Таким образом, диагностика АГ должна осуществляться согласно рекомендациям РКО. У пациентов с РА, имеющих ≥2 ТФР ССЗ, высокую активность заболевания, длительность РА более 5 лет, принимающих НПВП, ГК, лефлуномид, необходимо более углубленное обследование, направленное на выявление субклинических признаков поражения сердечно-сосудистой системы. Ведение пациента с РА и АГ должно включать устранение возможных причин повышения АД (НПВП, ГК, лефлуномид), рекомендации по изменению образа жизни, решение вопроса о необходимости назначения гипотензивной терапии, статинов и антиагрегантов согласно стратификации риска ССО. Если необходим одновременный прием аспирина и НПВП, следует минимизировать их дозу, использовать ингибиторы протонной помпы. Необходимо динамическое наблюдение за пациентами с РА и АГ. Рекомендуется систематический контроль АД при каждом обращении к ревматологу (не реже 1 раза в 6 мес). При развитии АГ проводят ежемесячный контроль АД до достижения целевых значений. При назначении терапии НПВП или ГК важен ежемесячный контроль АД в течение первых 6 мес, по возможности нужно минимизировать дозу и длительность приема как ГК, так и НПВП. При каждом визите к ревматологу, независимо от наличия у пациента АГ, необходим пересмотр антиревматических препаратов, обладающих потенциальными гипертензивными эффектами.
РА, как и сахарный диабет, относят к заболеваниям с доказанно высоким кардиоваскулярным риском. Если при сахарном диабете стратегия агрессивного скрининга и лечения ССЗ привела к значительному снижению ССО, то при РА решению данной проблемы не уделяется должного внимания. Высокая частота АГ при РА требует проведения агрессивного скрининга и тщательного контроля АД с более низким порогом назначения гипотензивной терапии.
Д.м.н. Д.С. Новикова, старший научный сотрудник лаборатории функциональной и ультразвуковой диагностики,
д.м.н. Т.В. Попкова, руководитель лаборатории системных ревматических заболеваний с группой гемореологических нарушений
ФГБУ «НИИР им. В.А. Насоновой» РАМН
Источник
Повышенное давление
В последнее время проводилось немало исследований, в которых изучалось влияние хронического воспаления суставов на артериальное давление. На сегодняшний день установлено, что артериальная гипертензия у больных ревматоидным артритом встречается гораздо чаще, чем в общей популяции. Причем вероятность чрезмерного повышения давления напрямую зависит от активности патологического процесса в суставах. Следовательно, чем более тяжелая форма артрита у человека – тем выше вероятность развития у него артериальной гипертензии.
Наличие одновременно гипертонической болезни и деформирующего остеоартроза (остеоартрита) у людей преклонного возраста заметно ускоряет прогрессирование обоих заболеваний. Подобное сочетание очень часто приводит к нарушению кальциевого обмена и развитию остеопороза. Поэтому людям с гипертонией и остеоартритом показана заместительная терапия (препараты кальция).
Причины
Как известно, для лечения большинства артритов используются нестероидные противовоспалительные средства и кортикостероиды. При системном применении эти препараты несколько повышают артериальное давление. Длительное лечение указанными средствами может привести к развитию артериальной гипертензии.
Механизм действия ангиотензина-2.
Помимо этого, повышению давления у больных артритами способствуют регулярные боли и хроническое воспаление. Последнее приводит к нарушению нормального функционирования эндотелия сосудов, что способствует развитию атеросклероза. Поврежденный эндотелий имеет свойство синтезировать избыточное количество ангиотензина-2 – вещества, повышающего давление.
Ревматоидный артрит
Как правило, артериальная гипертензия развивается при длительном течении ревматоидного полиартрита. Хроническое воспаление и регулярный прием НПВС (Диклофекак, Ибупрофен, Индометацин) способствуют развитию этой патологии. Метотрексат (препарат, который широко используется в лечении ревматоидного артрита) снижает риск сердечно-сосудистой патологии.
Остеоартрит
Этим заболеванием страдают преимущественно люди пожилого возраста. У них чаще всего поражаются тазобедренные, коленные, локтевые и другие крупные суставы. Это, в свою очередь, приводит к ограничению двигательной активности. Человеку тяжело ходить, работать, выполнять привычные действия. Малоактивный образ жизни способствует развитию ишемической болезни сердца и гипертонической болезни. Поэтому люди с остеоартритом намного чаще страдают от сердечно-сосудистой патологии.
Ревматический артрит
 Ревматизм – это системное воспалительное заболевание, при котором очень часто развивается ревматический кардит.
Ревматизм – это системное воспалительное заболевание, при котором очень часто развивается ревматический кардит.
При остром ревматическом полиартрите давление может повышаться из-за сильной интоксикации. Однако более опасным для человека является воспалительное поражение сердечной мышцы. Это может привести к сердечной недостаточности, приобретенным порокам сердца и другим тяжелым осложнениям.
При подагре
Главной причиной гипертонии при этом заболевании является стойкая гиперурикемия – повышение уровня солей мочевой кислоты в крови. Согласно данным научных исследований, данный фактор приводит к повышению артериального давления почти у половины людей, страдающих этим заболеванием.
Причины гипертонии при подагре:
- повышение активности симпатической нервной и ренин-ангиотензиновой систем;
- гипертрофия сосудистой стенки и повышение сопротивления периферических сосудов;
- поражение почек (уратная нефропатия);
- инсулинорезистентность и повышение реабсорбции (обратного захвата) натрия, удерживающего жидкость в организме.
Профилактика гипертонии
Основным мероприятием в профилактике артериальной гипертензии является разумный прием лекарственных средств. Проводить лечение нужно под строгим контролем врача, а принимать любые фармпрепараты следует лишь с его разрешения. Среди нестероидных противовоспалительных средств предпочтение необходимо отдавать селективным ингибиторам ЦОГ-2 – они более безопасны и намного реже вызывают какие-то побочные эффекты. К этим препаратам относится Мелоксикам, Целекоксиб, Ксефокам.
Нужно запомнить, что своевременное лечение артрита может заметно снизить риск развития гипертонической болезни. Поэтому столь важны такие мероприятия, как соблюдение диеты при подагре, избежание переохлаждений при ревматоидном артрите и сильных физических нагрузок при остеоартрите.
Лечение
Для коррекции давления больным с артериальной гипертензией и артритом следует принимать препараты из группы антагонистов кальция или ингибиторов ангиотензинпревращающего фермента. К первым относится Амлодипин, Верапамил, Дилтиазем, Нифедипин. Наиболее известные ингибиторы АПФ – Эналаприл, Каптоприл, Лизиноприл. Начинать лечение перечисленными препаратами можно только после консультации со специалистом.
Для профилактики остеопороза людям с деформирующим остеоартритом нужно обеспечить поступление достаточного количества кальция в организм. Принимая препараты кальция, следует учесть риск развития мочекаменной болезни. Естественно, патология почек только усугубит течение гипертонической болезни и существенно ухудшит состояние человека. Поэтому предпочтение следует отдавать препаратам на основе цитрата или гидроксиаппатита кальция (Кальций D3 цитрат, Кальцимакс, Гидроксиаппатит кальция).
 Кальций в организме необходим для поддержания структуры костей, нормальной работы нервной и сердечно-сосудистой систем.
Кальций в организме необходим для поддержания структуры костей, нормальной работы нервной и сердечно-сосудистой систем.
Что касается диуретиков – при подагре принимать их категорически запрещено, поскольку эти препараты дополнительно повышают уровень мочевой кислоты в крови. Во всех остальных случаях их можно пить лишь с разрешения врача.
Замена пораженного остеоартритом сустава (тазобедренного, коленного) существенно снижает риск развития инфарктов и другой сердечно-сосудистой патологии. Это можно объяснить снижением потребности в нестероидных противовоспалительных препаратах, уменьшением болевого стресса и заметным повышением двигательной активности. Хирургическое вмешательство позволяет многим людям вернуться к нормальному образу жизни.
Поделиться:
Источник
При обнаружении у больного РА митрального стеноза всегда необходимо исключать его ревматическую этиологию, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и в эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного эрозивно-деструктивного полиартрита с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается в 50-60% случаев [1, 4, 7]. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. Системные проявления РА, в том числе и поражение сердца, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение.
Морфологическая картина
| Рисунок 1. Интерстициальный миокардит, умеренный васкулит. Окр. гематоксилином и эозином. Х 150 |
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой — отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений [7]. В одних сосудах имеется васкулит, в других — гиалиноз, в третьих — склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным. В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных ревматоидным артритом нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, то есть при очередном выраженном обострении суставного синдрома.
Клиника
| Рисунок 2. Интерстициальный миокардит. Отложения липофусцина в перинуклеарных пространствах. Окр. гематоксилином и эозином. Х 400 |
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и не купирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [3].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [4].
Данные ЭКГ
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение интервалов ST, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
В литературе описано значительное число наблюдений, когда нарушение ритма сердца служит единственным патологическим симптомом поражения коронарных артерий. Нарушение ритма и проводимости при активном РА существенно чаще определяется при суточном мониторировании ЭКГ и чреспищеводном электрофизиологическом исследовании, чем при обычной ЭКГ. Так,
И. Б. Виноградова [2] при исследовании больных РА с использованием вышеуказанной методики выявила нарушение ритма и проводимости у 60% больных, в том числе предсердную (18%) и желудочковую (10%) экстрасистолию, пароксизмальную тахикардию (4%), мерцательную аритмию (6%), проходящую блокаду правой ножки пучка Гиса (20%) и атриовентрикулярную блокаду II степени (2%). Также было высказано предположение, что депрессия ST, выявляемая при чреспищеводном электрофизиологическом исследовании, является косвенным признаком изменения коронарной микроциркуляции вследствие ревматоидного васкулита. Поэтому у данных больных отмечены высокие уровни циркулирующих иммунных комплексов, ревматоидного фактора, антител к кардиолипину Ig M. Важно отметить, что в этой же группе больных имелись другие признаки васкулита: дигитальный артериит, сетчатое ливедо, синдром Рейно и ревматоидные узелки. Следовательно, если рутинные клинические методы исследования не выявляют достаточно убедительных признаков ревматоидного миокардита, то современные электрофизиологические исследования обнаруживают факты нарушений функции сердца, что указывает на связь этих изменений с активностью ревматоидного процесса. Подтверждением этому может служить положительная динамика изменений под влиянием адекватного лечения основного заболевания, обычно отмечаемая при регрессе суставного синдрома.
Дифференциальная диагностика
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, т. к. клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
| Рисунок 3. Утолщение перикарда. Склероз. Окр. гематоксилином и эозином. Х 150 |
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при ревматоидном артрите является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20-40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процессса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием. ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза инфаркта миокарда. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях ЭХО-изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [8].
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом. В литературе обсуждается возможность образования стенозов митрального и аортального клапанов, но единого мнения по этому вопросу нет [6]. При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, т. к. сочетание РА с предшествующим ревматическим пороком признается многими авторами [4].
С целью изучения характера клапанной патологии сердца при РА проанализированы результаты лечения 297 больных с достоверным РА по критериям АРА. Анализ показал, что чаще всего — в 61,6% случаев — имеет место митральная регургитация. При этом у 17,2% больных она была умеренной или выраженной. У 152 (51,2%) больных полипроекционное ЭХО-КГ-исследование структурных изменений створок клапанов не выявило. Более детальный анализ позволил выделить в отдельную группу 14 больных, которые имели в анамнезе ревматизм и ревматический порок сердца. РА эти больные заболели за 1–24 года до исследования (в среднем через 8,9 года). 7 человек из них имели характерные признаки ревматического митрального стеноза (у 3 — выраженного) в сочетании с митральной регургитацией разной выраженности и признаки аортального порока, который у 1 больной был диагностирован как сочетанный. У 2 больных митральный порок был в виде умеренной митральной недостаточности и комбинировался с недостаточностью аортального клапана. У 3 больных выявлены признаки ревматической недостаточности митрального клапана. У 2 больных отмечался выраженный сочетанный аортальный порок в комбинации с относительной недостаточностью митрального клапана.
Таким образом, наши данные подтверждают возможность заболевания РА лиц, ранее болевших ревматизмом и имеющих ревматические пороки сердца.
В отдельную группу были выделены 38 больных (средний возраст 58,7 года, давность РА 12,8 года) с наличием структурных изменений клапанного аппарата сердца в виде тотального краевого утолщения створок или отдельных очагов утолщения, нередко достигающих больших величин (13х6 мм), признаков кальциноза и ограничения подвижности створок. Створки митрального кольца оказались измененными у 19, аортального — у 33, трикуспидального — у 1 больной, причем у 16 пациентов были сочетанные изменения митрального и аортального клапанов, у 1 — митрального и трикуспидального. У 17 из 19 больных структурные изменения митральных створок сопровождались митральной регургитацией.
У 17 из 33 больных с изменениями аортальных створок диагностировалась аортальная регургитация, при этом у 12 она была умеренной или выраженной. У 16 больных, в том числе у 2 с признаками кальциноза, имел место склероз аортальных створок без нарушения функции клапана, что нашло свое подтверждение и неизмененным трансаортальным кровотоком. У 1 больной со значительным утолщением створок и умеренной аортальной регургитацией имелось ограничение открытия их (1-2 см) и повышение трансаортального градиента давления, т. е. признаки аортального стеноза. И еще у 1 больной 33-летнего возраста был диагностирован врожденный двухстворчатый аортальный клапан с признаками умеренной аортальной регургитации. Выраженная трикуспидальная регургитация была диагностирована у 3 больных с очаговым утолщением трикуспидальных створок, причем у 1 из них было диагностировано легочное сердце как осложнение ревматоидного поражения легких.
Возникает вопрос: все ли обнаруженные изменения у этой группы, состоящей из 33 больных, являются следствием РА? Анализ наших данных показал, что большинство больных этой группы были в возрасте 51–74 лет. У 19 из них диагностировалась артериальная гипертензия, имелись признаки ишемической болезни сердца, 4 больных перенесли инфаркт миокарда, 1 — острое нарушение мозгового кровообращения. Результаты исследования показали, что у лиц с высокими цифрами артериального давления изменения клапанного аппарата были более выраженными, и только у них диагностировался кальциноз митрального клапана и/или аортального клапана, признаки аортальной регургитации, гипертрофия стенки левого желудочка и межжелудочковой перегородки, а также утолщение стенок аорты с признаками дилятации и диастолическая дисфункция левого желудочка. Выявленные ЭХО-КГ-изменения в этой группе больных не отличаются от таковых при атеросклеротическом кардиосклерозе, атеросклерозе аорты и являются классическими. Поэтому в этой группе больных не представляется возможным исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в ЭХО-КГ-картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных.
Литература
1. Балабанова Р. М. Ревматоидный артрит. В кн.: Ревматические болезни (руководство по внутренним болезням)/ Под ред. В. А. Насоновой и Н. В. Бунчука. — М.: Медицина, 1997. С. 257-295.
2. Виноградова И. Б. Нарушение сердечного ритма и проводимости у больных ревматоидным артритом// Автореф. дис. … канд. мед. наук. М., 1998. С. 21.
3. Елисеев О. М. Амилоидоз сердца// Тер. арх. 1980. № 12. С. 116-121.
4. Котельникова Г. П. Поражение сердца при ревматоидном артрите// В сб.: Ревматоидный артрит. — М.: Медицина, 1983. С. 89-90.
5. Котельникова Г. П., Лукина Г. В., Муравьев Ю. В. Кардиальная патология при вторичном амилоидозе у больных ревматическими заболеваниями// Клин. ревматол. 1993. № 2. С. 5-8.
6. Немчинов Е. Н., Каневская М. З., Чичасова Н. В. и др. Пороки сердца у больных ревматоидным артритом (результаты многолетнего проспективного клинико-эхокардиографического исследования)// Тер. арх. 1994. № 5. С. 33-37.
7. Раденска-Лоповок С. Г. Морфологические методы исследования и диагностики в ревматологии В кн.: Ревматические болезни (руководство по внутренним болезням) под ред. В. А. Насоновой и Н. В. Бунчука. М.: Медицина, 1997. С. 80-94.
8. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке. Клинико-инструментальная диагностика и исходы: Автореф. дис. … д-ра мед. наук. М., 1997. С. 50
Источник
