Артрит и узи сердца
При обнаружении у больного РА митрального стеноза всегда необходимо исключать его ревматическую этиологию, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и в эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного эрозивно-деструктивного полиартрита с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается в 50-60% случаев [1, 4, 7]. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. Системные проявления РА, в том числе и поражение сердца, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение.
Морфологическая картина
| Рисунок 1. Интерстициальный миокардит, умеренный васкулит. Окр. гематоксилином и эозином. Х 150 |
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой — отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений [7]. В одних сосудах имеется васкулит, в других — гиалиноз, в третьих — склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным. В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных ревматоидным артритом нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, то есть при очередном выраженном обострении суставного синдрома.
Клиника
| Рисунок 2. Интерстициальный миокардит. Отложения липофусцина в перинуклеарных пространствах. Окр. гематоксилином и эозином. Х 400 |
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и не купирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [3].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [4].
Данные ЭКГ
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение интервалов ST, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
В литературе описано значительное число наблюдений, когда нарушение ритма сердца служит единственным патологическим симптомом поражения коронарных артерий. Нарушение ритма и проводимости при активном РА существенно чаще определяется при суточном мониторировании ЭКГ и чреспищеводном электрофизиологическом исследовании, чем при обычной ЭКГ. Так,
И. Б. Виноградова [2] при исследовании больных РА с использованием вышеуказанной методики выявила нарушение ритма и проводимости у 60% больных, в том числе предсердную (18%) и желудочковую (10%) экстрасистолию, пароксизмальную тахикардию (4%), мерцательную аритмию (6%), проходящую блокаду правой ножки пучка Гиса (20%) и атриовентрикулярную блокаду II степени (2%). Также было высказано предположение, что депрессия ST, выявляемая при чреспищеводном электрофизиологическом исследовании, является косвенным признаком изменения коронарной микроциркуляции вследствие ревматоидного васкулита. Поэтому у данных больных отмечены высокие уровни циркулирующих иммунных комплексов, ревматоидного фактора, антител к кардиолипину Ig M. Важно отметить, что в этой же группе больных имелись другие признаки васкулита: дигитальный артериит, сетчатое ливедо, синдром Рейно и ревматоидные узелки. Следовательно, если рутинные клинические методы исследования не выявляют достаточно убедительных признаков ревматоидного миокардита, то современные электрофизиологические исследования обнаруживают факты нарушений функции сердца, что указывает на связь этих изменений с активностью ревматоидного процесса. Подтверждением этому может служить положительная динамика изменений под влиянием адекватного лечения основного заболевания, обычно отмечаемая при регрессе суставного синдрома.
Дифференциальная диагностика
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, т. к. клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
| Рисунок 3. Утолщение перикарда. Склероз. Окр. гематоксилином и эозином. Х 150 |
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при ревматоидном артрите является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20-40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процессса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием. ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза инфаркта миокарда. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях ЭХО-изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [8].
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом. В литературе обсуждается возможность образования стенозов митрального и аортального клапанов, но единого мнения по этому вопросу нет [6]. При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, т. к. сочетание РА с предшествующим ревматическим пороком признается многими авторами [4].
С целью изучения характера клапанной патологии сердца при РА проанализированы результаты лечения 297 больных с достоверным РА по критериям АРА. Анализ показал, что чаще всего — в 61,6% случаев — имеет место митральная регургитация. При этом у 17,2% больных она была умеренной или выраженной. У 152 (51,2%) больных полипроекционное ЭХО-КГ-исследование структурных изменений створок клапанов не выявило. Более детальный анализ позволил выделить в отдельную группу 14 больных, которые имели в анамнезе ревматизм и ревматический порок сердца. РА эти больные заболели за 1–24 года до исследования (в среднем через 8,9 года). 7 человек из них имели характерные признаки ревматического митрального стеноза (у 3 — выраженного) в сочетании с митральной регургитацией разной выраженности и признаки аортального порока, который у 1 больной был диагностирован как сочетанный. У 2 больных митральный порок был в виде умеренной митральной недостаточности и комбинировался с недостаточностью аортального клапана. У 3 больных выявлены признаки ревматической недостаточности митрального клапана. У 2 больных отмечался выраженный сочетанный аортальный порок в комбинации с относительной недостаточностью митрального клапана.
Таким образом, наши данные подтверждают возможность заболевания РА лиц, ранее болевших ревматизмом и имеющих ревматические пороки сердца.
В отдельную группу были выделены 38 больных (средний возраст 58,7 года, давность РА 12,8 года) с наличием структурных изменений клапанного аппарата сердца в виде тотального краевого утолщения створок или отдельных очагов утолщения, нередко достигающих больших величин (13х6 мм), признаков кальциноза и ограничения подвижности створок. Створки митрального кольца оказались измененными у 19, аортального — у 33, трикуспидального — у 1 больной, причем у 16 пациентов были сочетанные изменения митрального и аортального клапанов, у 1 — митрального и трикуспидального. У 17 из 19 больных структурные изменения митральных створок сопровождались митральной регургитацией.
У 17 из 33 больных с изменениями аортальных створок диагностировалась аортальная регургитация, при этом у 12 она была умеренной или выраженной. У 16 больных, в том числе у 2 с признаками кальциноза, имел место склероз аортальных створок без нарушения функции клапана, что нашло свое подтверждение и неизмененным трансаортальным кровотоком. У 1 больной со значительным утолщением створок и умеренной аортальной регургитацией имелось ограничение открытия их (1-2 см) и повышение трансаортального градиента давления, т. е. признаки аортального стеноза. И еще у 1 больной 33-летнего возраста был диагностирован врожденный двухстворчатый аортальный клапан с признаками умеренной аортальной регургитации. Выраженная трикуспидальная регургитация была диагностирована у 3 больных с очаговым утолщением трикуспидальных створок, причем у 1 из них было диагностировано легочное сердце как осложнение ревматоидного поражения легких.
Возникает вопрос: все ли обнаруженные изменения у этой группы, состоящей из 33 больных, являются следствием РА? Анализ наших данных показал, что большинство больных этой группы были в возрасте 51–74 лет. У 19 из них диагностировалась артериальная гипертензия, имелись признаки ишемической болезни сердца, 4 больных перенесли инфаркт миокарда, 1 — острое нарушение мозгового кровообращения. Результаты исследования показали, что у лиц с высокими цифрами артериального давления изменения клапанного аппарата были более выраженными, и только у них диагностировался кальциноз митрального клапана и/или аортального клапана, признаки аортальной регургитации, гипертрофия стенки левого желудочка и межжелудочковой перегородки, а также утолщение стенок аорты с признаками дилятации и диастолическая дисфункция левого желудочка. Выявленные ЭХО-КГ-изменения в этой группе больных не отличаются от таковых при атеросклеротическом кардиосклерозе, атеросклерозе аорты и являются классическими. Поэтому в этой группе больных не представляется возможным исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в ЭХО-КГ-картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных.
Литература
1. Балабанова Р. М. Ревматоидный артрит. В кн.: Ревматические болезни (руководство по внутренним болезням)/ Под ред. В. А. Насоновой и Н. В. Бунчука. — М.: Медицина, 1997. С. 257-295.
2. Виноградова И. Б. Нарушение сердечного ритма и проводимости у больных ревматоидным артритом// Автореф. дис. … канд. мед. наук. М., 1998. С. 21.
3. Елисеев О. М. Амилоидоз сердца// Тер. арх. 1980. № 12. С. 116-121.
4. Котельникова Г. П. Поражение сердца при ревматоидном артрите// В сб.: Ревматоидный артрит. — М.: Медицина, 1983. С. 89-90.
5. Котельникова Г. П., Лукина Г. В., Муравьев Ю. В. Кардиальная патология при вторичном амилоидозе у больных ревматическими заболеваниями// Клин. ревматол. 1993. № 2. С. 5-8.
6. Немчинов Е. Н., Каневская М. З., Чичасова Н. В. и др. Пороки сердца у больных ревматоидным артритом (результаты многолетнего проспективного клинико-эхокардиографического исследования)// Тер. арх. 1994. № 5. С. 33-37.
7. Раденска-Лоповок С. Г. Морфологические методы исследования и диагностики в ревматологии В кн.: Ревматические болезни (руководство по внутренним болезням) под ред. В. А. Насоновой и Н. В. Бунчука. М.: Медицина, 1997. С. 80-94.
8. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке. Клинико-инструментальная диагностика и исходы: Автореф. дис. … д-ра мед. наук. М., 1997. С. 50
Источник
Введение
Проблема заболеваний суставов остается сложной и требует комплексного подхода к диагностике и лечению с привлечением специалистов разного профиля: лучевых диагностов, ортопедов-травматологов, ревматологов, реабилитологов, физиотерапевтов и т. д.
По состоянию на 2013 г. распространенность болезней костно-мышечной системы составляла в России 14 247 на 100 тыс. населения [1]. По данным Е.А. Галушко и Е.Л. Насонова, истинная распространенность ревматических заболеваний, полученная в ходе эпидемиологического исследования, превышает данные официальной статистики в 2,5 раза по ревматоидному артриту (РА), в 5 раз — по остеоартриту (ОА), в 3,5 раза — по спондилоартритам и в 3 раза — по системным заболеваниям соединительной ткани [2].
Поражение практически всех возрастных групп населения, склонность к хронизации и неуклонное прогрессирование ревматических заболеваний определяют важность их ранней диагностики. Выявление заболевания на ранней стадии позволяет не допустить стойкой утраты трудоспособности, выраженного снижения качества жизни и значительного увеличения стоимости лечения.
Современное ультразвуковое исследование (УЗИ) костно-мышечной системы заметно увеличивает диагностические и лечебные возможности клинициста. Интерес к расширению сферы применения ультразвука в диагностике заболеваний опорно-двигательного аппарата подтверждается постоянным ростом числа публикаций, посвященных изучению этого вопроса [3].
Благодаря своей портативности, доступности, быстроте выполнения, относительно низкой стоимости и практически полному отсутствию противопоказаний УЗИ представляется эффективным методом не только диагностики, но и оценки качества лечения [4].
Первые работы по УЗ-диагностике суставов, появившиеся в 1970-х гг., были посвящены исследованию крупных суставов и наиболее доступных околосуставных мягких тканей, в частности диагностике кисты Бейкера [5]. В 1972 г. МсDonald и Leopold впервые провели дифференциальную диагностику между тромбофлебитом и разрывом кисты Бейкера [6]. Ими же впервые было предложено использовать метод УЗ-сканирования в качестве скрининг-теста в случаях припухлости в подколенной области.
В это же время появляются и первые работы по применению УЗИ в ревматологии, в основном посвященные диагностике изменений коленных суставов при ревматоидном артрите [7].
В настоящее время в мировой практике УЗИ является одним из наиболее информативных методов визуализирующего обследования суставов благодаря высокой разрешающей способности в визуализации сухожильно-связочного аппарата, сосудов, гиалинового хряща и кортикального слоя кости.
Кроме того, УЗИ — это прямой контакт исследователя и пациента, дающий возможность непосредственно во время исследования сосредоточить внимание на беспокоящей зоне. При выполнении УЗИ сустава компрессия датчиком служит ориентировкой в поиске патологического участка. Такое обследование не требует какой-либо специальной подготовки, громоздкого оборудования и проводится в сжатые сроки [8].
Данные УЗИ в настоящее время входят в классификационные критерии ряда заболеваний [9]. Так, наличие поддельтовидного бурсита, теносиновита бицепса или синовита плечевых суставов включено в классификационные критерии Европейской лиги против ревматизма (European League Against Rheumatism, EULAR) для ревматической полимиалгии.
Каждый сустав состоит из суставных поверхностей костей, покрытых хрящом; суставной полости и суставной капсулы, окружающей сустав и укрепленной связками. К дополнительным элементам сустава относятся такие структуры, как мениски, внутрисуставные связки и сесамовидные кости [10]. Кости, образующие сустав, полностью отражают ультразвук, поэтому их объемная визуализация невозможна. Они лоцируются как эхогенные линейные образования, оставляющие широкую акустическую тень. Гиалиновый хрящ в норме визуализируется в виде узкой гипо- или анэхогенной полоски, структура и толщина которой могут быть оценены эхографически. Капсула лоцируется только в крупных суставах. Мениски в поперечном срезе визуализируются как гомогенные треугольные эхогенные зоны. Эхография позволяет оценить их структуру и целостность, а также выявить пролабирование в полость сустава.
Связки сустава визуализируются как переплетающиеся слабоэхогенные линии. Современные датчики высокого разрешения позволяют достаточно хорошо оценить их структуру. Суставная полость визуализируется в виде узкой анэхогенной зоны. Параартикулярные мягкие ткани, изменения в которых могут быть ассоциированы с заболеванием суставов или быть проявлением самостоятельной патологии (тендиниты, миозиты, фасцииты), также хорошо доступны визуализации при УЗИ.
Перечень показаний к проведению УЗИ суставов достаточно обширен. Следует отметить, что любые изменения в области суставов (травма, боль, ограничение движений, увеличение в объеме, припухлость, наличие пальпируемого образования) [11] требуют проведения УЗИ с целью первичной диагностики и динамического наблюдения в ходе лечения [8, 12, 13].
Исследование суставов проводится в разных сечениях: продольном, поперечном и косом. Кроме того, для получения более полной информации исследование сустава проводится в положениях сгибания, разгибания и вращения [13, 14].
Проведение УЗИ сустава предусматривает осмотр двух симметричных суставов, что может быть особенно важным для дифференциальной диагностики травматического поражения сустава и обострения ревматического заболевания, спровоцированного незначительным травмирующим фактором [13, 14].
Наиболее доступными для проведения УЗИ являются плечевой [15, 16], локтевой, коленный [11] и голеностопный суставы. Диагностическая ценность УЗИ такого сустава, как тазобедренный, очень сильно зависит от телосложения пациента и заметно снижается у лиц с повышенной массой тела. В то же время УЗИ тазобедренных суставов у новорожденных и детей первого года жизни является высокоинформативным методом в выявлении врожденной дисплазии суставов [17]. Не менее важным является УЗИ мелких суставов кистей, особенно в диагностике ревматоидного артрита [18].
УЗИ в диагностике ревматических заболеваний
Ревматоидный артрит
Согласно современным представлениям, РА — аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов [9]. Суставной синдром является главным проявлением РА. В процесс вовлекаются преимущественно мелкие суставы и околосуставные ткани. Ранняя диагностика РА обеспечивает быстрое начало терапии современными базисными противовоспалительными препаратами и применение генно-инженерной биологической терапии (ГИБТ), что позволяет достигнуть клинико-лабораторной ремиссии с замедлением воспалительных и деструктивных явлений и, в итоге, значительно улучшить прогноз заболевания.
В основе патогенеза РА лежит активация сложного цитокинового каскада, приводящего к воспалительной пролиферации синовиальной оболочки, развитию выраженного экссудативного синовита, пролиферации специфического паннуса с патологическим образованием сосудистой сети в нем, что в дальнейшем приводит к деструкции суставного хряща и субхондральной кости. Усиление васкуляризации паннуса и гипертрофированной синовиальной оболочки может служить индикатором активности РА, и, наоборот, на фоне терапии заболевания васкуляризация паннуса и синовии значительно снижается [19]. Показано, что УЗИ с цветовым и энергетическим допплеровским картированием обладает высокой чувствительностью в выявлении синовитов при РА. Сосудистые структуры четко визуализируются в местах эрозивных изменений хряща и кости.
Основным критерием оценки активности воспалительного процесса является выраженность васкуляризации синовиальной оболочки по данным энергетического допплеровского картирования (ЭДК).
Ведущим признаком, позволяющим верифицировать РА, является деструктивное поражение костей с образованием кист и эрозий на суставных поверхностях. Костные дефекты не всегда видны в ранней стадии РА при рентгенологическом исследовании.
УЗИ кистей достоверно чаще выявляет ранние эрозивные изменения в суставах, чем рентгенография [19, 20]. На эхограммах суставов больных РА отмечается значительное разрушение костных структур, формирующих поверхность суставов, хорошо визуализируются эрозии, особенно в области головок пястных костей [20, 21].
Остеоартрит
Значительную роль УЗИ играет и в диагностике ОА — гетерогенной группы заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц [9].
При проведении УЗИ может быть визуализировано истончение суставного хряща, появление «обломков» разрушенного хряща и кости («суставных мышей») в полости сустава, пролиферативные изменения краевых костных суставных поверхностей (остеофиты), нечеткость и неровность контуров суставных поверхностей, скопление жидкости в полости суставов, а также поражение внутрисуставных структур и параартикулярного аппарата в виде гипо- и дистрофических изменений [10, 22].
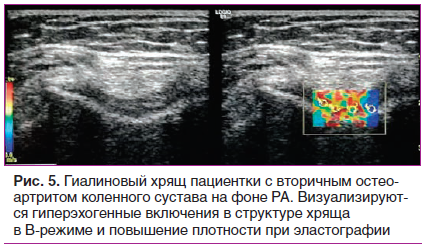
Крайне важна ранняя диагностика ОА, когда своевременное назначение хондропротекторов эффективно для воздействия на еще сохранный суставной хрящ. Здоровый хрящ визуализируется в виде ровной сплошной гомогенной анэхогенной полоски равномерной толщины (рис. 1). При ОА хрящ становится неравномерно истонченным, с нечеткими контурами и негомогенной структурой с возможными включениями (рис. 2) [10, 22].


Некоторые исследователи полагают, что при истончении гиалиновых хрящей, по данным УЗИ, менее 1,8 мм без визуализации жидкости назначение хондропротекторов будет эффективно для воздействия на еще сохранный суставной хрящ. Целесообразно также в этом случае рассмотреть возможность интраартикулярного введения препаратов гиалуроновой кислоты. Истончение гиалиновых хрящей менее 1,0 мм, изменение в синовиальных сумках и менисках в совокупности с рентгенологическими данными является показанием для эндопротезирования коленного сустава [11].
Поражение параартикулярного аппарата часто встречается как на фоне ОА и артритов различной этиологии, так и самостоятельно. Одним из самых наглядных примеров поражения параартикулярного аппарата является киста Бейкера — растянутая жидкостью синовиальная сумка подколенной ямки, расположенная в медиальном отделе между внутренней головкой икроножной мышцы и сухожилием полуперепончатой мышцы. Причинами возникновения кисты Бейкера могут быть ОА, РА, посттравматические состояния коленного сустава. Киста Бейкера визуализируется как образование округлой формы с четкими границами, анэхогенным содержимым, имеющее сообщение с полостью сустава через соустье. Особенностью кисты Бейкера является то, что при ее обнаружении устранить, как правило, надо не саму кисту, а вызвавшую ее причину [11].
При появлении бурситов и кист Бейкера размерами больше 70,0×15 мм рекомендуется проведение пункций с помощью УЗ-навигации. Эхография позволяет визуализировать иглу на всем протяжении ее введения, избежать повреждения сосудов, нервных стволов, эвакуировать содержимое из места патологического изменения и провести внутрисуставную инъекцию препаратов (глюкокортикостероиды, гиалуронаты) [11, 24, 25].
Спондилоартриты
Возрастает роль УЗИ и в диагностике изменений мышечно-скелетной системы у пациентов со спондилоартритами. Спондилоартриты — группа хронических системных воспалительных заболеваний позвоночника, суставов, энтезисов, характеризующаяся общими клиническими, рентгенологическими и генетическими особенностями [26]. Это гетерогенная группа заболеваний, включающая в себя анкилозирующий спондилит (болезнь Бехтерева), реактивный артрит (РеА), псориатический артрит (ПсА), спондилоартрит, ассоциированный с воспалительными заболеваниями кишечника, ювенильный спондилоартрит и недифференцированный спондилоартрит [27].
У пациентов со спондилоартритами УЗИ позволяет визуализировать выпот в суставе, даже когда клинически нет выраженных проявлений [28]. Также опытный сонографист выявляет тендиниты, теносиновиты, разрывы сухожилий, энтезиты, гипертрофию синовии и костные эрозии [28].
Подошвенный фасциит как самая частая причина боли в стопе у пациентов со спондилоартритом выявляется в виде утолщения плантарной фасции, снижения ее эхогенности и окружающего отека. Все это относится к основным патологическим УЗ-маркерам спондилоартрита.
Показана возможность диагностики и дифференциальной диагностики острого и хронического течения реактивного артрита с применением УЗИ [29].
Энтезиты как наиболее характерный признак всех нозологических форм из группы спондилоартритов доступны визуализации в энергетическом допплеровском режиме, позволяющем оценить степень васкуляризации (неоангиогенеза) в проблемной области [30, 31]. По изменению выраженности неоангиогенеза также можно судить и об эффективности местного и системного лечения [32].
Подагра и субклинические состояния
Установлено, что УЗИ позволяет визуализировать подагрические тофусы и ксантомы в области ахиллова сухожилия.
В последнее время все больше внимания уделяется возможности применения ультразвука для выявления субклинических состояний [33]. Так, M.A. Reuss-Borst, C.A. Pape, A.K. Tausche в 2014 г. показали наличие специфических для подагры сонографических изменений в суставах у пациентов с бессимптомной гиперурикемией [34], а B. Elnady et al. в 2019 г. показали с применением серошкального УЗИ и энергетического допплеровского картирования наличие у 39,5% пациентов с вульгарным псориазом бессимптомных энтезитов и синовитов [35].
Перспективы применения УЗИ в диагностике ревматических заболеваний
Методы УЗ-диагностики постоянно совершенствуются. Успешно проходят апробацию и внедряются в практику новые методики. Так, в ряде исследований показано, что при использовании контрастного агента происходит повышение сигнала с гиперваскуляризированного синовия, интенсификация цветового сигнала, более отчетливо дифференцируются синовиты, некрозы или фиброзы в воспалительно измененных суставах [36]. Технология мультимодальной визуализации «фьюжн» («слияние») позволяет проводить УЗИ с одновременным выводом на экран соответствующих срезов КТ или МРТ.
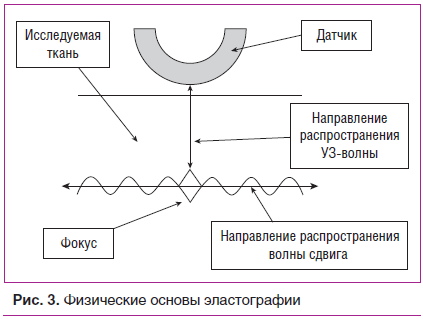
С развитием УЗ-методов появилась возможность оценить и механические свойства мягких тканей. Так, соноэластография позволяет определить эластичность мягкотканных структур. Метод основан на определении деформируемости ткани, которая зависит от ее структуры и состава. Эластичность определяется модулем Юнга, который отображает свойства материала сопротивляться растяжению или сжатию при упругой деформации. Основные методики, используемые в настоящее время, включают компрессионную (квазистатическую) эластографию и эластографию сдвиговой волны (динамическую) [37–39].
Принцип эластографии сдвиговой волны основан на измерении распределения скоростей волны упругой деформации ткани, полученной с помощью УЗ-импульса (рис. 3). Эта методика позволяет провести не только качественную оценку в виде цветных эластограмм, но и количественные измерения в килопаскалях или сантиметрах в секунду [40].
Известно, что эластичность мягких тканей, таких как подкожная жировая клетчатка, мышцы и соединительная ткань, составляет приблизительно от 1 до 103 кПа. Выявлено также, что злокачественные новообразования имеют большую жесткость по сравнению с нормальными тканями. Этим обусловлено широкое применение метода эластографии в диагностике заболеваний печени, молочных, щитовидной и предстательной желез [39].
Эластичность мягкотканных структур опорно-двигательного аппарата также может быть изменена под воздействием различных патологических процессов, таких как микроповреждения, воспаление, фиброзирование и кальциноз.
Первые публикации о применении эластографии для оценки эластичности скелетных мышц появились еще в середине 1990-х гг. [41]. С конца прошлого десятилетия стали появляться отдельные публикации по эластографическому исследованию сухожилий различных локализаций, в первую очередь ахиллова сухожилия. Ряд публикаций посвящен возможности получения информации о жесткости сухожилия в режиме реального времени как в норме [42], так и при дегенеративных изменениях [43], а также оценки механических свойств сухожилия в динамике на фоне проводимой терапии [44]. Интересны, на наш взгляд, и находки, показывающие разнонаправленные изменения плотности в различных связках и сухожилиях при тендопатиях. Так, B.K. Coombes et al., оценив плотность ахиллова сухожилия и собственной связки надколенника с применением эластографии сдвиговой волны, показали увеличение плотности собственной связки надколенника и снижение плотности ахиллова сухожилия у пациентов с тендопатией в сравнении с контрольной группой здоровых добровольцев [45]. Однако некоторые исследования показывают, что при тендопатии ахиллова сухожилия в области его прикрепления к кости (энтезиса) отмечается повышение жесткости, обусловленное, скорее всего, формированием энтезофитов и кальцификацией сухожилия [46]. Также показано, что соноэластография позволяет обнаружить дегенеративные изменения сухожилий, кальцификаты в толще сухожилий, которые трудно выявить с помощью других методов исследования [47].
В последнее время появляются новые сообщения о диагностических возможностях метода эластографии при ревматологических заболеваниях. Так, E. Cindila et al. показано достоверное различие в эластичности больших слюнных желез у пациентов с синдромом Шегрена [48]. Q. Wang et al. сообщают об использовании эластографии сдвиговой волны для определения показателей жесткости мягкотканных структур в области первого плюснефалангового сустава в межприступный период и при обострении подагры [49]. Активно изучается возможность применения методики исследования сухожилий при склеродермии, анкилозирующем спондилите. Наш личный опыт показывает возможность определения эластичности гиалинового хряща коленного сустава, что может быть использовано в динамической оценке эффективности хондропротективной терапии, однако требует дальнейшего изучения (рис. 4, 5).


Заключение
Современные методы УЗИ суставов благодаря быстроте выполнения, относительно невысокой стоимости, отсутствию противопоказаний и высокой разрешающей способности значительно расширяют лечебно-диагностические возможности ревматолога и позволяют кон?
