Елисеев м с подагра
Подагра – системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия в различных тканях и развивающимся в связи с этим воспалением, у лиц с гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами [1], одно из наиболее распространенных хронических заболеваний опорно–двигательного аппарата, особенно у мужчин среднего возраста.
По данным C.M. Harris с соавт., исследовавшим распространенность подагры в Англии, заболевание встречается в среднем у 1,64% мужчин и 0,29% женщин, непрерывно увеличиваясь с возрастом и достигая пика в возрасте старше 75 лет (5,3% мужчин и 2,8% женщин) [2]. Эпидемиологические данные свидетельствуют о непрерывном истинном росте заболеваемости подагрой в последние десятилетия, не обусловленном улучшением диагностики и приемом мочегонных препаратов [3]. Так, рядом работ показано, что заболеваемость подагрой за последние 10–20 лет возросла более чем вдвое [3,4]. Имеются данные и о снижении возраста дебюта подагры. При сравнении двух групп больных подагрой, диагностированной с 1983 г. по 1991 г. и с 1992 г. по 2000 г., возраст дебюта заболевания снизился почти на 3 года. Возросла частота женской и семейной подагры, нефролитиаза, а также некоторых характерных для больных подагрой коморбидных состояний – ожирения, гипертриглицеридемии и инсулинорезистентности [5].
Причины образования кристаллов, которые откладываются в виде депозитов различных размеров, называемых тофусами, до сих пор до конца не ясны. Небольшие тофусы обнаруживаются во многих органах и тканях уже в дебюте заболевания, а в случае хронического течения подагры постепенно формируются и крупные подкожные тофусы, обычно в области ушных раковин и суставов. Однако доказано, что главным фактором риска развития подагры является ГУ: вероятность развития подагры при сывороточном уровне мочевой кислоты (МК) >540 mмоль/л в 45 раз выше, чем у лиц с уровнем урикемии <420 mмоль/л [6]. Многократно увеличивают риск развития подагры и ГУ некоторые обменные нарушения, часто выявляемые у больных подагрой. Известно, что у большей части больных подагрой выявляются не только способствующие развитию и прогрессии атеросклероза отдельные метаболические нарушения, к которым прежде всего относят ожирение, нарушения углеводного и липидного обменов, повышение артериального давления; но и их комбинации, объединяемые термином «метаболический синдром» (МС). Применение рабочих критериев диагностики МС экспертов NCEP/ATP III при обследовании 312 больных подагрой в Институте ревматологии РАМН позволило выявить МС у 68% из них, сахарный диабет тип 2 (СД 2) выявлялся у 18%, артериальная гипертензия – у 83%, инсулинорезистентность – у 67%, перенесли инфаркт миокарда или инсульт 15% больных [7]. Результаты обследования более 8800 американцев в рамках исследовательской программы NHANES III показали, что частота МС у больных подагрой в разных возрастных группах в среднем более чем в 2 раза превышает таковую в популяции, достигая 65% в возрасте старше 60 лет [9]. Столь частое выявление не случайно, и уже сейчас можно утверждать, что именно МС во многом определяет клиническую картину заболевания. Установлено, что показатели, определяющие тяжесть течения подагры (частота приступов артрита, хроническое течение артрита, количество пораженных за время болезни суставов и выраженностью ГУ), ассоциируются с наличием как собственно МС, так и основных его составляющих (инсулинорезистентностью, ожирением, СД 2, нарушениями липидного обмена) [8,9]. Известно, что в нормальных концентрациях инсулин не влияет на выведение почками МК. Но в условиях свойственной инсулинорезистентности и МС гиперинсулинемии повышается реабсорбция натрия в проксимальных канальцах почек, приводя к активации уратно–ОН–каналов и, опосредованно, к увеличению реабсорбции уратов, способствуя, в конечном итоге, развитию ГУ и повышению АД [11]. Схожий механизм развития ГУ наблюдается при приеме мочегонных препаратов, ацетилсалициловой кислоты, злоупотреблении алкоголем. Исследование 36 больных подагрой с СД 2, проведенное в Институте ревматологии РАМН, показало, что при умеренной гипергликемии урикозурический эффект глюкозы нивелируется высоким уровнем инсулина у этих больных и сывороточный уровень МК остается высоким [11]. Динамические исследования неопровержимо свидетельствуют, что еще одним независимым фактором риска развития подагры у пациентов с асимптоматической ГУ является ожирение. При ожирении не только снижается почечная экскреция уратов, но в значительной мере возрастает и их продукция [12], увеличивая вероятность развития подагры более чем в три раза [13]. В несколько раз выше заболеваемость подагрой и у больных с нелеченной артериальной гипертензией [14].
«Золотым стандартом» диагностики подагры считается выявление кристаллов моноурата натрия при помощи поляризационной микроскопии или химическим методом в любых доступных для исследования средах (синовиальной жидкости, тофусе, синовиальной оболочке, слизистой оболочке желудка). В то же время идентификация кристаллов, несмотря на высокую чувствительность и специфичность, до сих пор не считается рутинным методом, требует от исследователя большого опыта, и при невозможности выявления кристаллов для диагностики подагры пользуются клиническими, рентгенологическими и лабораторными признаками, входящими в набор современных диагностических критериев подагры [15]. В этом случае диагноз вероятной подагры выставляется при наличии не менее 6 из 12 перечисленных ниже признаков (табл. 1).
Основным клиническим проявлением подагры является острый, начинающийся внезапно артрит, характеризующийся быстро нарастающей сильнейшей болью, гиперемией и гипертермией, протекающий в большинстве случаев по типу моноартрита. Более чем в половине случаев в дебюте заболевания поражается первый плюснефаланговый сустав, реже – суставы плюсны, коленный и голеностопный суставы. Провоцирующими факторами развития подагрической атаки могут являться травмы, переохлаждение, прием алкоголя, обильное потребление мяса и жирной пищи. Длительность приступов подагрического артрита, как правило, не превышает нескольких дней, значительно сокращаясь при приеме противовоспалительных средств. После атаки артрита наступает бессимптомный интервал, называемый межприступным периодом. Простота купирования первых приступов артрита и относительно длительные межприступные периоды в дебюте заболевания не должны вводить в заблуждение. Частота и длительность подагрических атак при отсутствии лечения постепенно увеличивается, межприступный период сокращается, вовлекаются новые суставы, эффективность противовоспалительных препаратов снижается, что при отсутствии адекватной терапии влечет за собой формирование тофусной формы заболевания и хронического течения артрита. Таким образом, цель лечения подагры заключается не только в быстром и безопасном купировании острого подагрического артрита, но должна быть направлена и на предотвращение рецидивов, развития хронической тофусной подагры.
Наиболее широко при терапии острого подагрического артрита используются нестероидные противовоспалительные препараты (НПВП), рекомендованные для применения с этой целью экспертами Европейской антиревматической лиги по диагностике и лечению подагры [16]. Использование НПВП более чем в 90% случаев приводит к полному купированию острого приступа артрита в течение 5–8 дней, причем, учитывая большую безопасность и, по некоторым данным, эффективность, применение селективных ЦОГ–2 ингибиторов может иметь преимущества перед неселективными НПВП [17]. Данные исследования, проведенного в ГУ Институт ревматологии РАМН и посвященного сравнению быстроты развития противовоспалительного и анальгетического эффектов различных НПВП при подагре, продемонстрировали большую эффективность использования у больных селективного ингибитора ЦОГ–2 нимесулида по сравнению с диклофенаком натрия; а сравнение гранулированной формы нимесулида (Нимесил®) с таблетированной показало превосходство первой [18]. Еще одним важным результатом этого исследования явился тот факт, что значительная положительная динамика в отношении боли и воспаления у больных, принимавших нимесулид, особенно в случае использования гранулированной формы препарата, прослеживалась даже в случае поражения нескольких суставов и при отсутствии эффекта от проводимой ранее терапии другими НПВП.
Не менее широко распространено в некоторых странах Европы применение колхицина, экстракта луковицы лугового шафрана (Colchicum autumnale). В последние годы пересматривается отношение к рекомендуемой с середины ХХ века схеме приема колхицина, основанной на назначении высоких доз препарата (по 0,5 мг каждые 1–2 ч, максимально до 6 мг за 12 ч) либо до наступления клинического эффекта, либо до появления побочных реакций (тошнота, рвота или диарея) [19]. Дело в том, что при сравнимой с НПВП эффективности для колхицина, помимо гастроэнтерологических осложнений, характерно частое развитие тяжелых побочных реакций, прежде всего поражения печени, острой почечной недостаточности и миелосупрессии. Предлагаются альтернативные схемы применения колхицина (по 0,5 мг 2–3 раза в сутки), отличающиеся хорошей эффективностью и переносимостью даже у больных со сниженной почечной функцией [20]. Тем не менее применение колхицина в настоящее время в США ограничено.
В случае неэффективности или наличия противопоказаний к применению НПВП и колхицина используют внутрисуставные инъекции глюкокортикоидов [21]. Однако необходимо помнить, что применение глюкокортикоидов при подагре (особенно внутривенное или внутримышечное введение препаратов) связывается с достаточно большим процентом ребаунд–синдрома (повторного обострения) и побочных эффектов, что требует нахождения больного в стационаре.
Считается обоснованным и параллельное использование для купирования острого приступа подагрического артрита фармакологических и нефармакологических методов лечения, в частности, локального применения криотерапии совместно с НПВП [17].
Основным методом терапии хронической тофусной подагры и профилактики приступов острых подагрических атак является назначение антигиперурикемических лекарственных препаратов (ингибиторы ксантиноксидазы – аллопуринол и пуринол; и урикозурические препараты) в комбинации с немедикаментозными методами лечения (диетотерапия, отказ от приема алкоголя, необоснованного применения диуретиков и низких доз салицилатов). Основной задачей терапии является достижение стойкой нормоурикемии – целевого сывороточного уровня МК ниже 360 мкмоль/л, минимизирующего вероятность развития подагрического артрита и предотвращающего формирование тофусов [17].
Большое значение для больных подагрой может иметь и адекватная коррекция отдельных метаболических нарушений. Например, соблюдение низкокалорийной диеты, как оказалось, имеет ряд преимуществ перед общепринятой при подагре низкопуриновой диетой, приводя к достоверному снижению сывороточного уровня МК уже в первые дни терапии, что может быть объяснено параллельным снижением уровня инсулина и выраженности ИР [22]. Рекомендованы к применению при подагре препараты, применяемые для лечения артериальной гипертензии (лозартан) и нарушений обмена липидов (фенофибрат), обладающие небольшим урикозурическим эффектом [17]. Назначение больным подагрой с нарушениями углеводного обмена метформина, в основе действия которого лежит способность к увеличению чувствительности тканей к инсулину, приводило к снижению сывороточного уровня МК в среднем на 22%, было отмечено уменьшение числа больных с хроническим артритом, количества пораженных на момент осмотра суставов и частоты приступов артрита [7,23].
Таким образом, своевременная диагностика, адекватная терапия подагры должны проводиться с учетом новых данных о патогенезе, клинических проявлениях и эпидемиологии подагры.
Литература
1. Насонова В.А., Барскова В.Г. Ранние диагностика и лечение подагры – научно обоснованное требование улучшения трудового и жизненного прогноза больных. Научно–практическая ревматология 2004; 1: 5–7.
2. Harris C.M., Lloyd D.C., Lewis J. The prevalence and prophylaxis of gout in England. J. Clin. Epidemiol. 1995, 48:1153–1158.
3. Arromdee E., Michet C.J., Crowson C.S. et al. Epidemiology of Gout: Is the Incidence Rising? J. Rheumatol. 2002, 29:2403–2406.
4. Wallace K.L., Riedel A.A., Joseph–Ridge N., Wortmann R. Increasing prevalence of gout and hyperuricemia over 10 years among older adult in a managed care population. J. Rheumatol. 2004; 31:1582–1587.
5. Chen S.Y., Chen C.L., Shen M.L. et al. Trends in the manifestations of gout in Taiwan. Rheumatology (Oxford). 2003; 42:1529–1533.
6. Campion E.W., Glynn R.J., DeLabry L.O. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study. Am. J. Med. 1987; 82:21–26.
7. Барскова В. Г. Метаболический синдром и кардиоваскулярные нарушения при подагре. Докторская диссертация. М., 2006, 291.
8. Choi H. K., Ford E. S., Li С., Curhan G. Prevalence of the Metabolic Syndrome in Patients With Gout: The Third National Health and Nutrition Examination Survey. Arthritis Rheum. 2007; 57: 109–115.
9. Eliseev M. S., Barskova V. G., Nassonova V. A., Nassonov E. L. Insulin resistance syndrome in patients with gout and its influence on uric acid concentration and severity of arthritis. Abstracts. Ann. Rheum. Dis. 2006; 65(Suppl II): 432.
10. Facchini F., Ida Chen Y. D., Hollenbeck C. B., Reaven G. M. Relationship between resistance to insulin mediated glucose uptake, urinary acid clearance and plasma uric acid concentration. JAMA 1991; 266:3008–3011.
11. Елисеев М.С., Барскова В.Г., Насонов Е.Л. и др. Особенности подагры, протекающей с сахарным диабетом 2 типа. Клин. Геронтология 2005; 4: 7–13.
12. Dessein P., Shipton E., Stanwix A. et al. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study. Ann. Rheum. Dis. 2000; 59: 539–543.
13. Choi H., Atkinson K., Karlson E., Curhan G. Obesity, weight change, hypertension, diuretic use, and risk of gout in men. Arch. Intern. Med. 2005; 165: 742–748.
14. Grodzicki T., Palmer A., Bulpitt C. J. Incidence of diabetes and gout in patients during 8 years of follow–up. The General Practice Hypertension Study Group. J. Hum. Hypertens. 1997; 11(9): 583–585.
15. Wallace S.L., Robinson H., Masi A.T. et al. Preliminary criteria for the classification of the acute arthritis of gout. Arthritis Rheum. 1977; 20:895–900.
16. Zhang W., Doherty M., Pascual–Gomez E. et al. EULAR evidence based recommendation for the diagnosis and management of gout. Ann. Rheum. Dis. 2005; 64(Suppl III):501.
17. Zhang W., Doherty M., Bardin T. et al. Clinical Studies Including Therapeutics (ESCISIT) EULAR Standing Committee For International Part II: Management. Report of a task force of the EULAR evidence based recommendations for gout. Ann. Rheum. Dis. 2006; 65:1312–1324.
18. Кудаева Ф.М., Елисеев М.С., Барскова В.Г., Насонова В.А. Сравнение скорости наступления анальгетического и противовоспалительного эффектов различных форм нимесулида и диклофенака натрия при подагрическом артрите. Тер. архив 2007; 5:35–40.
19. Hollander J.L. Arthritis and Allied Conditions: A Textbook of Rheumatology. 6th Edition. Philadelphia: Lea & Febiger; 1960.
20. Morris I., Varughese G., Mattingly P. Colchicine in acute gout. BMJ 2003, 327:1275–1276.
21. Fernandez C., Noguera R., Gonzalez J.A. et al. Treatment of acute attacks of gout with small doses of intraarticular triamcinolone acetonide. J. Rheumatol. 1999; 26:2285–2286.
22. Dessein P., Shipton E., Stanwix A. et al. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study. Ann. Rheum. Dis. 2000; 59: 539–543.
23. Eliseev M.S., Barskova V.G., Volkov A.V. et al. The efficacy and safety of metformin treatment in gouty patients with insulin resistence syndrome (pilot case control 6–months study). Ann. Rheum. Dis. 2005; 64(Suppl III):500.
Источник
В статье рассмотрены трудности диагностики и лечения сочетания подагры и болезни депонирования пирофосфатов кальция. Описано применение современных методов диагностики. Обсужден подбор адекватной противовоспалительной терапии при остром, в т. ч. часто рецидивирующем, артрите у пациента с учетом противопоказаний и сопутствующих заболеваний.
Микрокристаллические артриты – группа заболеваний, обусловленных воспалением в местах отложения образующихся in vivo кристаллов. К ним относятся заболевания с принципиально различной этиологией и патогенезом. И хотя провоспалительный потенциал для различных кристаллов отличается (кристаллов моноурата натрия, пирофосфата кальция, гидроксиапатита и др.), все они клинически могут проявляться острым воспалением, чаще артритом или периартикулярным поражением одного или нескольких суставов. Наиболее часто микрокристаллические артриты вызываются кристаллами уратов (подагра) и пирофосфата кальция (болезнь депонирования пирофосфатов кальция (БДПК)).
Подагра является наиболее частой причиной артритов у взрослых, не реже, по крайней мере в пожилом и старческом возрасте, выявляется БДПК. Клиническая картина БДПК нередко напоминает подагру – примерно в четверти случаев клинически она проявляется острыми приступами артрита, практически неотличимыми от таковых при подагре, полностью оправдывая один из исторических вариантов названия заболевания – «псевдоподагра» [1]. Кроме того, возможно сочетание двух заболеваний, что значительно затрудняет не только диагностику, но и подбор терапии [2–4]. Более того, по некоторым данным, подагра может быть также фактором риска развития БДПК [5].
Эпидемиологических исследований сочетания подагры и БДПК не проводилось. Однако в клинической практике сочетание двух микрокристаллических артритов – довольно частое явление [3, 6]. Ниже приведен клинический случай выявления у пациента двух микрокристаллических артритов.
Пациент Е., 56 лет, дебют заболевания в 2011 г. с развития острого олигоартрита (1-го плюснефалангового и голеностопного суставов). Артрит купировался самостоятельно в течение 8 дней. В последующем отмечались рецидивы артрита 1-х плюснефаланговых, голеностопных, предплюсны с частотой до 3–4 раз в год, при обострении с успехом применял НПВП (диклофенак натрия в/м). Уровень мочевой кислоты (МК) стойко превышал 500 мкмоль/л. С 2014 г. – резкое учащение частоты приступов (ежемесячно), стали вовлекаться коленные суставы, применение диклофенака стало менее действенным, потребность в нем увеличилась. Тогда же появились боли в эпигастрии после приема пищи, по результатам эзофагогастродуоденоскопии впервые выявлен эрозивный гастрит. Вскоре (в ноябре 2014 г.) был консультирован в ФГБНУ НИИР им. В.А. Насоновой, где был верифицирован диагноз подагры, подтвержденный результатами поляризационной микроскопии, выявившей кристаллы моноурата натрия в синовиальной жидкости. Сывороточный уровень МК составил 585 мкмоль/л. После купирования артрита была инициирована уратснижающая терапия – аллопуринол в стартовой дозе 100 мг/сут с последующим постепенным увеличением до 600 мг/сут, к апрелю 2015 г. был достигнут целевой уровень МК (360 мкмоль/л). Низкий сывороточный уровень МК, не превышающий целевой, сохранялся и в дальнейшем. Приступы артрита сохранялись вплоть до июня 2015 г., от профилактики приступов и противовоспалительной терапии воздерживался, т. к. прием НПВП приводил к возникновению болей в эпигастральной области.
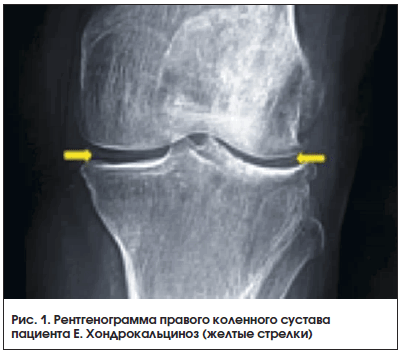
В декабре 2015 г., при сохраняющейся нормоурикемии, было отмечено последовательное развитие артритов коленных, затем плечевых суставов, суставов кистей. Пациент самостоятельно принимал НПВП (эторикоксиб 120 мг), боли уменьшались, но при этом происходило неконтролируемое повышение АД, требующее назначения антигипертензивной терапии. В апреле 2016 г. пациент повторно обратился в НИИ ревматологии с жалобами на боль, припухлость в плечевых, коленных суставах, суставах кистей. При осмотре были определены артриты проксимальных межфаланговых суставов обеих кистей, плечевого сустава справа, коленного сустава справа. Уровень МК сыворотки сохранялся стабильно ниже 300 мкмоль/л. C целью исключения дебюта ревматоидного артрита (РА) проведено иммунологическое исследование, по результатам РФ и АЦЦП – в норме, СРБ – 23 мл/мл, СОЭ –27 мм/ч, число болезненных суставов – 6, число припухших суставов – 4. В диагностический поиск был включен среди возможных и диагноз БДПК. В результате обследования проведена также рентгенография коленных суставов, выявившая типичные признаки БДПК (хондрокальциноз) (рис. 1). 
При повторном исследовании синовиальной жидкости были выявлены кристаллы пирофосфатов кальция, тогда как кристаллы моноурата натрия не определялись. Таким образом, был верифицирован диагноз второго микрокристаллического заболевания – БДПК. С целью купирования артрита пациенту был назначен колхицин в дозе 1 мг/сут, эффект расценен как недостаточный, повышение дозы до 1,5 мг/сут привело к выраженной диарее, потребовавшей отмены препарата. Несмотря на анамнестические данные о нежелательных явлениях при приеме НПВП (диклофенак – эрозивный гастрит, эторикоксиб – повышение АД), был назначен амтолметин гуацин (Найзилат) в суточной дозе 1200 мг (600 мг 2 р./сут). В течение 1 нед. артрит был полностью купирован, однако менее через 1 мес. развился рецидив артрита коленных суставов, прием Найзилата был возобновлен в прежней дозе, со столь же хорошим эффектом. После купирования приступа через 7 дней приема доза препарата была снижена до поддерживающей (600 мг/сут). При дальнейшем динамическом наблюдении на протяжении 6 мес. приступов артрита зарегистрировано не было, боли в суставах не беспокоили.
Обсуждение
Диагностика подагры и БДПК нередко вызывает затруднения – частое пересечение отдельных клинических симптомов у пациентов с микрокристаллическими артритами не позволяет выставить определенный диагноз только на основании клинической картины заболевания. Как правило, в начале болезни и подагра, и, нередко, пирофосфатная артропатия проявляются приступами острого артрита, характеризующимися сильнейшей болью, припуханием окружающих тканей, гиперемией и гипертермией кожного покрова над пораженным суставом, которые сменяются межприступными периодами. Кроме того, и подагра, и БДПК могут часто сочетаться как между собой, так и с другими ревматическими заболеваниями, что также затрудняет установление достоверного диагноза [3, 6–10].
У данного пациента трудности при верификации диагноза БДПК возникли не только из-за наличия у него достоверного диагноза подагры, на который при желании можно было бы списать новые приступы артрита, но и из-за возможности симулирования БДПК еще одного ревматического заболевания – РА. Так, наличие стойких симметричных артритов суставов верхних конечностей, в т. ч. кистей, повышение сывороточного уровня СРБ потребовало включения в диагностический поиск РА. Однако число вовлеченных суставов не превышало шести, а мелких суставов кистей – двух; повышение уровня СРБ было незначительным (менее чем 2-кратным). И даже если брать за основу диагностические критерии АСR/EULАR, то диагноз РА выставлен быть не может [11–13].
Напротив, диагноз подагры сомнению не подлежал исходно, кроме того, был подтвержден выявлением кристаллов моноурата натрия в синовиальной жидкости, а после подбора уратснижающей терапии пациент находился в состоянии ремиссии (полное отсутствие клинических проявлений заболевания). При подагре это отсутствие приступов острого артрита может быть достигнуто только при достижении стойкой нормоурикемии, под которой подразумевается уровень МК менее 360 мкмоль/л [14].
Именно факт наличия стойкой нормоурикемии позволил предположить наличие второго заболевания, вызвавшего обострение. Решающее значение в диагностике этих заболеваний имело выявление соответствующих кристаллов в синовиальной жидкости [1, 15]. И если исчезновение кристаллов моноурата натрия объясняется стойкой нормоурикемией, при которой имеющиеся кристаллы рассасываются, то, напротив, появление кристаллов пирофосфата кальция связано с «выходом» их в синовиальную жидкость из постепенно разрушающегося хряща в достаточном количестве, т. к. насыщаемость ими синовиальной жидкости не столь велика. Таким образом, сочетание двух основных признаков БДПК: выявление кристаллов пирофосфата кальция в синовиальной жидкости и типичные признаки хондрокальциноза по результатам рентгенологического исследования суставов позволили выставить пациенту диагноз достоверной БДПК. При этом даже при отсутствии рентгенологических признаков хондрокальциноза диагноз БДПК этому пациенту не исключался бы, т. к. рентгенография обладает низким разрешением при выявлении небольших депозитов кристаллов. В этом отношении более информативным является УЗИ, использование которого для выявления депозитов кристаллов пирофосфатов кальция может быть дополнительным инструментом ранней диагностики (табл.1) [1, 16]. 
Другим вопросом, который предстояло решить, был выбор оптимальной симптоматической терапии. Несмотря на высокую частоту БДПК, полиморфизм симптомов, диктующий необходимость дифференцированного подхода к выбору оптимальной схемы терапии, исследования, посвященные изучению эффективности и безопасности лекарственных препаратов при БДПК, крайне малочисленны, а рандомизированные контролируемые исследования и вовсе отсутствуют. В то же время список лекарственных средств, применяемых при БДПК, достаточно широк: НПВП, колхицин, низкие дозы глюкокортикоидов, гидроксихлорохин, метотрексат, биологические агенты (ингибиторы интерлейкина 1) [17]. Согласно рекомендациям, при остром приступе возможно назначение НПВП, колхицина [1, 18]. Однако назначение колхицина в необходимых дозах вызывало у пациента развитие нежелательных явлений, ограничивающих его применение (как и использовавшиеся ранее НПВП).
Очевидно, что когда НПВП используются в течение короткого или относительно короткого времени, в большей степени важен контроль побочных эффектов, связанных с ЖКТ. Хорошо известно, что опасная патология ЖКТ (язвы, кровотечение, перфорация) может возникать в первые дни или даже часы после парентерального введения или перорального приема НПВП. В этом плане очень показательны данные финских исследователей A. Helin-Salmivaara et al., которые оценили зависимость риска развития ЖК-осложнений от длительности приема НПВП. Материалом для анализа стало популяционное исследование по типу «случай/контроль», в котором в основную группу был включен 9191 больной с ЖК-кровотечением, язвой или перфорацией, а в контрольную группу – 41 780 лиц без данной патологии. Оказалось, что опасность развития данных осложнений была максимальной в первые 2 нед. приема НПВП (ОШ 3,2), а затем существенно снижалась [19].
У данного пациента упорный рецидивирующий артрит обусловил необходимость постоянного приема НПВП, с одной стороны, обладающих достаточно выраженной противовоспалительной активностью, с другой – не вызывающих нежелательных явлений со стороны ЖКТ. Для лечения требовался препарат, который обладал бы анальгетической и противовоспалительной активностью традиционных представителей этой лекарственной группы, но не имел бы при этом свойственных им специфических недостатков. К сожалению, ни одно из предложенных на сегодня решений этой проблемы нельзя признать идеальным [20].
Наш выбор пал на амтолметин гуацил (Найзилат). Амтолметин гуацил как молекула был синтезирован в Италии в 1985 г. Его предшественник толметин – это хорошо изученный неселективный НПВП, который никогда не был представлен в России, однако широко применялся во всем мире. Толметин характеризуется хорошим обезболивающим и противовоспалительным эффектом, а дополнительное его преимущество заключается во влиянии на таламические центры болевой чувствительности. Амтолметин гуацил унаследовал все положительные свойства толметина, при этом получив дополнительные преимущества. Основное отличие этого препарата от всей группы НПВП – наличие в составе ванилиновой группы, которая имеет высокую аффинность к капсаициновым рецепторам слизистой оболочки желудка, двенадцатиперстной и тонкой кишки. В результате раздражения последних запускается локальная выработка оксида азота, который наравне с физиологическими простагландинами играет значимую роль в системе гастропротекции. Последующее неизбежное снижение выработки физиологических простагландинов в результате действия неселективного НПВП в значимой степени компенсируется данным механизмом, что позволяет заметно уменьшить частоту побочных эффектов со стороны ЖКТ при применении данного препарата. Таким образом, амтолметин гуацил совмещает в себе, казалось бы, несочетаемые свойства: положительные качества неселективного НПВП (хорошее обезболивающее и противовоспалительное действие) и протективный эффект в отношении слизистой оболочки ЖКТ [21]. Клинические исследования, проведенные в различных странах Европы, показали, что по своим основным свойствам амтолметин гуацил не уступает таким препаратам, как диклофенак и индометацин, в то время как частота развития поражения ЖКТ при применении амтолметина гуацила значительно ниже [20–22].
Назначение Найзилата пациенту с сочетанием двух микрокристаллических артритов в течение 6 мес. оказалось эффективным и безопасным как для купирования обострения, так и для длительного приема.
Диагностика и лечение микрокристаллических артритов, несмотря на их широкое распространение, до сих пор вызывают затруднение. На практике невозможно создать оптимальный алгоритм диагностики микрокристаллических артритов, который позволил бы поставить достоверный диагноз у каждого пациента. Однако при использовании современных методов диагностики верификация сходных по клинической картине заболеваний максимально вероятна. Подбор адекватной противовоспалительной и анальгетической терапии при остром, в т. ч. часто рецидивирующем, артрите должен осуществляться индивидуально у каждого пациента с учетом противопоказаний и сопутствующих заболеваний.
Источник
