Гиперурикемия наблюдается при подагре
Термин гиперурикемия означает увеличение значений мочевой кислоты в крови выше нормы.
Пациент считается гиперурикемическим, у которого после 5 дней соответствующей диеты с низким содержанием пуринов и без приема лекарств, влияющих на повышение кислотности, значения в крови превышают:
7 мг / дл, у мужчин;
6,5 мг / дл, у женщин.
Если значения в крови превышают 9 мг / дл, вам необходимо начать лекарственную терапию. Подагра является следствием хронической гиперурикемии.
Гиперурикемия классифицируется как:
- первичная: когда это наследственное заболевание и, следовательно, с генетическими характеристиками;
- вторичная: когда это заболевание является следствием других патологий или вызвано приемом, или злоупотреблением определенных медикаментов.
Гиперурикемия преимущественно влияет на мужской пол в возрастной группе от 30 до 50 лет.
Гиперурикемия: каковы причины и факторы риска
Одной из основных причин гиперурикемии является избыточное введение пуринов или азотистых веществ, которые образуют нашу ДНК. Они могут быть произведены метаболизмом нашего организма или получены из некоторых продуктов питания. Их катаболизм происходит из мочевой кислоты, которая, как правило, в избытке, сохраняется на уровне плазмы.
Другая причина увеличения мочевой кислоты в крови связана с ее уменьшением выведения через почки. Также некоторые патологии могут определять увеличение мочевой кислоты в крови. Вот некоторые примеры:
- некоторые формы рака также обусловлены применением антибластических препаратов;
- химиотерапия;
- псориаз;
- болезнь накопления гликогена типа 1;
- заболевание почек, которое явно уменьшает выведение мочевой кислоты из мочи;
- диета, богатая пуринами. В число продуктов богатых пуринами входят анчоусы, сардины, мидии, скумбрия, колбасы, печень, мясо и дичь;
- злоупотребление алкогольными напитками;
- сахарный диабет.
Симптомы гиперурикемии
Избыток мочевой кислоты в крови вызывает ее осаждение в суставах, а также в соединительных тканях в виде кристаллов. В этом случае мы отождествляем патологию также с подагрой. Кристаллы также могут накапливаться в почках, образуя почечные камни.
Наиболее частые симптомы, с которыми возникает гиперурикемия:
- суставные боли;
- зуд;
- опухшие и красные суставы;
- почечная колика и клиническая картина почечной недостаточности;
- высокое кровяное давление.
Диагностика гиперурикемии
Гиперурикемия часто диагностируется во время контрольных анализов крови или когда пациент испытывает вышеуказанные симптомы.
Полезен во время визита поиск признаков артрита с наличием покраснения, отека и болей в суставе. Приступы гиперурикемии / подагры обычно поражают большой палец ноги.
Лечение гиперурикемии
Медицинское лечение больного с гиперурикемией включает в себя:
- использование противовоспалительных препаратов;
- Колхицин;
- приостановка лекарств, которые могут вызвать или увеличить гиперурикемию, таких как аспирин и производные, кортизон, диуретики;
- использование лекарств, которые могут снизить выработку мочевой кислоты, таких как аллопуринол, или лекарств, способствующих его выведению, таких как пробенецид.
- Пациент должен резко сократить употребление продуктов, богатых пурином, сократить потребление алкоголя и увеличить потребление воды.
Статьи носят информативный характер и не отменяют консультацию специалиста!
Если вы хотите видеть в ленте свежие публикации канала Саквояж знаний — жмите «понравилось» и подписывайтесь на канал!
Источник
Гиперурикемия является одним из важнейших патогенетических механизмов и проявлений подагры. Поэтому ее коррекция считается неотъемлемой составляющей успеха в лечении подагры.
Основная цель антигиперурикемической терапии – достижение сывороточного уровня мочевой кислоты менее 360 мкмоль/л. Это позволяет снизить накопление уратов, размер тофусов и, как следствие, частоту приступов подагры.
Препаратами первой линии по-прежнему остаются ингибиторы ксантиноксидазы. Наиболее широко применяемым препаратом данной группы является аллопуринол. Однако его использование может быть ограничено по ряду причин. Альтернативой может стать фебуксостат. В статье рассмотрены преимущества фебуксостата, представлены данные его эффективности и безопасности.

Таблица 1. Обзор основных положений по ведению больных подагрой

Таблица 2. Основные уратснижающие препараты, применяемые при подагре

Таблица 3. Основные исследования по уратснижающей терапии с применением фебуксостата у пациентов с подагрой
Последние годы отмечается повышенный интерес к изучению подагры. В первую очередь это обусловлено высокой медико-социальной значимостью заболевания. Подагра считается наиболее частой причиной развития артрита [1]. Число больных увеличивается из года в год [2], особенно в развитых странах. Так, согласно эпидемиологическим исследованиям, проведенным в Великобритании [3–5], с 1975 по 1993 г. распространенность подагры возросла с 2,6 до 9,5 случая на 1000 населения.
Подагра – системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия в разных органах и тканях, а также развивающимся в связи с этим воспалением у лиц с гиперурикемией, обусловленной внешнесредовыми и/или генетическими факторами [6, 7]. Мочевая кислота является конечным продуктом пуринового обмена. Она образуется в результате цепочки превращений: гипоксантин – ксантин – мочевая кислота.
Накопление кристаллов мочевой кислоты приводит к клиническому дебюту болезни – острому подагрическому приступу. Это происходит тогда, когда кристаллы уратов осаждаются в синовиальной жидкости.
В синовиальной жидкости кристаллы фагоцитируются нейтрофилами, вследствие чего активируются содержащие NALP3 (криопирин) инфламмасомы [8] и во внеклеточную среду высвобождается интерлейкин 1-бета. В результате развивается воспалительный процесс, для которого характерны сильная боль, покраснение, гипертермия и припухлость [9].
В связи с тем что гиперурикемия – один из важнейших патогенетических механизмов и проявлений подагры, ее коррекция считается неотъемлемой составляющей успеха в лечении подагры [7, 10].
Антигиперурикемическая (уратснижающая) терапия проводится с целью достижения целевого сывороточного уровня мочевой кислоты менее 360 мкмоль/л (для больных тяжелой тофусной подагрой – менее 300 мкмоль/л). Благодаря этому уменьшаются накопление уратов, размер тофусов и, как следствие, сокращается частота приступов подагры [7].
Эффект уратснижающей терапии очевиден в отношении лабораторных параметров, но не в отношении клинических показателей. Последние сложнее поддаются оценке. Согласно результатам одного из последних крупных обзоров, посвященных терапии подагры, уратснижающая терапия уменьшает риск развития острого подагрического артрита с достаточной степенью доказательности только через год от ее начала и не влияет на риск развития приступов подагры в первые шесть месяцев (табл. 1) [11–21]. В значительной степени это объясняется тем, что снижение уровня мочевой кислоты после приступа может происходить самостоятельно, а применение уратснижающих препаратов способно активировать выход кристаллов мочевой кислоты из депо с последующим обострением.
Длительный прием антигиперурикемических препаратов связан с риском развития нежелательных реакций (НР) и, следовательно, дополнительными расходами на лечение. Поэтому при рецидивирующих приступах эксперты Американского колледжа терапевтов [22] рекомендуют назначать уратснижающую терапию с осторожностью.
Тем не менее в большинстве рекомендаций указывается, что уратснижающая терапия относится к важным методам лечения [7, 10, 23]. Таковая является обязательной при упорном рецидивирующем течении заболевания, особенно при тофусной форме, поскольку может эффективно и радикально изменить прогноз даже в самых тяжелых случаях [24].
В настоящее время существует несколько антигиперурикемических препаратов (по данным Государственного реестра лекарственных средств) (табл. 2). Однако на российском фармацевтическом рынке пока не представлены урикозурические препараты, повышающие выведение мочевой кислоты почками, и препараты уриказы (уратоксидазы), катализирующие процесс окисления мочевой кислоты до аллантоина. Несомненно, это ограничивает возможности применения персонифицированного подхода к лечению.
Препаратами первой линии при подагре по-прежнему остаются ингибиторы ксантиноксидазы вследствие высокой эффективности, способности полностью контролировать течение заболевания, улучшать качество жизни пациентов, относительно доступной стоимости [7, 10, 24, 25].
Наиболее широко применяемым препаратом данной группы является аллопуринол. Опыт его использования при подагре насчитывает несколько десятилетий (зарегистрирован в 1966 г. в США) [26].
Однако применение аллопуринола может быть ограничено по ряду причин: низкий процент достижения целевого уровня мочевой кислоты в сыворотке при назначении малых доз, высокий риск неэффективности при клинически значимом уменьшении скорости клубочковой фильтрации, низкая приверженность терапии [24, 27–29]. Приблизительно 5% пациентов не переносят аллопуринол [30]. Кроме того, такая терапия ассоциируется с риском развития редких, тяжелых и потенциально опасных для жизни НР, в частности синдрома гиперчувствительности к аллопуринолу с летальностью до 25% [31]. Особенно высок риск развития тяжелых НР у пациентов с нарушением функции почек [32]. Немаловажную роль в этом играет стартовая доза препарата [33].
В связи со сказанным выше особого внимания заслуживает препарат фебуксостат – cелективный ингибитор ксантиноксидазы (в России зарегистрирован под двумя торговыми марками – Аденурик [34] (компания «Берлин-Хеми/А. Менарини», Германия) и Азурикс [35] (АО «Фармацевтическое предприятие „Оболенское“»)).
Фебуксостат – производное 2-арилтиазола. Это сильный селективный непуриновый ингибитор ксантиноксидазы. Селективное ингибирование ксантиноксидазы (как окисленной, так и восстановленной формы) приводит к снижению концентрации мочевой кислоты в сыворотке крови.
Фебуксостат был произведен японской фармацевтической компанией Teijin в 1996 г. [38], зарегистрирован в Евросоюзе в 2008 г. [39], в США – в 2009 г. [40], в Российской Федерации – в 2016 г. [41].
По фармакодинамическим характеристикам фебуксостат существенно отличается от аллопуринола [36, 37]. Он подавляет две формы ксантиноксидазы, и это действие более стойкое и сильное, в том числе за счет образования высокоаффинных связей. Препарат обладает высокой селективностью – в терапевтических концентрациях не ингибирует другие ферменты, участвующие в метаболизме пуринов или пиримидинов. Речь, в частности, идет о гуаниндезаминазе, гипоксантингуанинфосфорибозилтрансферазе, оротат-фосфорибозилтрансферазе, оротидин-монофосфатдекарбоксилазе или пурин-нуклеозидфосфорилазе.
При подагре препарат назначается перорально в дозе 80 мг/сут, при необходимости она может быть увеличена до 120 мг/сут.
Высокая эффективность фебуксостата доказана в рандомизированных клинических исследованиях (РКИ) и открытых наблюдениях. Результаты четырех больших исследований продемонстрировали его эффективность при подагре – РКИ FACT [16], РКИ APEX [17], открытое исследование EXCEL – продленная фаза исследований FACT и APEX [18], РКИ CONFIRMS [19]. Описание исследований и их результаты представлены в табл. 3. Во всех исследованиях фебуксостат в стандартной дозе 80 мг по эффективности был сопоставим или превосходил аллопуринол в дозе 300 мг. Частота НР и серьезных НР на фоне такой терапии была одинаковой.
Аналогичный результат получен в 2014 г. в РКИ продолжительностью 28 недель. В исследовании сравнивали эффективность, а также безопасность фебуксостата и аллопуринола у пациентов с гиперурикемией и подагрой [42].
Результаты постмаркетинговых исследований подтвердили результаты РКИ. Наблюдение за 374 пожилыми пациентами (старше 65 лет) с гиперурикемией свидетельствовало, что фебуксостат в стандартных дозах снижает уровень мочевой кислоты лучше, чем аллопуринол [43].
Согласно результатам многоцентрового исследования, проведенного в Германии (включало 5592 пациентов с подагрой), лечение фебуксостатом в течение четырех недель способствовало достоверному уменьшению уровня мочевой кислоты. Кроме того, 67% пациентов достигли целевых значений показателя [44]. Препарат хорошо переносился как в дозе 80 мг, так и в дозе 120 мг.
В отечественной литературе описаны случаи успешного лечения фебуксостатом тяжелых пациентов при неэффективности других методов терапии [24].
Специалисты Национального института здравоохранения и клинического совершенствования Великобритании пришли к заключению, что фебуксостат имеет более высокое соотношение «цена/качество» по сравнению с аллопуринолом, поэтому рекомендовали фебуксостат в качестве препарата второй линии уратснижающей терапии [45].
Анализ данных о применении фебуксостата в клинической практике позволил выявить потенциальные проблемы такой терапии. Так, 15 ноября 2017 г. было опубликовано предупреждение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США о небезопасности такой терапии у пациентов с высоким риском развития сердечно-сосудистых событий (в анамнезе инфаркт, инсульт, застойная сердечная недостаточность) [46, 47]. В то же время большинство клинических наблюдений свидетельствуют о благоприятном профиле безопасности фебуксостата. Даже обсуждается возможность применения высоких доз [48].
В заключение необходимо отметить, что фебуксостат, несомненно, эффективен в качестве уратснижающего средства как в краткосрочной, так и в долгосрочной перспективе. По эффективности он превосходит аллопуринол в стандартной дозе. При длительном использовании фебуксостат оказывает влияние на тофусы и частоту обострений подагрического артрита.
При умеренной почечной недостаточности коррекции дозы фебуксостата не требуется. Это обусловливает возможность его применения у значительной части пациентов с подагрой [30].
Источник
- Гиперурикемия и подагрический артрит (подагра)
- Факторы, влияющие на интенсивность гиперурикемии
- Сравнительная характеристика клинических проявлений ОА
- Главное направление в лечении подагры
Микрокристаллические артропатии (или кристалл-индуцированные артриты) – симптомокомплекс, обусловленный отложением различных солей в суставах или околосуставных тканях, а в некоторых случаях, например, при подагре, а также при отсутствии соответствующего лечения и в тканях других органов (Terkeltaub R., 2012) (Fauci A.S., Langford C.A., 2010) (Firestein G.S., 2008). Отложение кристаллов в суставных тканях индуцирует активацию внутреннего (клеточного и гуморального) иммунитета, который в свою очередь приводит к развитию хронического локального асептического воспаления в суставе (Pang L, 2013) (Shen H, 2013), клинически манифестирующего в виде острого или хронического болевого синдрома, припухлостью, скованностью, а при неблагоприятных обстоятельствах к тяжелым деформациям сустава.
Подагра и пирофосфатная артропатия (ПФА) относятся к микрокристаллическим артропатиям и занимают значительное место среди заболеваний суставов (Terkeltaub R., 2012) (Fauci A.S., Langford C.A., 2010) (Firestein G.S., 2008).
Считается, что подагра встречается не менее чем у 4% мужчин среднего возраста, в то время как понятие о частоте ПФА достаточно условно, так как заболевание нередко «маскируется» остеоартрозом, ревматоидным артритом, собственно подагрой и проявляться в виде недифференцированного хронического артрита, что затрудняет ее своевременную диагностику. Тем не менее, показано, что у 7–10% больных старше 60 лет при рентгенологическом исследовании выявляется одно из проявлений ПФА – хондрокальциноз (Ильиных Е.В., 2011).
Решающим для диагностики подагры и ПФА по-прежнему остается выявление (микро)кристаллов моноурата натрия и пирофосфата кальция соответственно в синовиальной жидкости пораженных суставов (Ильиных Е.В., 2011) (Кудаева Ф.М., 2012) (Terkeltaub R., 2012) (Fauci A.S., Langford C.A., 2010) (Firestein G.S., 2008).
Гиперурикемия и подагрический артрит (подагра)
В настоящее время под термином «подагра» принято понимать группу гетерогенных заболеваний (встречающихся только у человека), характеризующихся следующими общими чертами:
- Повышение сывороточной концентрации уратов (гиперурикемия)
- Рекуррентные (рецидивирующие) атаки острого артрита, при котором кристаллы мононатрия урата определяются в лейкоцитах синовиальной жидкости
- Агрегация кристаллов урата натрия с образованием «тофусов», располагающихся, главным образом, в или около суставов, что в конечном итоге приводит к его деформации с потерей функциональности
- Почечные заболевания с вовлечением почечных канальцев, почечных клубочков, а также интерстициальных тканей и кровеносных сосудов
- Уратный нефролитиаз(Fauci A.S., Langford C.A., 2010) (Firestein G.S., 2008).
В целом подагра представляет собой системное тофусное заболевание, характеризующееся отложением кристаллов моноурата натрия в различных тканях и развивающимся в связи с этим воспалением, у лиц с гиперурикемией, обусловленной внешнесредовыми и/или генетическими факторами (Елисеев М.С., 2011).
Частота подагры четко не определена в связи с эпизодическим характером приступов артрита, «доброкачественного» поначалу, легко купирующегося в течение нескольких дней противовоспалительными и обезболивающими средствами. Частота подагрического артрита в различных популяциях колеблется от 5 до 50 на 1000 мужчин и 1-9 на 1000 женщин, а число новых случаев в год — соответственно 1-3 на 1000 мужчин и 0-2 на 1000 женщин. Считается, что не менее 1-4% взрослых мужчин страдают подагрой (Барскова В. Г., 2009). По данным Lawrence R.C. и соавт. (Lawrence R.C., et al., 2008), подагра является наиболее распространенной среди лиц пожилого и старческого возраста — 8% среди лиц в возрасте 70-79 лет, по сравнению с 1,7% пациентов в возрасте после 50 лет.
Особенно это имеет отношение к женщинам в период постменопаузы, Так, подагра встречается у 1% женщин в возрасте 50 лет и 5% – в возрасте 70 лет. Дополнительными факторами, предрасполагающими к развитию подагры у пожилых по мнению авторов являются более частое использование лекарственных препаратов и нарушение функции почек, которые приводят к увеличению содержания уратов в сыворотке крови. Эти же факторы могут усложнять лечение подагры в пожилом и старческом возрасте, увеличивая возможность для нежелательных лекарственных взаимодействий и противопоказаний к терапии. Возраст пациентов, а также социальные и функциональные факторы влияют на выбор медикаментозной терапии (Арьев А.Л., 2012).
Распространенность подагры превышает таковую при ревматоидном артрите. Она является самой частой причиной артритов у мужчин (среднего возраста, 40-50 лет), и в последние десятилетия заболеваемость подагрой непрерывно увеличивается, что может быть обусловлено ростом продолжительности жизни, влиянием таких факторов риска, как прием алкоголя, нарушение диеты, ожирение, артериальная гипертензия, хроническая почечная недостаточность, прием (длительный) диуретиков, низких доз ацетилсалициловой кислоты (например, для профилактики тромбозов), циклоспорина и других цитостатиков. При этом экономические затраты на больных хронической подагрой колоссальные и, например, в США, составляют приблизительно 6% общих затрат на здравоохранение (Елисеев М.С., 2011).
Помимо влияния отдельных заболеваний на риск развития подагры, появляется все больше доказательств того, что гиперурикемия, частота которой в популяции составляет 18%, – не только причина развития подагры и мочекаменной болезни, но и один из факторов риска других заболеваний (Елисеев М.С., 2011).Индекс коморбидности при подагре и гиперурикемии намного превышает таковой при других заболеваниях. По данным зарубежных и отечественных исследований частота метаболического синдрома при подагре оказалась крайне высокой – 82% и 68% соответственно. Вполне закономерно, что рост заболеваемости подагрой происходит параллельно популяционному росту частоты ожирения, артериальной гипертензии и ХПН, наличие которых ассоциируется с повышенным риском развития заболевания.
С другой стороны, подагра и гиперурикемия входят в число факторов, влияющих на риск развития нарушений углеводного обмена. Во многих исследованиях отмечено значимое снижение качества жизни у больных подагрой. Кроме того, при подагре отмечено достоверное увеличение риска развития нарушения мозгового кровообращения и инфаркта миокарда по сравнению с популяцией. Отсутствие адекватной терапии может усугублять риск возникновения таких нарушений. Изучение исходов подагры может способствовать разработке и внедрению рекомендаций по лечению данного заболевания. В настоящее время исходами болезни принято считать выздоровление, ремиссию, переход заболевания в хроническую форму и смерть (Денисов И.С., 2013).
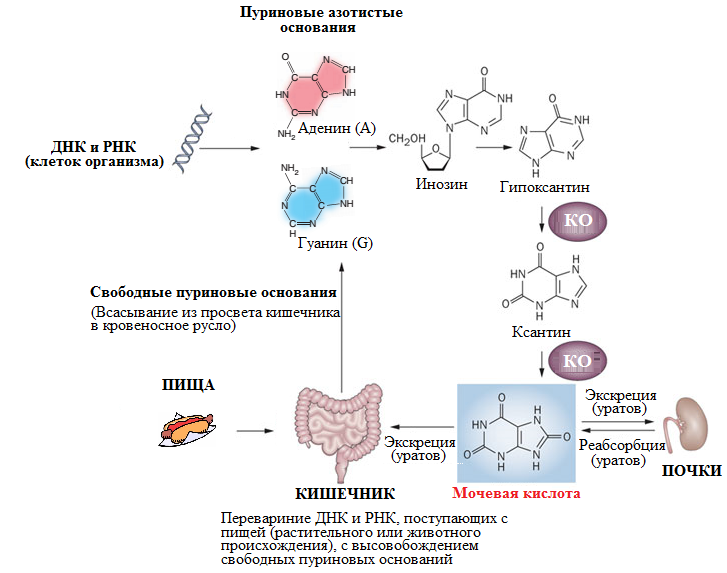
Облигатным фактором риска развития подагры является стойкая гиперурикемия, т.е. повышенный сывороточный уровень мочевой кислоты. Мочевая кислота – конечный продукт обмена пуриновых азотистых оснований (гуанина и аденина), образующийся в результате ферментативного окисления ксантина под действием фермента ксантиноксидазы (Барскова В. Г., 2009) (Рисунок 15).

Рисунок 15. Обмен пуриновых азотистых оснований с образованием мочевой кислоты (уратов) (адаптировано из (RockKL, 2013))
Примечание – КО – ксантиноксидаза.
В организме человека свыше 98% образуемой в ходе метаболизма пуринов мочевой кислоты превращается в мононатриевый урат (Рисунок 16), по концентрации которого и определяется уровень мочевой кислоты. За превышение уровня мочевой кислоты принимается ее концентрация, при которой ураты не растворяются в жидкихсредах организма, например, в синовиальной жидкости. Так, об гиперурикемии следует говорить, в случаях, когда уровень мочевой кислоты (то есть уратов) составляет выше 416 мкмоль/л (7,0 мг/дл)(Барскова В. Г., 2009) (Firestein G.S., 2008).
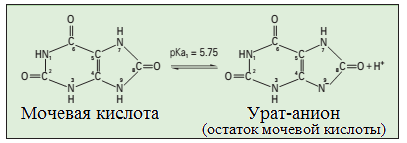
Рисунок 16. Равновесные реакции взаимопревращения мочевой кислоты и урата (натрия) (адаптировано из (RockKL, 2013))
Примечание – при физиологической рН (7,4) соотношение концентраций урата и мочевой кислоты составляет 50:1, то есть в условиях нормы мочевая кислота представлена в жидких средах организма, в том числе в крови и экстраклеточных пространствах преимущественно в растворимой (ионизированной) форме, то есть в виде урата натрия. Это соотношение существенно изменяется в сторону неионизированной формы мочевой кислоты при увеличении концентрации урата в крови (гиперурикемии).
В этом случае происходит пересыщение «раствора» урата. Будучи слабым электролитом (слабо растворимой) мочевая кислота в жидких средах, особенно при понижении рН (воспаление), а также в тканях, где физиологически температура ниже, чем в тканях, локализованных в более глубоких областях организма, начинает выпадать в осадок, в конечном итоге это приводит к агрегации микрокристаллов и формированию тофуса.
‹‹ Предыдущая Следующая ››
Автор материала: Булгакова Яна Сергеевна, кандидат биологических наук, ООО Сайнсфайлз
Также стоит почитать:
Медицинские центры, врачи
Опросы, голосования
Источник
