Ифа при ревматоидном артрите
Для ревматоидного артрита характерны эрозивно-деструктивные изменения в суставах и большой спектр внесуставных проявлений. Клинически он проявляется суставным синдромом: припухлостью, болезненностью, ограничением подвижности, впоследствии — нарушением функции суставов, скованностью в них по утрам.
Какие лабораторные методы применяются при ревматоидном артрите?
Суставной синдром встречается при многих ревматических заболеваниях. Это усложняет диагностику, особенно на ранних стадиях артрита. Поэтому больным часто требуется обширное обследование для того, чтобы установить диагноз. Из лабораторных методов для этого применяются:
- Анализ на ревматоидный фактор.
- Тест на АЦЦП.
- Общий анализ крови.
- Биохимия крови.
- Исследование синовиальной жидкости.
Количественный и качественный анализ на РФ
При ревматоидном артрите синовия вырабатывает измененные иммуноглобулины G. Организм не распознает их и считает чужеродными. Иммунная система в ответ на появление антигенов синтезирует ревматоидные факторы — иммуноглобулины М, А, G. Для диагностики самыми важными из них являются IgM. Они обнаруживаются у 70-85% пациентов.

Существуют разные лабораторные методики для выявления ревматоидного фактора:
- Латексная агглютинация — качественный анализ, с помощью которого определяют отсутствие или наличие РФ (концентрация не указывается). Он недорогой, быстро проводится, но нечувствительный и неспецифичный. Нормальный результат при латекс-тесте — минус (-).
- Нефелометрия, иммунотурбидиметрия — количественные методы определения IgM. Норма — до 15 МЕ/мл. При ревматоидном артрите титры повышаются до 40 МЕ/мл и более. Недостаток этих методов заключается в том, что их результаты бывают ложноположительными у 2-3% здоровых лиц, у пожилых людей эта цифра достигает 15%.
- ИФА — количественный анализ. Он широко распространен, так как признан самым точным и надежным. Кроме IgM методом иммуноферментного анализа можно определить иммуноглобулины А, Е, G. Они составляют до 10% белка, называемого ревмофактором. Концентрация IgG повышается при васкулите, IgA — при тяжелом и быстропрогрессирующем течении болезни. Норма для IgM — меньше 14 МЕ/мл, для IgA — меньше 20 МЕ/мл.
Определение иммуноглобулинов разных классов повышает специфичность исследования. Одновременное выявление IgM и IgA убедительно говорит о наличии ревматоидного артрита.
РФ бывает повышенным у здоровых людей и лиц с другой ревматической патологией (СКВ, синдром Шегрена, слеродермия), хроническими болезнями почек, легких, печени, злокачественными новообразованиями.
Если в крови больных выявляется классический РФ (IgM), то ревматоидный артрит считают серопозитивным, если не выявляется — серонегативным.
Тест на АЦЦП
Цитруллин — заменимая аминокислота. Она образуется в ходе биохимических процессов из незаменимой аминокислоты аргинина. По невыясненной причине при ревматоидном артрите иммунная система вырабатывает к ней антитела — преимущественно иммуноглобулины G.
Тест на антитела к циклическому цитруллинированному пептиду имеет высокую чувствительность (71%) и специфичность (до 99%). При ревматоидном артрите он используется с целями:
- ранней диагностики. Антитела появляются в крови больных, в среднем, за полтора года до возникновения первых симптомов;
- выявления серонегативных форм болезни;
- дифференциальной диагностики с другими ревматическими заболеваниями;
- прогнозирования темпов деструкции суставов (чем выше уровень АЦЦП, тем больше они повреждены).
Для определения антител к ЦЦП применяются стандартные методы:
- ИФА;
- полуколичественный иммунохроматографический экспресс-метод;
- хемилюминисцентный и электрохемилюминисцентный анализ.
Если АЦЦП в крови не обнаруживаются, то результат теста считают отрицательным, если их содержание равняется 3 ЕД/мл и меньше — слабо позитивным, больше 3 ЕД/мл — высоко позитивным.
Общий анализ крови
При артрите в нем появляются маркеры воспаления — повышение СОЭ (больше 10 мм/час у мужчин, 15 — у женщин), лейкоцитоз (более 10 х 10^9/л). Это неспецифические показатели, которые изменяются при любом воспалительном процессе. Но ускорение СОЭ свыше 40 мм/час может говорить об обострении ревматоидного артрита или его прогностически неблагоприятном течении.
При особом варианте болезни — синдроме Фелти — поражается селезенка. В ОАК при этом наблюдается нейтропения (число нейтрофилов меньше 48%) и тромбоцитопения (количество тромбоцитов меньше 180 х 10^9/л).
При ревматоидном артрите существенно возрастает уровень и активность противовоспалительных цитокинов. Они влияют на метаболизм железа, продолжительность жизни эритроцитов, их продукцию костным мозгом. В крови появляется картина анемии. Чаще всего она гипохромная и микроцитарная. Для нее характерны:
- снижение гемоглобина (у женщин ниже 120, мужчин — 130 г/л);
- уменьшение MCV (среднего объема эритроцита) — менее 80 fl;
- уменьшение цветового показателя (меньше 0,85);
- реактивный тромбоцитоз — число тромбоцитов больше 320 х 10^9/л.
Анемию может усугублять применение лекарств. Некоторые базисные препараты при длительном применении оказывают токсическое действие на клетки крови. Так, метотрексат довольно часто вызывает мегалобластную анемию, препараты золота и сульфасалазин — апластическую. Выраженная анемия может быть противопоказанием для проведения плазмафереза при ревматоидном артрите.
Биохимия крови
При обострении артрита в биохимическом анализе повышается уровень:
- фибриногена (> 4 г/л);
- сиаловых кислот (> 2,36 ммоль/л);
- гаптоглобина (> 3,03 г/л);
- церулоплазмина (> 60 мг/дл);
- C-реактивного белка (> 5 мг/л);
- гамма-глобулинов (> 15%);
- компонентов системы комплемента.
Увеличение и снижение этих показателей коррелирует с активностью заболевания и является индикатором эффективности лечения.
Изменения в биохимии появляются при осложнениях ревматоидного артрита. Например, при вторичном амилоидозе нарушается функция почек и в крови увеличивается содержание креатинина, уменьшается скорость клубочковой фильтрации. Одновременно в моче повышается содержание белка.
На биохимические показатели могут влиять используемые для лечения препараты. Повышение печеночных трансфераз (АЛТ, АСТ) может говорить об их гепатотоксичности.
Анализ синовиальной жидкости

В полости сустава находится жидкость (около 2 мл), которая обеспечивает беспрепятственное скольжение суставных поверхностей костей, а также выполняет другие функции: метаболическую, трофическую, барьерную.
В норме синовиальная жидкость вязкая, прозрачная, имеет соломенно-желтую окраску, содержит небольшое количество клеток — до 200/мкл (гистиоцитов, синовиоцитов, лейкоцитов) и общего белка (10-20 г/л).
При ревматоидном артрите в суставе скапливается выпот объемом 3-25 мл и больше. Он мутный, имеет желтый или зеленый цвет, после смешивания с уксусной кислотой образует рыхлый по структуре муциновый сгусток, содержит много клеток — до 30-50 тысяч/1 мкл.
Характерный признак ревматоидного артрита — появление в суставном выпоте рагоцитов. Это особые «ячеистые»клетки, у которых в цитоплазму включены иммунные комплексы.
При биохимическом исследовании в выпоте обнаруживаются С-реактивный белок и
ревматоидный фактор, которых быть не должно, а также повышение общего белка до 60 г/л.
Микроскопический анализ синовиальной жидкости позволяет отдифференцировать инфекционные артриты, при которых в нативных препаратах выявляются хламидии, гонококки, грамположительные кокки, грибки. Наличие в ней кристаллов говорит о подагрической природе воспаления.
Результаты анализов при ревматоидном артрите должны трактоваться в комплексе с данными клиники, инструментальных методов. Их правильная интерпретация важна для ранней диагностики заболевания. По лабораторным показателям судят об эффективности назначенной терапии, оценивают прогноз заболевания.
Источник
[40-133]
Лабораторное обследование при ревматоидном артрите
3230 руб.
Комплексный анализ, используемый для оценки активности и контроля лечения ревматоидного артрита.
Синонимы русские
Анализы крови при ревматоидном артрите (РА).
Синонимы английские
Rheumatoid arthritis (RA) blood panel;
Rheumatoid arthritis laboratory tests;
Rheumatoid arthritis work up.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Ревматоидный артрит – это хроническое аутоиммунное заболевание, течение которого варьируется от незначительно выраженного олигоартрита до стремительной деструкции многих суставов и инвалидизации. Для оценки активности этого заболевания, его прогноза, принятия решения о назначении базисных препаратов и контроля лечения используют несколько клинико-лабораторных маркеров. Особенно удобным для врача и пациента является комплексный анализ крови, включающий все необходимые показатели.
Комплексный анализ крови при ревматоидном артрите состоит из 4 частей: маркеры воспаления, гематологические, биохимические и иммунологические показатели.
Маркеры воспаления – это скорость оседания эритроцитов (СОЭ), С-реативный белок (СРБ) и фибриноген. Высокий уровень СОЭ, СРБ или фибриногена отражает активность заболевания. Кроме того, было показано, что уровень СРБ связан с прогрессирующей деструкцией суставов по данным радиологического исследования. Фибриноген – это не только белок острой фазы воспаления, но и фактор свертывания крови, высокий уровень которого ассоциирован с риском тромбоза и сердечно-сосудистых заболеваний. Подобная ассоциация была показана и для СРБ. Действительно, риск сердечно-сосудистых заболеваний и инсульта у пациентов с ревматоидным артритом повышен.
Гематологические показатели – это общий анализ крови (ОАК) и лейкоцитарная формула. С помощью ОАК удается выявить и оценить степень выраженности анемии при ревматоидном артрите. При этом заболевании чаще всего наблюдается анемия хронических заболеваний, степень выраженности которой отражает активность заболевания. При хорошем ответе на терапию показатели крови нормализуются. Другой нередкой формой анемии является железодефицитная анемия, обусловленная скрытым кровотечением ЖКТ при применении НПВС. Для дифференциальной диагностики двух видов анемий при ревматоидном артрите могут понадобиться исследования уровня железа. Также с помощью ОАК можно выявить тромбоцитоз, который отражает активность заболевания, или тромбоцитопению, которая может возникнуть как осложнение при приеме лекарств или являться симптомом гиперспленизма при синдроме Фелти. При ревматоидном артрите, как правило, наблюдается умеренный лейкоцитоз. Лейкопения может возникать как осложнение при приеме лекарств или, по аналогии с тромбоцитопенией, являться симптомом синдрома Фелти.
К биохимическим показателям, которые исследуют при ревматоидном артрите, относятся печеночные ферменты (АЛТ, АСТ) и общий белок сыворотки крови. Печеночные ферменты исследуют для оценки гепатотоксичности, вероятной при назначении базисных препаратов, и своевременной коррекции их дозы. Повышение уровня печеночных ферментов наблюдается у 10-35 % пациентов, получающих комбинацию метотрексата и лефлуномида. Общий белок сыворотки – это интегральный показатель белкового обмена организма, который часто нарушается при хронических заболеваниях, в том числе при ревматоидном артрите. Следует отметить, что уровень общего белка может быть нормальным даже при тяжелом течении заболевания.
Иммунологические показатели – ревматоидный фактор (РФ) и антитела к циклическому цитруллинсодержащему пептиду (АЦЦП) – используют не только для диагностики, но и для оценки активности и прогноза ревматоидного артрита. РФ – это иммуноглобулины класса IgM к Fc-фрагменту иммуноглобулинов IgG. РФ выявляется у 60-80 % пациентов с ревматоидным артритом, чаще в стадию развернутой клинической картины. Чувствительность этого маркера на ранней стадии ревматоидного артрита составляет около 40 %. Таким образом, отрицательный результат исследования РФ не позволяет полностью исключить ревматоидный артрит. Уровень РФ в некоторой степени меняется с изменением активности заболевания, но может оставаться высоким даже при достижении клинической ремиссии заболевания. Наличие РФ связано с прогрессирующей деструкцией суставов по данным рентгенологического исследования вне зависимости от активности заболевания. РФ не является специфичным для ревматоидного артрита маркером и может быть обнаружен при многих других аутоиммунных заболеваниях, в том числе при системной красной волчанке, анкилозирующем спондилите, ювенильном ревматоидной артрите, саркоидозе, а также определяется у 5-7 % здоровых людей. Более специфичным маркером ревматоидного артрита являются антитела к циклическому цитруллинсодержащему пептиду (АЦЦП), IgG. АЦЦП – это гетерогенная группа аутоантител, взаимодействующих с аминокислотой цитруллином различных белков (возможно, фибрина, виментина, коллагена I и II типа, гистонов и других), образующейся в результате воспалительных изменений в суставе. Специфичность этого маркера достигает 99 %. Также АЦЦП чаще, чем РФ (60 % по сравнению с 40 %), наблюдаются на ранней стадии ревматоидного артрита. Считается, что концентрация АЦЦП может отражать активность заболевания. Обнаружение АЦЦП, подобно РФ, ассоциировано с деструкцией суставов и является неблагоприятным прогностическим фактором.
В некоторых случаях могут понадобиться дополнительные тесты, например анализ кала на скрытую кровь у пациента, принимающего НПВС, или оценка функции почек у пациента, принимающего метотрексат. Следует отметить, что лабораторное обследование – важное, но не единственное обследование при ревматоидном артрите. Результаты комплексного анализа необходимо оценивать с учетом дополнительных анамнестических, клинических и инструментальных данных.
Для чего используется исследование?
- Для оценки активности и контроля лечения ревматоидного артрита.
Когда назначается исследование?
- При наличии симптомов поражения суставов: боли и ограничения подвижности (скованности) в суставах, отек и покраснение кожи в области суставов, особенно при симметричном поражении мелких суставов кистей и стоп;
- при контрольном обследовании пациента с ревматоидным артритом.
Что означают результаты?
Референсные значения
Для каждого показателя, входящего в состав комплекса:
- [02-005] Клинический анализ крови (c лейкоцитарной формулой)
- [02-007] Скорость оседания эритроцитов (СОЭ)
- [06-182] С-реактивный белок, количественно (метод с нормальной чувствительностью)
- [13-020] Ревматоидный фактор
- [13-026] Антитела к цитруллинированному виментину (анти-MCV)
Важные замечания
- Для получения точного результата необходимо следовать рекомендациям по подготовке к тесту;
- результаты исследования оценивают с учетом дополнительных анамнестических, клинических и инструментальных данных.
Также рекомендуется
[40-131] Лабораторная диагностика железодефицита
[02-001] Анализ кала на скрытую кровь
[06-021] Креатинин в сыворотке
[06-034] Мочевина в сыворотке
Кто назначает исследование?
Ревматолог, иммунолог, врач общей практики, хирург.
Источник
ИММУНОЛОГИЧЕСКИЙ ПРОФИЛЬ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ
- Авторы
- Резюме
- Файлы
- Ключевые слова
Пачкунова М.В.
У 80 больных ревматоидным артритом исследовано относительное и абсолютное содержание лимфоцитарных рецепторов CD3+, CD4+, CD8+, CD19+ крови, используя иммуноцитохимический субпопуляционный анализ лимфоцитов и уровень интерферона гамма сыворотки крови методом твердофазного иммунноферментного анализа. Проанализированы взаимосвязи между Т-,В-лимфоцитами и уровнем интерферона гамма крови. Определено состояние лимфоцитарных рецепторов и интерферона гамма крови в зависимости от степени активности ревматоидного артрита.
ревматоидный артрит
CD-рецепторы
интерферон гамма
Ревматоидный артрит (РА) ‒ аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов [5]. Известно, что в основе патогенеза РА лежат выраженные нарушения иммунного ответа, при этом важная роль в развитии и прогрессировании данного заболевания отводится лимфоцитарной и цитокиновой системам. За последние годы достигнут значительный прогресс в изучении патогенеза РА, а также в разработке современных средств диагностики и лечения данного заболевания. Однако изучение состояния молекулярных рецепторов лимфоцитарной системы и взаимосязи их с провоспалительными цитокинами при РА остается актуальной и недостаточно исследованной
проблемой.
Представления о содержании субпопуляций Т-лимфоцитов периферической крови и их значении при РА немногочисленны и противоречивы.
По данным исследователей, у больных РА по сравнению с группой здоровых лиц имеет место Т-лимфопения ‒ снижение относительного содержания CD3+ лимфоцитов [4].
В периферической крови у больных РА ряд авторов не обнаружили значительного изменения содержания CD4+ Т-лимфоцитов [4], другие выявили достоверное увеличение этих клеток [9]. По данным ряда исследователей, в периферической крови больных РА отмечается снижение содержания CD8+ Т-лимфоцитов как следствие нарушения сбалансированности иммунного ответа [3]. По другим данным, у больных РА содержание CD8+ Т-лимфоцитов нормальное или повышено [7]. По данным литературы, у больных РА в периферической крови повышено содержание CD8+ Т-лимфоцитов клеток памяти и понижено содержание соответствующих эффекторных клеток, что связано с ускоренной дифференцировкой Т-клеток памяти с фенотипами CD4+ и CD8+[6].
У больных РА выявлена активация гуморального звена иммунной системы, характеризующаяся увеличением содержания В-лимфоцитов периферической крови, что сопровождается увеличением Ig и ЦИК [4].
РА является системным аутоиммунным заболеванием, при котором преобладающая пусковая роль принадлежит Т-хелперам первого типа.
Важным последствием поляризации иммунного ответа по Th1 типу является нарушение баланса синтеза провоспалительных и противовоспалительных цитокинов.
Интерферон гамма (IFNγ) является важным медиатором как доиммунной защиты, так и развивающегося специфического иммунного ответа. Этот цитокин регулирует адаптивный иммунный ответ, влияя на антигенпрезентирующие фагоциты и антигенраспознающие лимфоциты. IFNγ является главным медиатором клеточного иммунитета, стимулируя поляризацию клеток в направлении Th1. Кроме того, IFNγ способствует дифференцировке Т и В-лимфоцитов, является основным активатором макрофагов, стимулирует синтез антител В-лимфоцитами, увеличивает синтез основных провоспалительных цитокинов ‒ TNF-α, IL-1, IL-6, рекрутирует CD4+ ‒Т-лимфоциты и другие клетки-эффекторы в очаг воспаления [2]. В связи с этим, IFNγ способен усиливать аутоиммунные реакции. Использование современных иммуноферментных методик показало, что концентрация IFNγ достоверно повышена в сыворотке крови и в синовиальной жидкости больных РА [8]. По данным других авторов, у больных РА снижена способность лейкоцитов и лимфоцитов к продукции IFNγ [3]. Рядом исследователей продемонстрирован отчетливый лечебный эффект антител к IFNγ у больных РА [1].
Цель работы
Изучить состояние молекулярных рецепторов иммунной системы: CD3+, CD4+, CD8+, CD19+, иммунорегуляторного индекса ‒ ИРИ (CD4+%/ CD8+%), а также регулятора иммунного воспаления IFNγ у больных РА, оценить взаимосвязи между Т-, В-лимфоцитами и IFNγ. Выявить состояние CD3+, CD4+, CD8+, CD19+, ИРИ, IFNγ в зависимости от активности заболевания.
Материал и методы
Нами обследовано 80 женщин, больных РА, у которых диагноз соответствовал критериям АРА 1987 года. Средний возраст пациенток составил ‒ 51,96±1,36 года, длительность заболевания ‒ в среднем 7,24±0,7 лет.
Первая степень активности воспалительного процесса выявлена у 6,2 % больных, вторая ‒ у 45 % и третья ‒ у 48,8 % пациентов. У 80 % больных была определена серопозитивная форма РА. Рентгенологические изменения I-II степени отмечались у 52,5 % больных, III-IV ‒ у 47,5 %. Системные проявления в виде амиотрофии (67,5), ревматоидных узелков (26,2 %), лихорадки (22,5 %), лимфоаденопатии (21,25 %), гепатоспленомегалии (17,5 %), сетчатого ливедо 10 %), дигитального артериита (6,2 %) были обнаружены у 48,8 % больных. Преобладали больные со II функциональным классом заболевания ‒ 40 % и III ‒ 55 %. Группу сравнения составили 25 здоровых лиц, репрезентативных по возрасту и полу.
Для оценки выраженности суставного синдрома и функциональной способности больного использовались: анамнез; оценка степени выраженности болевого синдрома больным с применением 100 мм визуальной аналоговой шкалы (ВАШ); продолжительность утренней скованности в мин.; число болезненных и припухших суставов (исходя из 68 и из 44 суставов соответственно); суставной индекс Ричи (оценка 53 суставов). Всем больным проводилось лабораторное и инструментальное исследование: общий анализ крови и общий анализ мочи, определение С-реактивного белка (СРБ) (полуколичественный латекс-тест); ревматоидного фактора (РФ) (твердофазный иммуноферментный анализ); рентгенологическое исследование пораженных суставов. Состояние молекулярных рецепторов лимфоцитарной системы CD3+, CD4+, CD8+, CD19+ определяли, используя иммуноцитохимический субпопуляционный анализ лимфоцитов крови. Субпопуляции лимфоцитов периферической крови идентифицировали как в процентном их соотношении, так и в пересчете на абсолютные показатели. IFNγ сыворотки крови определяли методом твердофазного иммунноферментного анализа.
Статистическую обработку материала производили на персональном компьютере с помощью программы Statistica 6,0.Данные представлены в виде средней арифметической величины (M) и стандартной ошибки среднего (m). Для определения статистической значимости различий использовали Т-критерий Стъюдента. Взаимосвязи между переменными вычислялись при помощи коэффициента корреляции Пирсона r. Различия считались достоверными при р <0,05.
Результаты исследования и их обсуждение
В группе больных РА по сравнению с группой контроля определено достоверное снижение относительного содержания CD19+ (22,51±0,53 % и 24,63±1,0 % соответственно, р<0,05) без изменения их абсолютной численности (0,49±0,03*109 /л и 049±0,04*109 /л соответственно, р>0,05), что, вероятно, связано с миграцией В-лимфоцитов из периферической крови в очаг воспаления. В группе больных РА по сравнению с группой здоровых лиц отмечена тенденция к увеличению процентного содержания CD8+ (24,82±0,42 % и 22,04±0,95 % соответственно, р>0,05) и тенденция к снижению ИРИ (1,46±0,03 и 1,54±0,07 соответственно, р>0,05). Вероятно, у больных РА нарушена функция цитотоксических лимфоцитов, неспособных контролировать аутоиммунное воспаление. Не определено изменение относительного содержания CD3+, CD4+, лимфоцитов крови у больных РА по сравнению с группой контроля (р>0,05, рис. 1).
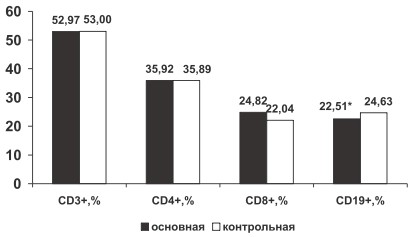
Рис. 1. Изменение относительного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
* ‒ (р<0,05)
У больных РА по сравнению с группой здоровых лиц определена тенденция к росту абсолютного содержания молекулярных рецепторов лимфоцитов крови CD3+, CD4+, CD8+ (р>0,05, рис. 2), что связано с активацией лимфоцитарной системы при хроническом иммуновоспалительном процессе.
Уровень IFNγ в периферической крови больных РА по сравнению с группой контроля был увеличен в 3 раза (249,92±33,84 пг/ мл и 73,89±6,55 пг/мл, р<0,05).
Было исследовано состояние CD3+, CD4+, CD8+, CD19+ и IFNγ крови у больных РА в зависимости от активности воспалительного процесса. Относительное содержание изучаемых молекулярных рецепторов (р>0,05, таблица) при различных степенях активности РА достоверно
не изменялось.
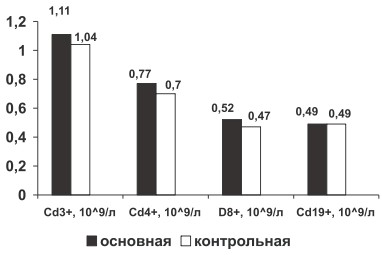
Рис. 2. Изменение абсолютного содержания CD3+, CD4+, CD8+, CD19+ крови у больных РА в основной и контрольной группах
У больных со 2-й степенью активности по сравнению с 1-й, наблюдается тенденция к увеличению абсолютного содержания изучаемых лимфоцитов крови CD3+, CD4+, CD8+, CD19+ и снижению ИРИ (р>0,05, таблица).
Изменение содержания молекулярных рецепторов лимфоцитарной системы крови и цитокинов в зависимости от активности РА (М ±m)
Показатель | 1 группа здоровые n =25 | Степень активности | ||
2 группа 1 степень n =5 | 3 группа 2 степень n= 36 | 4 группа 3 степень n= 39 | ||
1 | 2 | 3 | 4 | 5 |
CD3 +,% | 53,0±0,99 | 55,4±2,58 р(2,1) >0,05 | 52,81±0,8 р(3,1) >0,05 р(3,2) >0,05 | 52,77±0,86 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD4 +,% | 35,89±1,23 | 35,2±1,93 р(2,1) >0,05 | 35,47±0,61 р(3,1) >0,05 р(3,2) >0,05 | 36,42±0,8 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD8 +,% | 23,74±0,95 | 23,6±2,58 р(2,1) >0,05 | 24,84±0,51 р(3,1) >0,05 р(3,2) >0,05 | 24,97±0,66 р(4,1) >0,05 р(4,2) >0,05 р(4,3) >0,05 |
CD19 +,% | 24,63±1,0 | 21,8±2,17 р (2,1) >0,05 | 22,31±0,78 р (3,1) >0,05 р (3,2) >0,05 | 22,77±0,8 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
ИРИ CD4+%/ CD8+% | 1,54±0,07 | 1,55±0,19 р (2,1) >0,05 | 1,44±0,03 р (3,1) >0,05 р (3,2) >0,05 | 1,48±0,05 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD3 +,109/л | 1,04±0,09 | 1,06±0,18 р (2,1) >0,05 | 1,23±0,11 р (3,1) >0,05 р (3,2) >0,05 | 1,02±0,09 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD4 +,109/л | 0,7±0,06 | 0,66±0,1 р (2,1) >0,05 | 0,85±0,08 р (3,1) >0,05 р (3,2) >0,05 | 0,7±0,06 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD8 +, 109/л | 0,47±0,05 | 0,4±0,09 р (2,1) >0,05 | 0,57±0,05 р (3,1) >0,05 р (3,2) >0,05 | 0,49±0,04 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
CD19 +,109/л | 0,49±0,04 | 0,41±0,07 р (2,1) >0,05 | 0,53±0,05 р (3,1) >0,05 р (3,2) >0,05 | 0,46±0,04 р (4,1) >0,05 р (4,2) >0,05 р (4,3) >0,05 |
IFNγ, пг/мл | 73,89±6,55 | 139,33±23,04 р (2,1) <0,05 | 191,58±31,03 р (3,1) <0,05 р (3,2) <0,05 | 319,53±68,46 р (4,1) <0,05 р (4,2) <0,05 р (4,3) <0,05 |
Примечания: р ‒ уровень значимости различия групп с соответствующими номерами, n ‒ количество обследованных
При 3-й степени активности РА по сравнению со 2-й степенью, несмотря на нарастание тяжести заболевания, наблюдается тенденция к снижению CD3+, CD4+, CD8+, CD19+ и нарастанию ИРИ, что, вероятно, свидетельствует о срыве компенсаторных реакций и нарастании иммунодефицита (р>0,05).
При всех степенях активности РА по сравнению с нормой определено достоверное увеличение уровня IFNγ (p <0,05, таблица), что, вероятно, связано с воздействием этого существенного показателя аутоиммунизации на развитие и прогрессирование заболевания. У больных РА по мере повышения степени активности РА выявлено закономерное увеличение содержания IFNγ крови (p<0,05, таблица). Мы считаем, что это связано с нарастанием процессов иммунного воспаления по мере усиления активности РА.
При проведении корреляционного анализа нами обнаружена прямая взаимосвязь между активностью воспаления у больных РА, с одной стороны, и IFNγ, с другой,
(r= 0,27, p<0,05). Не выявлены корреляционные взаимосвязи между активностью воспаления при РА и относительным и абсолютным содержанием изучаемых молекулярных рецепторов (р>0,05). Мы считаем, что динамика клеточных субпопуляций лимфоцитов не отражает напрямую активности иммуновоспалительного процесса.
Был проведен корреляционный анализ между показателями лимфоцитарной и цитокиновой систем при РА. Выявлены прямые корреляционные связи между относительным содержанием CD3+%, с одной стороны, и относительным содержанием CD4+% (r=0,56, p<0,0001), CD8+% (r=0,38, p<0,01), с другой, как и между CD4+%, с одной стороны, и CD8+% (r=0,31, p<0,03) и ИРИ (r=0,37, p<0,01), с другой. Определена обратная сильная корреляция между CD8+%, с одной стороны, и ИРИ (r= -0,75, p<0,001), с другой. Определена умеренная обратная корреляционная связь между ИРИ, с одной стороны, и CD19+% (r= -0,32, p<0,03), с другой, что свидетельствует об увеличении миграции В-лимфоцитов в очаг воспаления при снижении относительного содержания цитотоксических лимфоцитов в периферической крови. Выявлены высокодостоверные прямые корреляционные связи между абсолютным содержанием изучаемых молекулярных рецепторов: CD3+, с одной стороны, и CD4+, CD8+, CD19+ (r=0,9, p<0,0001), с другой, как и между CD4+ с одной стороны, и CD8+, CD19+ (r= 0,9, p<0,0001) с другой, и между CD8+, с одной стороны и CD19+ (r=0,9, p<0,0001), с другой. Таким образом, обнаруженная выраженная зависимость между лимфоцитарными рецепторами свидетельствует об имеющемся взаимном влиянии Т- и В- лимфоцитов. Т-хелперы посредством когнатной помощи и путем выработки IFNγ влияют на дифференцировку В-лимфоцитов в плазматические клетки, антителопродукцию, способствуют созреванию цитотоксических лимфоцитов, активируют макрофаги. В-лимфоциты способны презентировать антигены Т-клеткам, активировать аутореактивные CD4+, CD8+ лимфоциты, продуцировать провоспалительные цитокины. CD8+ лимфоциты осуществляют основной клеточный механизм иммунорегуляции, оказывая ингибирующее влияние на Т-хелперы как путем контактных взаимодействий, так и через выделение гуморальных факторов. Выявлена умеренная прямая корреляционная связь между абсолютным содержанием CD19+с, одной стороны, и IFNγ крови (r= 0,36, p<0,01), с другой, что объясняется усилением дифференцировки В-лимфоцитов, их превращением в плазматические клетки с последующим синтезом антител под действием IFNγ.
Выводы
Таким образом, у больных РА имеет место активация лимфоцитарной системы, сопровождающаяся миграцией В-лимфоцитов из периферической крови в очаг воспаления и нарушением функции цитотоксических лимфоцитов. При 3-й степени активности заболевания по сравнению со 2-й, определена тенденция к снижению абсолютного содержания лимфоцитарных рецепторов, вероятно, вследствие нарастания иммунодефицита. Выявлено взаимное прямое влияние между Т- и В-лимфоцитами у больных РА. Миграция В-лимфоцитов из периферической крови в очаг воспаления увеличивается при снижении относительного содержания CD8+ крови. Увеличение уровня IFNγ крови приводит к увеличению содержания в крови абсолютного содержания В-лимфоцитов.
Достоверное повышение уровня IFNγ в сыворотке крови больных РА по сравнению с контрольной группой является, вероятно, признаком дисрегуляции с избыточными иммунными реакциями и последующим нарушением функции клеток общевоспалительного назначения. Концентрация IFNγ достоверно связана с активностью воспалительного процесса. Определение уровня IFNγ может быть использовано в качестве информативного критерия для определения степени активности РА с последующей перспективой применения антител к IFNγ.
Список литературы
- Лукина Г.В. Перспективы антицитокиновой терапии ревматоидного артрита // Вестник Российской академии медицинских наук. ‒ 2003. ‒ №.7. ‒ С.23-27.
- Насонова В.А., Лукина Г.В., Сигидин Я.А. Нейтрализация ИФ-γ ‒ новое направление в терапии ревматоидного артрита // Терапевтический архив. ‒ 2008. ‒ Т. 80, №. 5. ‒ С. 30-37.
- Олюнин Ю.А., Балабанова Р.М. Комбинированная иммуномодулирующая терапия ревматоидного артрита // Терапевтический архив. ‒ 1996. ‒ Т.68, №5. ‒ С. 13-16.
- Порядин П.В., Казимирский А.Н. Иммунная система и воспаление // Сборник трудов 5-го конгресса «Современные проблемы аллергологии, иммунологии и иммунофармакологии». ‒ Т.1. ‒ М., 2002. ‒ С. 269-280.
- Ревматология, национальное руководство / под ред. Е.Л. Насонова, В.А. Насоновой. ‒ М.: ГЭОТАР-Медиа, 2008. ‒ 714 с.
- Сучков С.В., Хитров А.М., Наумова Т.Е. и др. Современная модель патогенеза ревматоидного артрита и её место в клинической практике // Терапевтический архив. ‒ 2004. ‒ Т. 76, № 12. ‒ С. 83-87.
- Bank I., Coheu L., Monallem M. T cell subsets in patients with arthritis and chronic neutropenia // Ann Rheum Dis. ‒ 2002. ‒ Vol.61, №5. ‒ Р. 438-443.
