Интерферон при лечении ревматоидного артрита
Р.М. Балабанова, О.Н. Егорова
R.M. Balabanova, O.N. Yegorova
Благодаря
достижениям молекулярной биологии
уточняются наши представления о
патогенетических механизмах
ревматических заболеваний (РЗ). При
лечении РЗ используются так
называемые препараты,
воздействующие на болезнь, которые
в той или иной мере влияют и на
иммунные процессы.
Однако
развитие достаточно серьезных
побочных реакций при использовании
этих препаратов ограничивает
возможность их применения при РЗ.
Сейчас
наметилось несколько подходов к
решению этой проблемы: создание
моноклональных антител (МКАТ) к
рецепторам Т-, В-лимфоцитов,
антигенпрезентирующих клеток, МКАТ
к СД18 и СД54, МКАТ к цитокинам; поиск
естественных ингибиторов
цитокинов; использование
цитокинов, в том числе
рекомбинантных интерферонов (ИФН).
К
настоящему моменту получены
обнадеживающие результаты
клинического использования ИФН при
РЗ. Наш опыт применения
рекомбинантных форм a- и g-ИФН
при РЗ согласуется с этими данными.
Advances in molecular biology form a true
notion of the pathogenetic mechanisms of rheumatic diseases (RD).
To treat the latter, the drugs which affect the disease itself,
as well as immune processes in some way or another are used.
However, many serious side effects due to the use of these agents
restrict their application in RD. Nowadays there are several
evident approaches to solving this problem: the advent of
monoclonal antibodies (MAb) to the receptors of T and B
Iymphocytes, antigen-presenting cells, MAb to CD18 and CD54 and
those to cytokines; search for natural cytokine inhibitors, the
use of cytokines, including recombinant interferons (IFN).
The encouraging results of clinical use of IFN in RD have been
obtained to date. The authors’ findings while using the
recombinant forms of a- and g- interferons in RD are in agreement with these data.
В лекарственной терапии
ревматических заболеваний (РЗ) за
последние годы достигнуты
определенные успехи за счет
расширения арсенала лекарственных
препаратов и рационализации схем
терапии, однако данные
относительно роли цитокинов в
процессах иммунного и неиммунного
воспаления диктуют необходимость
поиска новых путей
патогенетической терапии РЗ.
Система
интерферона и цитокинов при РЗ
Несмотря на
очевидное клиническое своеобразие
РЗ, имеются общие закономерности
развития патологического процесса,
в котором ведущая роль отводится
цитокинам иммунных и неиммунных
клеток: Т- и В-лимфоцитов,
нейтрофилов, мононуклеарных
фагоцитов, вызывающих деструкцию
ткани [1]. Повреждение ткани идет либо прямым
путем посредством цитотоксических
реакций, либо косвенным — через
активацию аутореактивных и
воспалительных клеток,
индуцирующих продукцию
воспалительных цитокинов, протеаз
и других компонентов, участвующих в
реакции воспаления [1]. Так, при ревматоидном
артрите (РА) тканевая деструкция
изначально появляется в участке,
где Т-лимфоциты тесно контактируют
с моноцитами и фибробластподобными
синовиальными клетками, что
предполагает прямой контакт
клеток. В то же время
активированные Т-лимфоциты,
получившие сигнал от
антигенпрезентирующих клеток,
начинают секретировать цитокины,
действие которых проявляется как in
situ, так и через систему
микроциркуляции.
Известно более 80 цитокинов, в том
числе интерлейкины (ИЛ), фактор
некроза опухоли (ФНО),
колониестимулирующий фактор,
интерфероны (ИФН) и др.
В поддержании гомеостаза
макроорганизма наряду с иммунной
большая роль отводится системе ИНФ,
которая помимо специфического
(противовирусного) оказывает и
иммуномодулирующее воздействие,
проявляющееся регуляцией
экспрессии генов главной системы
гистосовместимости, модуляцией
клеточной дифференцировки и
созревания, подавлением
пролиферации клеток, а также
влияющее на эндокринную систему [2].
Имеются данные, указывающие на
взаимодействие системы иммунитета
и ИФН. Так, ФНО и g-ИНФ потенцируют
действие друг друга в отношении
стимуляции миграции нейтрофилов и
секреции кислородных радикалов [3]. b-ИЛ-1 и
ФНО индуцируют синтез 26 кД белка,
который является b-ИФН, он же – ИЛ-6 [4].
Предобработка макрофагов a-, b-, g-ИФН
способствует гиперпродукции ИЛ-1
этими клетками, что может объяснить
лихорадочную реакцию организма в
ответ не введение ИФН [5].
Существует прямая и обратная
связь между синтезом ИЛ-2 и g-ИФН, в
то же время g-ИФН индуцирует
секрецию ИЛ-2 активированными
Т-клетками [6]. ИФН способен
ингибировать дифференцировку
В-клеток, в то же время стимулируя
их пролиферативный ответ [2].
Интересны данные о том, что g-ИФН
наряду с ИЛ-4 подавляет
цитокинстимулированную резорбцию
костной ткани, оказывая
кальцитонинподобное ингибиторное
действие на зрелые остеокласты [1].
Исследование особенностей
системы ИФН при РЗ позволило нам
выявить сходные изменения
ИФН-статуса при РА, системной
красной волчанке (СКВ) и болезни
Бехчета (ББ): гипопродукцию
лейкоцитами in vitro a-ИФН у 89% больных РА И
СКВ и у 60% пациентов с ББ, выраженное
угнетение выработки g-ИФН у 96% больных РА и
СКВ и у 80% больных ББ,
гиперпродукцию сывороточного ИФН
при РА и СКВ, тестируемого как a-кислотолабильный
ИФН – a-КЛИ (О.Н.Щегловитова и
А.Н. Кулиева, 1989). Аналогичные
результаты получены Hooks и соавт.
(1979), обнаружившими в сыворотке
больных СКВ, РА и пациентов
синдромом Шегрена повышенный
уровень сывороточного ИФН,
представленного высоким
содержанием a-КЛИ, на фоне
гипопродукции a- и g-ИФН (J. Barnier и соавт., 1984;
Y. Kim и соавт., 1987).
Исследователи расходятся в
оценке способности лейкоцитов к
продукции ИНФ в ответ на
специфическую индукцию.
Так, Т. Stolzenburg и соавт. (1988) при
исследовании сыворотки больных РА,
СКВ, системной склеродермией (ССД),
болезнью Рейтера (БР) и
остеоартрозом (ОА) выявили дефект
продукции g- ИФН у пациентов с СКВ,
РА, ССД, а при БР и ОА уровень
исследуемого ИФН не был изменен.
Другие, напротив, отмечают снижение
продукции a-ИФН у пациентов с СКВ и
РА (A. Renter и соавт., 1989; M. Seitz, 1987).
Вышеизложенное свидетельствует
о том, что в комплексную терапию РЗ
необходимо включать препараты,
способные модулировать иммунный
ответ пациента и восстановить
нормальное функционирование
системы ИНФ.
Препараты
ИНФ в лечении РЗ
Существующие и
широко используемые в клинической
практике медицинские препараты ИФН
делятся по типу активного
компонента на a, b и g, а также по
технологии получения и времени
создания – на природные (ИФН I
поколения) и рекомбинантные (ИФН II
поколения).
Человеческий лейкоцитарный ИФН
(ИФН I поколения) впервые был
использован при СКВ; ряд
исследователей (В.А. Галенок, 1971; О.В.
Синяченко, 1975; З.С. Алекберова и
соавт., 1980) показали положительное
влияние этого препарата на течение
кожного васкулита, люпус-нефрита.
Схема острой фазы воспаления при
ревматическом поражении сустава.
Ранее была предпринята попытка
лечения человеческим
лейкоцитарным ИФН больных РА, что
способствовало уменьшению
длительности утренней скованности,
числа воспалительных суставов и
некоторому снижению активности
процесса по данным лабораторных
исследований (Р.М. Балабанова и
соавт., 1988; M. Peddinani и соавт., 1986).
Однако невозможность полной
технической очистки и связанные с
этим выраженные побочные явления,
опасность ВИЧ-инфекции, а также
дефицит сырья — лейкоцитов
донорской крови ограничивали
применение ИНФ I поколения.
Разработан способ продукции,
выделения и очистки
генно-инженерными методами
различных препаратов ИФН:
a2а-ИФН — реаферон,
виферон, роферон-А;
a2в-ИФН — интрон-А,
инрек, реальдирон;
a2с-ИФН — берофор;
b-ИФН – ферон;
g-ИФН — инфлаген,
полиферон, имукин.
К настоящему времени проведено
большое число открытых,
плацебо-контролированных и
пролонгированных (12 мес) испытаний,
свидетельствующих об
эффективности препаратов ИФН.
Исследователи использовали
различные способы (подкожный,
внутримышечный, ректальный) и схемы
(ежедневно, прерывистыми курсами и
др.) введения, а также разные дозы
препаратов — от 40 000 до 9000000 МЕ.
G. Firestein и соавт. (1987) при
использовании рекомбинантного g-ИФН в
дозе 1 800 000 МЕ/сут у 12 больных РА
наблюдали улучшение лишь у двух. У 6
пациентов имела место выраженная
лихорадочная реакция. Е. Lemmel и
соавт. (1988) предприняли попытку
лечения больных РА рекомбинантным g-ИФН в
сравнительно низких дозах (40 000 МЕ 1
раз в неделю), что позволило
получить положительный эффект у
половины больных и избежать
побочных реакций, однако
выраженного иммунологического
эффекта не отмечалось. В Германии в
1996 г. было проведено многоцентровое
испытание g-ИФН (полиферона) при
подкожном введении 2 000 000 МЕ по 7
инъекций в течение 3 нед, в
последующие 4 нед по 3 инъекции в
неделю (через день) и еще 5 нед по 2
инъекции в неделю. В результате
проведенной терапии отмечено
снижение утренней скованности,
уменьшение числа воспалительных
суставов, снижение
иммунологической активности.
При ювенильном РА a-ИФН (реаферон), который
применяли ректально не более 2 000 000
МЕ/сут в сочетании с
антиоксидантами первые 10 дней
каждые 12 ч, далее 3 раза в неделю
однократно в течение 6 мес,
способствовал уменьшению
системных проявлений,
положительной динамике суставного
и ИНФ-статуса, нормализации
лабораторных показателей (Н.Н.
Кузьмина и М.К. Щербакова, 1991).
В последнее время в литературе
появились сообщения о применении
рекомбинантных форм ИНФ при ББ. Так,
G. Fierlback и соавт. (1989) выявили
обратную корреляцию между
активностью ББ и уровнем
эндогенного ИФН, что дало основание
применять g-ИФН для лечения этого
заболевания; препарат назначали в
дозе 100 мкг подкожно ежедневно в
течение 2 нед 10 больным, затем в той
же дозе раз в неделю. В результате
терапии исчезли афты у 4 из 8
больных, папулезные высыпания или
узловатая эритема у 4 из 7,
полиартралгии у 3 из 4 больных.
Наиболее устойчивыми к лечению
оказались глазные проявления, не
исчезнувшие ни у одного из 4
больных. Vedat Hamuryudan и соавт. (1994) также
использовали для лечения 20
пациентов с ББ a2в-ИФН в дозе 5 000
000 МЕ 3 раза в неделю в течение 6 нед,
затем в той же дозе 1 раз в неделю в
течение 10 нед. Отмечено выраженное
влияние на суставной синдром и
слабое — на течение язвенного
васкулита.
J. Sanchez-Roman и соавт. (1995) применяли a2в-ИФН
у 2 больных с кишечной формой ББ в
дозе 5 000 000 МЕ/день в течение 12 дней,
затем в той же дозе еженедельно. На
фоне лечения нормализовался
абдоминальный симптом, что
подтверждено колоноскопией,
уменьшились или исчезли
генитальные афты.
С середины 80-х годов мы проводим
открытое неконтролированное
лечение больных РА и СКВ
рекомбинантными формами ИФН: g-ИФН
(реафероном, реальдироном) и g-ИФН
(инфлагеном) производства фирмы
“Biofa”, Литва, в комбинации как с
нестероидными
противовoспалительными
препаратами, так и со средствами,
воздействующими на заболевание,
преимущественно с
цитостатическими
иммунодепрессантами и
кортикостероидами (при СКВ),
используя различные схемы и дозы
введения:
- внутримышечное
введение 1 000 000 МЕ a-
или g-ИФН через день 1
мес, в последующие 2 мес — 1 раз в
неделю; - внутримышечно
по 3 000 000 МЕ a- или g-ИФН
по вышеописанной схеме; - 3 000 000 МЕ
внутривенно через день 10
инъекций, а затем в качестве
поддерживающей терапии 1 раз в
неделю внутримышечно; - 3 000 000 МЕ
внутривенно 3 дня подряд (по
типу пульс-терапии) с
интервалом 1 мес. - 3 000 000 МЕ
внутривенно 3 дня подряд, затем
в течение 1 мес та же доза 1 раз в
неделю внутримышечно, курсы
повторяются.
Включение
рекомбинантных форм ИФН в
комплексную терапию РА и СКВ в
первую очередь способствовало
нормализации ИФН-статуса и за счет
этого препятствовало обострению и
развитию хронических
интеркуррентных инфекций. Нами
отмечено уменьшение частоты
побочных реакций, особенно при
использовании цитостатических
иммунодепрессантов.
Эффект проводимой терапии
выразился в уменьшении системных
проявлений и положительной
динамике суставного статуса при РА
и регрессии периферического
васкулита, люпус-нефрита при СКВ.
Оценивая отдаленные результаты
терапии ИФН у больных РА и СКВ, мы
отметили недостаточность
однократного курса лечения этими
препаратами: у 53% больных
возобновились
респираторно-вирусные и другие
инфекции, у 20% развились осложнения
терапии иммунодепрессантами, у 55%
заболевание приняло типичное
течение. У 87,8% больных, получавших
повторные курсы препаратов ИФН (22 с
РА и 12 с СКВ), удалось
стабилизировать активность
процесса.
К настоящему моменту нами
получены обнадеживающие
результаты применения реальдирона
или инфлагена при ББ, ССД и синдроме
Шегрена, однако для окончательной
оценки роли ИФН-терапии при этих
заболеваниях необходимо
дальнейшее накопление
клинического материала.
При введении ИФН, как и при
использовании других
биологических препаратов,
наблюдаются в основном
гриппоподобные побочные реакции.
К настоящему времени еще не
сформировалось единое мнение о
целесообразности использования
ИФН в комплексной терапии РА, что
объясняется малой доступностью
этих препаратов для широкого круга
практикующих ревматологов. Однако
исследования в этом направлении
необходимы, так как становится
возможным использование
селективных иммуномодулирующих
препаратов, биологических
иммуномодуляторов.
Литература:
1. Dayer IM, Burger D.
Rheumat in Europe 1995;12:24-6.
2. Ф.Е. Ершов. Система интерферона
в норме и при патологии. – М.,:
Медицина, 1996;11-120.
3. Old LJ. Science 1985;230:630.
4. Van Damme J., Opdenakker G., Simpson RJ. et al. Exp
Med 1987;165:515-21.
5. Dinarello Ch. A. Horizon in cytokine research. The 3d
Internat. Mochida memor. symp. — Tokyo, 1993;49.
6. Staeheli P, Horisberger MA, Haller O. Virology
1984;132:456-68.
Источник
Ученые из нью-йоркской ортопедической больницы Hospital for Special Surgery в сотрудничестве с ревматологами из Университета Южной Каролины обнаружили, что инерферон-бета может служить биомаркером, с помощью которого врачи могут с высокой точностью определить, кому из страдающих ревматоидным артритом поможет назначение блокаторов фактора некроза опухоли (tumor necrosis factor, TNF) – внеклеточный белок, многофункциональный провоспалительный цитокин, образующийся в основном моноцитами и макрофагами.
Ревматоидный артрит – хроническое аутоиммунное заболевание, при котором иммунная система человека, призванная бороться с инфекционными и вредными агентами, попадающими в организм извне, атакует клетки собственного организма, вызывая воспаление и разрушение соединительной ткани, приводящее к поражению мелких суставов. Заболевание часто приводит к инвалидности в следствии нарушения двигательных функций и постоянных болей.
В развитии ревматоидного артрита фактор некроза опухоли играет заметную негативную роль: он опосредует сильный локализованный иммунный ответ, вызывая воспаление и последующее разрушение соединительной ткани.
Блокаторы фактора некроза опухоли, такие как энбрель (Enbrel), хумира (Humira) и ремикад (Remicade), применяются уже около десяти лет и приносят заметное облегчение больным ревматоидным артритом, однако не всем, а только 50-70%. Одним из побочных эффектов препаратов данной группы является повышенный риск развития инфекционных заболеваний и микозов. Ввиду очень высокой стоимости (лекарства обходятся пациентам в 16000 $ в год), а также их потенциальной токсичности, неоправданное назначение этих препаратов наносит удар по кошельку и здоровью больных.
Ранее было найдено несколько факторов, ассоциированных со слабой эффективностью блокаторов фактора некроза опухоли (активность некоторых генов), однако не один из них не подошел для роли биомаркера.
Группа исследователей под руководством Мэри Кроу (Mary Crow) обратили внимание на интерфероны типа I, в частности, на интерферон-бета, поскольку было известно, что этот подавляющий рост клеток белок обнаруживается в суставах некоторых больных ревматоидным артритом. Интерфероны – белки, вырабатывающиеся в организме человека в ответ на вторжение вирусов и бактерий и обладающие широким спектром биологической активности: противовирусной, иммуностимулирующей и противораковой.
Ученые предположили, что различный уровень активности интерферона-бета в крови может быть связан с эффективностью лечения блокаторами фактора некроза опухоли. Ввиду того, что интерферон-бета стимулирует выработку другого белка, антагониста рецептора интерлейкина-1 (interleukin-1 receptor antagonist, IL-1Ra), исследователи также определяли уровни этого белка в крови больных РА.
Исследование проводилось на трех группах людей: 1) больные ревматоидным артритом, принимающие блокаторы TNF (35 человек), 2) больные, не принимающие никаких лекарств (12 человек) и 3) здоровые волонтеры (50 человек). Ученые определяли активность интерферона-бета и уровень IL-1Ra в крови участников до начала эксперимента и в промежутке от трех до девяти месяцев после окончания лечения, для более точной диагностики состояния испытуемых. Оценку клинического состояния больных проводили с помощью тестирования по Шкале прогрессии заболевания в 28 суставах (the Disease Activity Score/28), традиционно применяемой для определения состояния при ревматоидном артрите, и относили пациентов к одной из трех групп по эффективности лечения: хорошая, средняя и отсутствие реакции.
Оказалось, что у пациентов с высокой активностью интерферона-бета в крови терапия TNF-блокаторами наиболее вероятно будет эффективной. У испытуемых с хорошей реакцией на лечение наблюдались также высокие уровни IL-1Ra в крови по сравнению с пациентами со средней и отсутствующей реакцией.
Несмотря на то, что исследование было проведено на относительно небольшой группе добровольцев, полученные данные достоверны и клинически значимы.
Внедрение интерферона-бета в качестве биомаркера прогноза эффективности назначения TNF-блокаторов станет возможным после проведения более широкомасштабных исследований.
Статья Clio P. Mavragani et al., “Association of the response to tumor necrosis factor antagonists with plasma type I interferon activity and interferon-β/α ratios in rheumatoid arthritis patients: A post hoc analysis of a predominantly Hispanic cohort” опубликована on-line 28 января 2010 в журнале Arthritis & Rheumatism.
Дарья Червякова
Портал «Вечная молодость» https://vechnayamolodost.ru по материалам Hospital for Special Surgery: Biomarker Could Help Doctors Tailor Treatment for Rheumatoid Arthritis
02.02.2010
Источник
Лекарства последнего поколения, разработанные по современным технологиям фармацевтики, облегчают страдания человека, снижают риск дальнейших осложнений. Что же такое ревматоидный артрит, каковы причины, симптомы, какие методы лечения возможны?
Что собой представляет болезнь?
Важно знать! Врачи в шоке: «Эффективное и доступное средство от боли в суставах существует…» Читать далее…
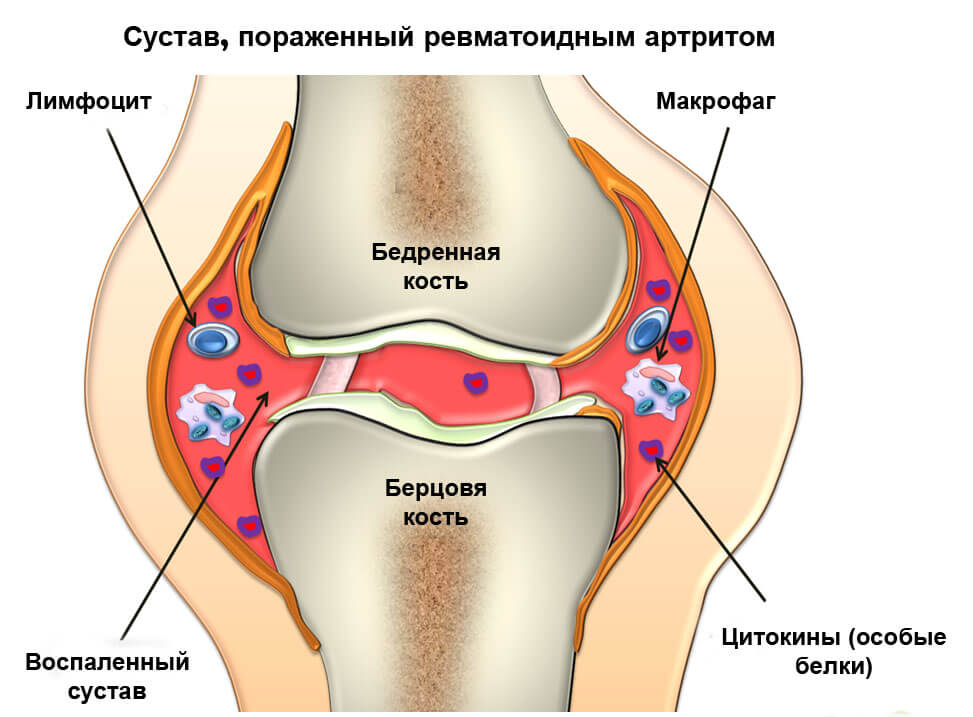
Это системная неврологическая патология, связанная с воспалением хрящевой ткани в суставном сочленении. Причинно-следственные связи клинического состояния различны. Однако все они обусловлены проблемами в работе защитной иммунной организации человека. Наиболее вероятный провоцирующий фактор – инфекционное поражение.

Реакция на воспалительный процесс инфицирования – это медленное разрушение соединительных тканей, связанное с их дегенеративно-дистрофической реорганизацией.
Если вовремя не провести адекватное лечение, то следующим этапом дегенерации станет деформация суставной поверхности. Это влечет значительное ограничение подвижности костно-суставных сегментов ОДА нижней конечности.
Возможные причины возникновения неврологической патологии:
- генетическая зависимость;
- воздействие хронических заболеваний на суставные сегменты;
- действие пусковых факторов: переохлаждение, интоксикация, реакция костно-суставной системы на мутагенные лекарственные средства.
При ревматоидном артрите симптомы заболевания без медикаментозной терапии могут сохраняться длительное время и выражаться в следующих проявлениях:
- боли в суставах различной степени интенсивности, даже при незначительных нагрузках;
- присутствие отечности, покраснения в месте поражения;
- нарушение температурного режима, как результат воспалительной реакции в соединительной ткани.
Такие симптоматические признаки возможны при любых воспалительных реакциях. Поэтому перед тем как проводить лечение ревматоидного артрита, необходимо идентифицировать диагностические признаки заболевания.

Запущенное состояние колена.
Человеку необходимо обратиться к врачу, который на основе собранного анамнеза, диагностического лабораторного исследования (УЗИ, рентген, МРТ, КТ), других уточняющих процедур диагностики определит степень выраженности неврологической патологии. Он установит причинно-следственную связь воспалительной реакции, назначит медикаментозное лечение.
При лечении обязательна двигательная активность суставных сегментов. С этой целью консультирующий специалист назначает физиотерапевтические процедуры, лечебный массаж, гимнастические упражнения, мануальные методы воздействия на суставную патологию.
Подробное видео о природе заболевания:
Системная медикаментозная терапия
Лечебная терапевтическая реакция предусматривает применение пяти групп фармакологических лекарственных средств.
| № п/п | Фармакологические комбинации | Назначение лекарственных средств |
| 1 | Нестероидные противовоспалительные (НПВП) | Устранение симптомов |
| 2 | Базисные противоревматические группы | Уменьшение воспалительной активности, смягчение костно-суставной деструкции |
| 3 | Глюкокортикостероиды | Нормализация обменных функций, восстановление активного кровообращения |
| 4 | Биологические средства лечения | Устранение ферментативного разрушения близлежащих тканевых соединений суставной поверхности |
| 5 | Миорелаксанты | Для расслабления скелетной мускулатуры при значительном снижении двигательной активности |
Нестероидные противовоспалительные
При обезболивании и устранении воспалительной реакции врачи назначают наиболее известные препараты нестероидной противовоспалительной активности – Диклофенак®, Ибупрофен® или Парацетамол®.
Однако существуют более действенные средства лечения из нестероидной противовоспалительной группы с наименьшим эффектом побочного воздействия, связанным с органами мочеполовой, желудочно-кишечной систем.
Среди нестероидных противовоспалительных комбинаций выделяется Дексалгин® 25 немецкого производителя – компании BERLIN-CHEMIE/MENARINI PHARMA GmbH. Выпускается в виде таблеток с активным действующим веществом декскетопрофеном, отпускаемый в аптечной сети только по рецептурному назначению врача. Благодаря активному компоненту и вспомогательным веществам (кукурузный крахмал, микрокристаллическая целлюлоза и т. д.) нестероидная лекарственная форма оказывает анальгезирующее, противовоспалительное и жаропонижающее действие.
После приема фармацевтического средства основные симптомы ревматоидного артрита — боль, отечность, покраснение – исчезают через 30-40 минут. Однако длительность обезболивания составляет 4-5 часов – и наступает новый виток болевых приступов. Дозировка и курс лечения определяется лечащим специалистом с учетом возрастных, половых, индивидуальных особенностей пациента.
Препарат не назначается беременным женщинам, детям до 12 лет, больным людям с хроническими дыхательными патологиями, почечной и печеночной недостаточностью. Лекарство не предназначено для длительного применения. Курс лечения не должен превышать 5-7 дней.
«Врачи скрывают правду!»
Даже «запущенные» проблемы с суставами можно вылечить дома! Просто не забывайте раз в день мазать этим…
>
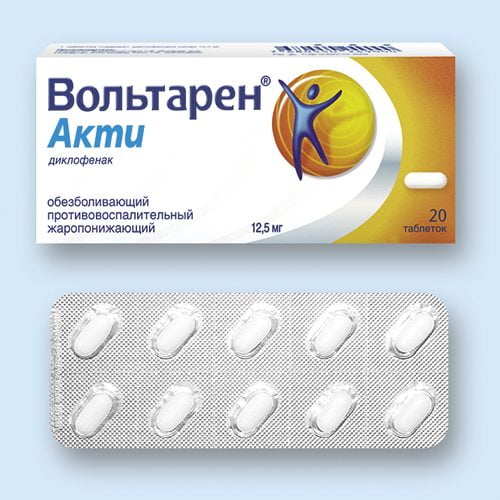
Следующий нестероидный противовоспалительный препарат нового (последнего) поколения – это Вольтарен® акти российского производителя АО «ГлаксоСмитКляйн Хелскер». Лекарство выпускается в виде таблеток белого цвета. Основное действующее вещество – диклофенак натрия.
Вольтарен® акти обладает всеми свойствами фармакологических средств нестероидной противовоспалительной активности – жаропонижающим, болеутоляющим. Лечебный эффект наступает после 15-20 минут, что делает эффективным применение препарата для скорейшего купирования болевого приступа и урегулирования температурного режима. Курс лечения лекарственным средством не должен превышать 5 дней. Противопоказания: язвенная болезнь желудка, дети до 14 лет, почечная, печеночная или сердечная недостаточность. Принимать его не рекомендуют людям с хронической патологией органов дыхания.
Среди новинок фармацевтической промышленности для наружного применения – противовоспалительный анальгезирующий крем Аэртал® испанской фирмы «ALMIRALL S.A.».
Благодаря активному действующему веществу – ацеклофенаку — применение лекарственной формы целесообразно при воспалении в суставе, других костно-мышечных, суставных сегментах опорно-двигательного аппарата.
Исключения – заболевания кожного покрова в месте предполагаемого проведения терапевтических действий, индивидуальная непереносимость фармакологического продукта.
Базисные противоревматические препараты
Среди интересных модифицирующих антиревматических продуктов фармацевтического рынка:
- Азатиоприн® – рецептурный препарат российского производителя ОАО «МОСХИМФАРМПРЕПАРАТЫ им. Н.А.Семашко», выпускаемый в таблетированной форме. Иммунодепрессант блокирует клеточное деление, пролиферацию (разрастание) поврежденных тканей в полости сустава. Лекарственная форма практически не имеет побочных действий и противопоказаний. Единственное ограничение – это индивидуальная непереносимость пациентом действующего вещества и беременность;
- Сульфасалазин® – лекарственный препарат компании «KRKA d. d.» (Словения), обладает свойствами базисной противоревматической терапии. Это основное средство лечения ревматоидного, ювенильного артритов. Среди ограничений – функциональное нарушение печени и/или почек, болезни крови, повышенная чувствительность к сульфаниламиду и производным салициловой кислоты, детский возраст до 7 лет;
- Доксициклин® – полусинтетический антибиотик от ЗАО «БИНЕРГИЯ» (Россия), обладающий антибактериальным действием. Проникая в организм при помощи внутримышечного введения, лекарство действует разрушающе на синтез протеинов в микробной клетке. Противопоказания: аллергическая реакция на тетрациклиновую группу, дети до 10 лет, беременные, кормящие женщины.
Как и чем лечить болезнь, решает лечащий врач. Данная группа лекарственных препаратов обладает очень медленным терапевтическим эффектом. Рекомендуется применять базисные средства лечения совместно с прочими фармакологическими группами – нестероидными противовоспалительными препаратами, глюкокортикостероидами.
Глюкокортикостероиды
Этот вид фармакологических препаратов представляет собой стероидный гормон, синтезируемый корой надпочечников, обладающий разносторонним физиологическим действием:
- противовоспалительным;
- антиаллергическим;
- иммунорегулирующим;
- антишоковым;
- противострессовым.
Среди назначаемых фармакологических средств последнего поколения наиболее эффективны:
Являясь мощнейшим контринсулярным гормоном, глюкокортикостероиды практически не назначаются пациентам с сахарным диабетом.
Биологические средства лечения
При ревматоидном артрите происходит ферментация синовиальной оболочки в суставной полости, которая приводит к разрушению дисульфидных связок в близлежащих костно-суставных тканях и хрящах. Это влечет каскадную реакцию, усугубляет клиническую симптоматику неврологического заболевания. Организм отвечает воспалительной реакцией, сопровождающейся выработкой цитокинов, наиболее опасен ФНО – фактор некроза опухоли. Такое состояние может обеспечить пациенту значительное снижение подвижной активности суставов и физическую нетрудоспособность.
Поэтому в комплексное лечение вводятся специальные блокаторы (ингибиторы ФНО) или антицитоновые препараты:
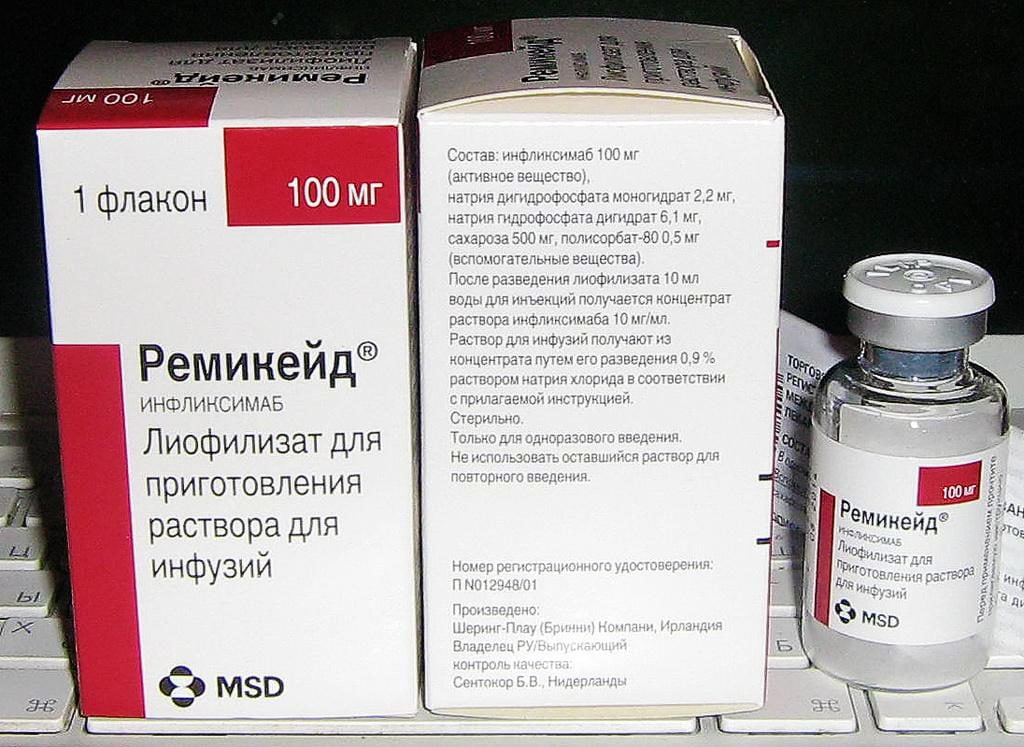
- Ремикейд® российского производителя ООО «МСД ФАРМАСЬЮТИКАЛС» – противоопухолевый ингибитор ФНО, обеспечивающий широкий спектр биологической активности против воспалительной реакции, участвующий в модуляции иммунной системы. Терапия инфликсимабом – основным действующим компонентом лекарственного средства – обеспечивает снижение клеточной инфильтрации в воспаленных участках сустава. Он назначается при активной форме ревматоидного артрита. Частота и длительность лечения устанавливаются по индивидуальной схеме терапевтического лечения. Противопоказания: индивидуальная непереносимость, беременность и кормление грудью у женщин, дети до 18 лет, тяжелые инфекционные поражения;

- Энбрел® – раствор для инъекций компании «WYETH WHITEHALL EXPORT GmbH» (Австрия). Лекарственное средство назначается при умеренной или тяжелой форме ревматоидного артрита, идиопатическом полиартрите у детей, прогрессирующем псориатическом артрите у взрослых, прочих повреждениях суставной массы неврологического характера. Противопоказания: тяжелые инфекции активной формы, беременность и грудное вскармливание, повышенная чувствительность к действующему компоненту – этанерцепту;

- Симзия® – рецептурная лекарственная форма бельгийского производителя компании «UCB Pharma S.A.». Основной действующий компонент раствора для подкожного введения – цертолизумаб пэгол (Certolizumab pegol). Средство является основным ингибитором фактора некроза опухоли (ФНО), широко применяется при ревматоидном артрите суставов нижних или верхних конечностей, псориатическом артрите, аксинальном спондилоартрите. Противопоказания: пожилые пациенты от 65 лет и старше, беременные женщины, дети до 16 лет.
Миорелаксанты
Медицинский термин происходит от латинского myorelaxantia, где myo – это мускул, relaxantis – расслабляющий. Цель их назначения – это снижение мышечного тонуса в зоне неврологического повреждения. Классифицируется лекарственная форма следующим образом (смотреть таблицу).
| Деполяризующие миорелаксанты | Не деполяризующие миорелаксанты | ||
| Ультракороткого действия | Короткого действия | Среднего действия | Длительного действия |
| Дитилин® – деполяризующий миорелаксант короткого действия | Мивакрон® – для кратковременного угнетения нервно-мышечной передачи | Тракриум® – лекарственная форма периферического действия конкурентного типа. Основной компонент – атрикурия безилат снижает чувствительность холинорецепторов, обеспечивая невозможность возбуждения и сокращения мышечного волокна | Павулон® – недеполяризующий миорелаксант продолжительной активности, обеспечивающий релаксацию скелетной мускулатуры |
Доклад на тему медикаментозного лечения:
Прогноз
Обязательным условием для скорейшего выздоровления является не только применение медикаментозных фармацевтических комбинаций. В комплексную терапию необходимо включать физиотерапевтические процедуры, специальные упражнения, лечебный массаж, санаторно-курортное оздоровление.
В случае неэффективности перечисленных методов терапии или при прогрессировании болевой симптоматики в костно-суставном сегменте предусмотрено хирургическое вмешательство:
- артродез;
- синовэктомия;
- эндопротезирование.
Медицинские эксперты отмечают, что продолжительность жизни пациентов с ревматоидной патологией сокращает жизнь человека в среднем на 5-10 лет.
По лабораторным исследованиям американской Клиники Мэйо (США, Миннесота), проведенным в 2005 году, риск сердечно-сосудистых патологий в 2 раза выше у пациентов, страдающих ревматическими и артрологическими заболеваниями. Эта неутешительная статистика в наибольшей степени объясняется хронической стадией ревматоидного артрита опорно-двигательной системы.
Уменьшить риск хронических патологий и увеличить продолжительность жизни поможет назначение биофармацевтических средств лечения. Они активно воздействуют на жизненно важные биологические объекты – кровь, клеточную структуру и соединительные ткани.
Берегите себя и будьте здоровы!
Похожие статьи
Как забыть о болях в суставах?
- Боли в суставах ограничивают Ваши движения и полноценную жизнь…
- Вас беспокоит дискомфорт, хруст и систематические боли…
- Возможно, Вы перепробовали кучу лекарств, кремов и мазей…
- Но судя по тому, что Вы читаете эти строки — не сильно они Вам помогли…
Но ортопед Валентин Дикуль утверждает, что действительно эффективное средство от боли в суставах существует! Читать далее >>>
загрузка…
Источник
