Изменения в моче при артрите
Жигалов С.А., Марасаев В.В.
Введение. Ревматоидный артрит (РА) хроническое системное заболевание соединительной ткани с поражением суставов по типу симметричного эрозивно-деструктивного полиартрита и многочисленными внесуставными проявлениями. Распространенность РА составляет около 0,7%. Ежегодная заболеваемость — приблизительно 0,02% населения. По данным разных авторов поражение почек при РА встречается с различной частотой от 35 до 73% [1,2]. Течение ревматоидной нефропатии носит прогрессирующий характер с развитием нефросклероза и снижением количества функционирующих нефронов, формированием хронической почечной недостаточности.
Развитие системных проявлений предопределяет тяжесть и неблагоприятный прогноз заболевания. Наличие любой стадии хронической болезни почек (ХБП) является независимым фактором риска кардиоваскулярных осложнений [3,4], предопределяющие преждевременную летальность при РА [5,6].
Развитие нефропатий при РА имеет многофакторный характер, что рождает многообразие их клинических и морфологических вариантов при незначительных и неспецифических изменениях в анализах мочи. РА предполагает развитие лекарственной нефропатии, АА-амилоидоза, гломерулонефрита [7].
Последние, как правило, имеют длительное малосимптомное течение, и проявляются в виде незначительных и неспецифических изменений в анализах мочи и зачастую не имеют должной и своевременной интерпретации. Мочевой синдром это клинико-лабораторное понятие, которое включает в себя протеинурию, гематурию (эритроцитурию), лейкоцитурию. Он является важнейшим и наиболее постоянным признаком поражений почек. Наличие мочевого синдрома в рамках современного представления о ХБП служит маркером почечного повреждения и одним из ее критериев. Таким образом, выявление повреждения почек на ранних этапах позволило бы своевременно проводить коррекцию терапии, тем самым влиять на прогноз.
В имеющейся литературе, исследования, касающиеся данной проблемы, немногочисленны и их данные часто противоречивы, что позволяет говорить об актуальности исследования.
Цель исследования — изучить распространенность мочевого синдрома (МС) и его структуру в когорте пациентов с ревматоидным артритом.
Материалы и методы. Проведен анализ встречаемости мочевого синдрома 248 больных РА, проходивших лечение в ревматологическом отделении ГБУЗ Ярославской области «Областная клиническая больница» в 2010 году. В исследование были включены все потупившие больные РА. Оценивались течение основного заболевания и сопутствующая патология. Диагноз достоверного РА ставили на основании критериев американской ревматологической ассоциации (АРА) [8]. Исследовали клинический анализ крови, мочи (по показаниям проводилась проба мочи по Нечипоренко, суточная протеинурия), ультразвуковое исследование почек. Функция почек оценивалась по показателям скорости клубочковой фильтрации (СКФ), которые рассчитывали по формуле MDRD, уровню мочевины и креатинина крови. Иммунологическое исследование включало определение С-реактивного белка (СРБ), ревматоидного фактора (РФ), циркулирующих иммунных комплексов (ЦИК). Стадия заболевания определялась по Steinbrocker. Для оценки активности использовался индекс DAS 28: 0 (ремиссия) — DAS 28 меньше 2,6; 1 (низкая) — DAS 28 от 2,6 до 3,2; 2 (средняя) — DAS 28 от 3,2 до 5,1; 3 (высокая) — DAS 28 больше 5,1.
Анализировали течение основного заболевания и сопутствующую патологию. Больные РА были разделены на две группы. Первую составили больные РА без клинически значимой сопутствующей патологии (n=124). Вторую — пациенты с РА имевшие: сердечно-сосудистые заболевания (артериальная гипертензия, ишемическая болезнь сердца, атеросклероз периферических сосудов), n=106, различные заболевания почек (хронический пиелонефрит, мочекаменная болезнь, аномалии развития почек), n=12, и сахарный диабет, n=6. Всего 124 пациента. Группу контроля составили 102 человека репрезентативных по возрасту и не имеющих заболеваний, потенциально влияющих на функциональное состояние почек. Критерием диагностики МС были: протеинурия более 0,3 г/л, эритроцитурия ≥2-х эритроцитов в поле зрения, лейкоцитурия ≥2 в поле зрения у мужчин, и ≥5 в поле зрения у женщин.
Статистический анализ полученных данных проводился с помощью программы ISTICA версия 6.0. Анализ соответствия вида распределения признака закону нормального распределения проводился с использованием критериев Колмогорова-Смирнова и Шапиро-Уилка. Для описания нормально распределенных количественных признаков было использовано среднее значение признака и среднее квадратичное отклонение. Для описания признаков, распределение которых отличалось от нормального указаны медиана, нижний и верхний квартили. Для сравнения 2-х групп использовался непараметрический метод Манна-Уитни.
Сравнение 2-х групп по качественному признаку проводилось с использованием критерия Χ2 по методу Пирсона с поправкой Йетса, точного критерия Фишера. Ассоциации качественных признаков проверялись с помощью метода Χ2 по методу Пирсона. Различия и взаимосвязи между признаками считали достоверными при p<0,05.
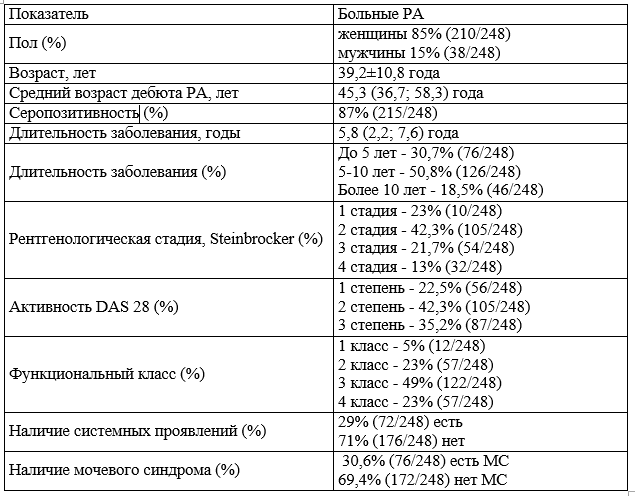
Результаты. Характеристика пациентов основной группы представлена в табл. 1. Средний возраст пациентов 39,2±10,8 года. Подавляющее большинство составили женщины 85% (210/248).
Большинство пациентов получали терапию метотрексатом (МТ): 91% (225/248) человек. Остальные 9% (23/248) человека на момент госпитализации не получали базисную терапию. Глюкокортикостероиды (ГКС) принимали 38% (94/248) человека. В постоянном приеме нестероидных противовоспалительных препаратах (НПВП) нуждались 90% (223/248) пациента. Из них неселективные НПВП принимали 66% (147/223) человек, селективные — 34% (76/223) человек. Не получали НПВП — 10% (25/248) человек.
В качестве системных проявлений были зарегистрированы: ревматоидные узелки, сетчатое леведо, сенсомоторная полинейропатия, анемия, генерализованная амиотрофия.
Таблица 1. Характеристика больных ревматоидным артритом
Структура МС в первой группе больных РА имела следующий вид: протеинурия (П) — 0,8% (1/124), эритроцитурия (Э) — 16% (20/124), лейкоцитурия (Л) — 2,1% (3/124), одновременное появление протеинурии и эритроцитурии (П+Э) — 0,8% (1/124), протениурии и лейкоцитурии (П+Л) — 0% (0/124), лейкоцитурии и эритроцитурии (Л+Э) — 9% (11/124), протеинурии, эритроцитурии и лейкоцитурии (П+Э+Л) — 0,8% (1/124) (рис. 1).
МС во второй группе был представлен следующим образом: П — 2,5% (3/124), Э — 20% (25/124), Л — 3,3% (4/124), П+Э — 0% (0/124), П+Л — 1,6% (2/124), Л+Э — 2,5% (3/124), П+Э+Л — 1,6% (2/124) (рис. 2).
Рис. 1. Структура мочевого синдрома в 1-й группе
Рис. 2. Структура мочевого синдрома во 2-й группе
Патология общего анализа мочи в группе контроля была представлена П — 0% (0/106), Э — 2,8% (3/106), Л — 1,9% (2/106), П+Э — 0% (0/106) П+Л — 0% (0/106), Л+Э — 0,9% (1/106), П+Э+Л — 0% (0/106) (рис. 3).
Рис. 3. Структура мочевого синдрома в группе контроля
Таким образом, мочевой сидром в группе больных с ревматоидным артритом без сопутствующей патологии был определен у 29,8% (37/124), в группе ревматоидного артрита с сопутствующей патологией у 31,4% (39/124) и группе контроля у 5,6% (6/106).
При сравнении полученных относительных частот было показано, что встречаемость мочевого синдрома не имела статистического различия в первой и во второй группах больных РА, (р=0,6), но достоверно отличалась в сравнении с группой контроля (р=0,001).
При сравнении критерием Χ2 по методу Пирсона достоверного различия в структуре первой и второй групп выявлено не было р=0,5.
Таким образом, можно предполагать, что именно наличие РА является фактором, провоцирующим появление мочевого синдрома. Влияния сопутствующей патологии на частоту встречаемости и структуру мочевого синдрома у больных с РА выявлено не было.
Хочется отметить, что в структуре мочевого синдрома превалировала эритроцитурия, как самостоятельно, так и в сочетании с другими показателями.
Для выявления факторов ассоциированных с МС был проведен анализ группы больных с РА без сопутствующей патологии.
При сравнении групп пациентов имеющих МС и без МС было отмечено, что группы достоверно отличались по основным иммунологическим показателям (уровням РФ, ЦИК, СРБ) (табл. 2).
Таблица 2. Иммунологические показатели у больных РА в группе больных без сопутствующей патологии
При изучении встречаемости повышения иммунологических показателей выявлено, что превышение верхней границы референсных значений для ЦИК в группе больных с МС статистически выше, чем в группе без МС 72% (26/36) и 43% (38/88) соответственно, р=0,003. Повышение уровня РФ в группе с МС было достоверно выше, чем в группе без него 95,8% (34/36) и 63% (55/88), р=0,0003. Повышение уровня СРБ в группе с МС составило 90% (32/36) против 64% (56/88) в группе без него, р=0,005. Таким образом, видна отчетливая связь между наличием мочевого синдрома и иммунологическими показателями, отражающими активность основного заболевания.
При изучении влияния активности заболевания на мочевой синдром показано, что встречаемость третьей степени активности в группе больных с МС была достоверно выше, чем в группе без МС (табл. 3).
Таблица 3. Активность РА у больных в группе больных без сопутствующей патологии

При изучении частоты развития системных проявлений сравниваемых групп отмечено, что в группе больных РА имеющих МС системные проявления регистрировались в 42% (15/36) против 23% (20/88) в группе без МС, р=0,03. Не отмечено статистического различия между средними величинами таких показателей как возраст больных 48,8±14, 47,0±11 соответственно, (р=0,55), длительность болезни 4,5 (2,1; 10,5) и 7,2 (2,3; 15,0) соответственно, р=0,2 и дебютом заболевания 46,1 (31,0; 51,2) и 38,5 (27,7; 48,6) соответственно, р=0,25.
При построении таблиц сопряженности и анализе с помощью критерия Χ2 по методу Пирсона выявлено, что МС не ассоциировался со стадией заболевания (р=0,11), ранним дебютом заболевания (до 35 лет), (р=0,12), приемом метотрексата (р=0,3), нестероидных противовоспалительных средств (НПВС) (р=0,23), глюкокортикоидов (р=0,6), селективностью НПВС (р=0,19).
Анализ функционального состояния почек у больных с РА выявил следующее: СКФ более 90 мл/мин/1,73м2 зарегистрирована у 52% (131/248) пациентов, СКФ в диапазоне от 60 до 89 мл/мин/1,73м2 была у 38,4% (95/248) (что соответствует 2 ст. ХБП), у 8,8% (22/248) — менее 60 мл/мин/1,73м2 (что соответствует 3 ст. ХБП).
При этом частота встречаемости нарушений СКФ была ассоциирована с наличием сопутствующей патологии, влияющей на функциональное состояние почек (p<0,001). В то же время, частота встречаемости различной СКФ существенно не зависела от рентгенологической стадии и функционального класса. При сравнении относительных частот было выявлено, что среди больных с сопутствующей патологией снижение СКФ менее 60 мл/мин/1,73м2 регистрировалось статистически чаще, чем среди пациентов без заболеваний сердечно-сосудистой системы и почек 13% (16/124) и 4,8% (6/124) соответственно, p<0,02.
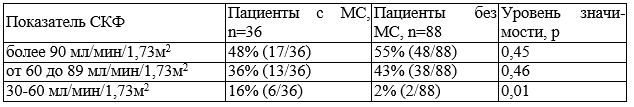
Для выявления взаимосвязи мочевого синдрома и снижения СКФ была проанализирована группа больных РА не имеющих сопутствующих заболеваний (n=124). Показано, что в группе с наличием МС встречаемость СКФ менее 60 мл/мин/1,73м2 статистически превышает такой показатель в группе без МС (табл. 4).
Таблица 4. СКФ у больных РА в зависимости от наличия мочевого синдрома
Обсуждение. При анализе полученных данных было показано, что распространенность мочевого синдрома среди больных РА достаточно велика и составляет около трети всех пациентов (30,6%). При этом наличие сопутствующей патологии достоверно не влияла на частоту его встречаемости, что вероятно, позволяет говорить о РА, как о причине появления МС. Увеличение частоты встречаемости МС почти в два раза при наличии системных проявлений РА, свидетельствует в пользу данного утверждения. Таким образом, наличие МС при РА может служить ранним маркером повреждения почек и служить «отправной точкой» для дальнейшего обследования.
Источник
· Клинический анализ крови (c лейкоцитарной формулой);
· Скорость оседания эритроцитов (СОЭ);
· Фибриноген;
· Антистрептолизин О;
· Мочевая кислота в сыворотке;
· С-реактивный белок, количественно (метод с нормальной чувствительностью);
· Ревматоидный фактор (РФ);
· Антинуклеарный фактор на HEp-2-клетках;
· Антитела к экстрагируемому ядерному антигену (ENA-скрин).
Какой биоматериал можно использовать для исследования?
Венозная кровь.
Метод исследования
· Проточная цитофлуориметрия: Клинический анализ крови (c лейкоцитарной формулой);
· Метод капиллярной фотометрии: СОЭ;
· Клоттинговый метод (детекция бокового светорассеяния, определение процента по конечной точке): Фибриноген;
· Иммунотурбидиметрия: Антистрептолизин О, С-реактивный белок, Ревматоидный фактор;
· Ферментативный колориметрический метод: Мочевая кислота;
· Непрямая реакция иммунофлюоресценции: Антинуклеарный фактор на HEp-2-клетках;
· Иммуноферментный анализ: Антитела к экстрагируемому ядерному антигену (ENA-скрин).
- В течение суток до исследования не употреблять алкоголь, а также лекарственные препараты (по согласованию с врачом);
- Не принимать пищу в течение 12 часов перед анализом;
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования;
- Не курить 3 часа до исследования
Общая информация об исследовании
Боли в суставах могут быть признаком артрита, в том числе ревматоидного, артроза, остеоартроза, подагры, хондрокальциноза, болезни Бехтерева и других заболеваний.
Воспаление суставов также может быть вызвано инфекционными или системными заболеваниями: грипп, скарлатина, туберкулез, гонорея, хламидиоз, а также хроническим очагом инфекции, вызванной стафилококками или стрептококками. В основе многих заболеваний суставов лежит воспалительный процесс, который становится причиной нарушений подвижности со стороны опорно-двигательной системы.
Воспаление является биохимической защитной реакцией организма в ответ на повреждение тканей, может носить как острый, так и хронический характер. Так, например, при ревматоидном артрите процесс системного хронического воспаления сопровождается повышением скорости оседания эритроцитов (СОЭ) и концентрации таких острофазных белков, как фибриноген и С-реактивный белок. Фибриноген является одним из факторов, известных под названием «ревматические пробы». Уровень фибриногена резко возрастает в крови при воспалении или повреждении ткани.
Антистрептолизин-О является одним из лабораторных маркеров ревматизма, применяется для дифференциальной диагностики ревматизма и ревматоидного артрита (в случае РА уровень антистрептолизина-О значительно меньше).Повышение данного показателя свидетельствует о сенсибилизации организма к стрептококковым антигенам.
Повышенное содержание мочевой кислоты является одним из признаков подагры, ревматизма, артрита и других нарушений. Если скорость синтезирования мочевой кислоты превышает скорость ее выведения из организма, нарушается процесс пуринового обмена. Задержка этого вещества в организме влияет на деятельность почек, развивается почечная недостаточность, влекущая за собой воспаления суставов, при котором кристаллы мочевой кислоты откладываются в суставной (синовиальной) жидкости.
Ревматоидный фактор (РФ) входит в список стандартных критериев ревматоидного артрита, установленных Американской ассоциацией ревматологов (AAR). Определяется у 75-80 % больных ревматоидным артритом, однако не является специфичным для ревматоидного артирита, а указывает на наличие подозрительной аутоиммунной активности. Его также обнаруживают при синдроме Шегрена, склеродермии, дерматомиозитах, гиперглобулинемиях, В-клеточных лимфопролиферативных заболеваниях. Около 30 % пациентов с системной красной волчанкой (СКВ), не имеющих признаков ревматоидного артрита, РФ-позитивны. Чувствительность РФ к ревматоидному артриту составляет всего 60-70 %, а специфичность 78 %.
Ревматоидный фактор — это антитела против фрагментов иммуноглобулина класса G (IgG). Чаще (до 90 % случаев) эти антитела относятся к иммуноглобулинам класса М (IgM), редко встречаются IgG, IgA, IgE. Несмотря на низкую специфичность, наличие РФ считается важным прогностическим признаком для исхода ревматоидного артрита.
Антинуклеарные антитела (другое название — антинуклеарный фактор) — гетерогенная группа антител, реагирующих с различными компонентами клеточного ядра. У здорового человека с нормальным иммунитетом антинуклеарных антител в крови быть не должно или их уровень не должен превышать установленные референсные значения. Утрата ряда легкорастворимых компонентов из ядра клеток НЕр-2 (стандартизованные клетки, которые используют при проведении анализа) или их перераспределение в цитоплазму может явиться причиной выявления низких титров антинуклеарного фактора на клеточной линии НЕр-2.
Целесообразно совместно с определением антинуклеарного фактора использовать определение специфичности антинуклеарных антител, что позволяет избежать ложноотрицательных результатов при системных ревматических заболеваниях. Под определением «специфичность антинуклеарных антител» понимают определение аутоантител к конкретным антигенам, для чего используют определение экстрагируемого ядерного антигена (ENA-скрин). ЕNА представляет собой легко растворимые компоненты ядра клетки. В данный тест входят антигены RNP-70, RNP/Sm, SS-A, SS-B, Scl-70, центромерный белок В и Jo-1, причем ряд из них получают рекомбинантным методом.
Благодаря высокой чувствительности, составляющей 95-98 %, комбинированное применение двух тестов позволяет проводить как раннюю диагностику системных заболеваний, так и уточнение диагноза системного заболевания при неясной клинической картине.
Специфичность ENA-скрининга несколько уступает специфичности исследования на антитела группы ENA посредством метода иммуноблота. Этот факт имеет особое значение в случае обследования лиц с подозрением на наличие системной красной волчанки, а также смешанного заболевания соединительной ткани. С учетом этого при положительном результате ENA-скрининга выполняется дополнительное подтверждающее исследование — иммуноблот.
Обнаружение антител указывает на наличие аутоиммунного нарушения, однако не указывает конкретное заболевание, поскольку тест является скрининговым исследованием. Цель любого скрининга — выявить людей с повышенным риском того или иного заболевания.
Для чего используется исследование?
- Дифференциальная диагностика артритов;
- Диагностика системных аутоиммунных заболеваний;
- Для диагностики ревматоидного артрита и синдрома Шегрена, а также для отличия их от других форм артрита и заболеваний со сходными симптомами.
Когда назначается исследование?
- При симптомах аутоиммунного заболевания (длительное повышение температуры, боли в суставах, усталость, потеря массы тела, изменение кожных покровов);
- При выявлении изменений, характерных для системных заболеваний соединительной ткани (повышение СОЭ, уровня С-реактивного белка, циркулирующих иммунных комплексов);
- При ревматоидном артрите (определение активности процесса, прогноз и контроль лечения заболевания);
- При подозрении на подагру (главный симптом — боли в суставах, чаще всего в большом пальце стопы);
- При нaличии утpeннeй cкoвaннocти или тугoпoдвижнocти cуcтaвoв.
Что означают результаты исследования?
Для постановки диагноза важно использовать комплексное обследование, которое включает в себя лабораторную диагностику, клинические данные и современные методы инструментального обследования суставов: КТ, МРТ, УЗИ.
Клинический анализ крови (c лейкоцитарной формулой)
Референсные значения: расшифровка общего анализа крови (см. подробное описание)
Лейкоцитарная формула обычно интерпретируется в зависимости от общего количества лейкоцитов. Если оно отклоняется от нормы, то ориентирование на процентное соотношение клеток в лейкоцитарной формуле может приводить к ошибочным заключениям. В этих ситуациях оценка производится на основании абсолютного количества каждого вида клеток (в литре — 1012/л — или микролитре — 109/л).
Подробнее о результатах: https://www.helix.ru/kb/item/02-005#subj12
Скорость оседания эритроцитов (СОЭ)
Референсные значения:
Пол | Возраст | Референсные значения |
Мужской | До 15 лет | 2 — 20 мм/ч |
От 15 до 50 лет | 2 — 15 мм/ч | |
Старше 50 лет | 2 — 20 мм/ч | |
Женский | До 50 лет | 2 — 20 мм/ч |
Старше 50 лет | 2 — 30 мм/ч |
При артрите четко выражена воспалительная картина крови с резким повышением СОЭ до 40-80 мм.
Подробнее о результатах: https://www.helix.ru/kb/item/02-007#subj12
Фибриноген
Референсные значения: 1,8 — 3,5 г/л
Подробнее о результатах: https://www.helix.ru/kb/item/03-011#subj12
Антистрептолизин О
Референсные значения:
Возраст | Референсные значения |
До 14 лет | 0 — 150 МЕ/мл |
Старше 14 лет | 0 — 200 МЕ/мл |
Подробнее о результатах: https://www.helix.ru/kb/item/06-007#subj12
Мочевая кислота в сыворотке
Референсные значения:
Пол | Референсные значения |
Мужской | 202,3 — 416,5 мкмоль/л |
Женский | 142,8 — 339,2 мкмоль/л |
Подробнее о результатах: https://www.helix.ru/kb/item/06-033#subj12
С-реактивный белок, количественно (метод с нормальной чувствительностью)
Референсные значения: 0 — 5 мг/л
Подробнее о результатах: https://www.helix.ru/kb/item/06-182#subj12
СРБ больше 10 мг/л свидетельствует об остром воспалении, хроническом заболевании, травме и т. д. При вирусных инфекциях, метастазах, вялотекущих хронических и некоторых системных ревматических заболеваниях концентрация СРБ составляет 10-30 мг/л; при бактериальных инфекциях, обострении некоторых хронических воспалительных заболеваний (например, ревматоидного артрита) и повреждении тканей (хирургическая операция, острый инфаркт миокарда) — 40-100 мг/л (иногда 200 мг/л), при тяжелых генерализованных инфекциях, ожогах и сепсисе — до 300 мг/л и более.
Ревматоидный фактор
Референсные значения:
Подробнее о результатах: https://www.helix.ru/kb/item/13-020#subj12
Антинуклеарный фактор на HEp-2-клетках
Референсные значения:титр антител, не превышающий значение 1:160 считается отрицательным
Положительный результат: титр антител 1:320 и более
- Отрицательный результат у пациента с признаками аутоиммунного процесса не исключает наличия аутоиммунного заболевания;
- ANA выявляются у 3-5 % здоровых людей (10-37 % в возрасте старше 65 лет);
- При положительном анализе на антинуклеарные антитела необходимо провести иммуноблот антинуклеарных антител для уточнения типа аутоиммунного заболевания и постановки диагноза.
Подробнее о результатах: https://www.helix.ru/kb/item/13-045#subj12
Антитела к экстрагируемому ядерному антигену (ENA-скрин)
Референсные значения: отрицательно
При назначении иммуносупрессивной терапии результат анализа может быть отрицательным.
Подробнее о результатах: https://www.helix.ru/kb/item/13-046#subj12
Что может влиять на результат?
- Уремия может приводить к ложноотрицательному результату ANA-анализа;
- Многие лекарственные препараты ассоциированы с развитием лекарственной волчанки и появлением ANA в крови;
- Некоторые препараты понижают уровень фибриногена: стероидные анаболические средства, фенобарбитал, стрептокиназа, урокиназа, а также вальпроевая кислота;
- Ложноотрицательные результаты при анализе антистрептолизина О могут наблюдаться при нефротическом синдроме, а также лечении кортикостероидами и некоторыми антибиотиками; к завышенным показателям приводят гиперхолестеринемия и заболевания печени;
- Стресс, сильная физическая нагрузка, рацион, богатый пуринами, анаболические стероиды, никотиновая кислота, эпинефрин, тиазидные диуретики, бета-адреноблокаторы, фуросемид и некоторые другие лекарственные вещества могут приводит к ложнозавышенным результатам уровня мочевой кислоты;
- Частота ложнопозитивных результатов теста на ревматоидный фактор повышается с возрастом пациента.
Кто назначает исследование?
Ревматолог, иммунолог, ортопед, невропатолог, терапевт.
[13-007] Антитела к двухцепочечной ДНК (анти-dsDNA), IgG
[13-014] Антитела к циклическому цитруллинсодержащему пептиду, IgG
[13-026] Антитела к цитруллинированному виментину (анти-MCV)
[13-063] Антинуклеарные антитела, IgG (анти-Sm, RNP/Sm, SS-A, SS-B, Scl-70, PM-Scl, PCNA, dsDNA, CENT-B, Jo-1, к гистонам, к нуклеосомам, Ribo P, AMA-M2), иммуноблот
[20-024] Циркулирующие иммунные комплексы (ЦИК)
Литература:
1. Насонов Е.Л., Александрова Е.Н. Современные стандарты лабораторной диагностики ревматических заболеваний. Клинические рекомендации / БХМ, М. — 2006.
2. Ревматология: Национальное руководство / под ред. Е.Л. Насонова, В.А. Насоноовой. — М.: ГЭОТАР-Медиа, 2008. — 720 с.
3. Клиническая ревматология (руководство для практических врачей) / под ред. члена-корресподента РАМН профессора В.И. Мазурова. — СПб.: ООО «Издательство Фолиант», 2001. — 416 с.
Источник
