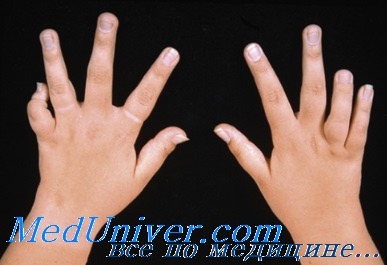
Ювенильный идиопатический артрит алексеева

Ювенильный идиопатический артрит (ЮИА) у детей: клиника, диагностика, лечениеТермин «ювенильный идиопатический артрит (ЮИА)» используют у детей и подростков со стойкой припухлостью суставов, появившейся до 16-летного возраста при отсутствии инфекции или любой другой определённой причины. У 95% детей с ювенильным идиопатическим артритом заболевание клинически и иммунологически отличается от ревматоидного артрита у взрослых. Ювенильный идиопатический артрит — редкая патология, врач общей практики в среднем сталкивается с новым случаем заболевания 1 раз в 20 лет. Тем не менее ювенильный идиопатический артрит (ЮИА) является одной из наиболее частых причин физической инвалидизации в детском возрасте, его распространённость составляет 1 на 1000 детского населения, в Великобритании этим заболеванием страдают более 12 000 детей. Существует не менее семи различных форм ювенильного идиопатического артрита (ЮИА). В зависимости от дебюта выявляют системный, полиартритический (поражение более четырёх суставов) и олигоартритический (до четырёх суставов включительно) варианты. Также выделяют псориатический артрит и артрит с энтезитами. Кроме того, учитывают наличие ревматоидного фактора (РФ) и HLA B27. Осложнения ювенильного идиопатического артритаХронический передний увеит. Заболевание может протекать бессимптомно, но способно привести к выраженному снижению зрения. Показано регулярное офтальмологическое обследование (осмотр с использованием щелевой лампы), особенно при олигоартикулярном варианте. Сгибательные контрактуры суставов формируются вследствие того, что дети держат сустав в наиболее удобном положении, при котором внутрисуставное давление минимально. При хроническом воспалении возможна деструкция сустава, что обусловливает необходимость в протезировании суставов у некоторых детей. Задержка роста. Задержка роста может быть связана с анорексией, хроническим воспалением, терапией глюкокортикоидами. Дифференциальная диагностика при системном варианте ювенильного идиопатического артрита:
Лечение ювенильного идиопатического артрита (ЮИА) у детейЦель лечения заключается в поддержании приемлемого качества жизни пациента и сохранении функций суставов во время всего периода активности заболевания. Большое значение имеет обучение и поддержка пациента ревматологической бригадой, включающей детского ревматолога и средний медперсонал, обеспечивающий реабилитационные мероприятия, обучение пациента, контроль за переносимостью и побочными эффектами принимаемых лекарственных препаратов, консультации по вопросам питания, школьного обучения, семейную, социальную и психологическую поддержку. При необходимости привлекают и других специалистов-педиатров — офтальмолога, ортопеда, челюстно-лицевого хирурга, нефролога, дерматолога и психиатра. Для успешного лечения необходимы сильная мотивация и приверженность к лечению со стороны пациента. Для сохранения подвижности пациента, поддержания полного объёма движений в суставах и мышечной силы большое значение имеет физиотерапия. Обычно необходимо ежедневное выполнение специальных упражнений. Полезным дополнением может служить гидротерапия. Для предотвращения формирования сгибательных контрактур можно применять ночные шины, также используют «рабочие» шины для запястий, чтобы обеспечить необходимую позу при письме. Все дети с активным артритом для купирования болей и подавления воспаления должны регулярно принимать НПВС (ибупрофен, пироксикам или напроксен). Эффективны внутрисуставные инъекции глюкокортикоидов (могут потребоваться повторные введения). По возможности следует избегать системного применения глюкокортикоидов, обладающих широким спектром неблагоприятных побочных эффектов, включая замедление роста. Тем не менее для купирования активного полиартрита иногда необходимо внутривенное введение метилпреднизолона, в части случаев эту терапию проводят по жизненным показаниям, например, при системном варианте артрита с перикардитом. Противоревматические препараты (средства, изменяющие течение заболевания) могут потребоваться в случаях, когда заболевание не удаётся контролировать с помощью НПВС и внутрисуставных инъекций глюкокортикоидов. У детей с полиартритом приблизительно в 70% случаев эффективен метотрексат, при системном варианте его эффективность ниже. Препарат оказывает наибольший эффект при подкожном введении, его также можно назначать внутрь. Необходим мониторинг побочных эффектов, из которых чаще всего наблюдают тошноту, также возможны боли в животе, повышение активности печёночных трансаминаз и, в редких случаях, изъязвление слизистой оболочки полости рта, выпадение волос и миелосупрессия. Обязателен контроль ФПП и признаков миелосупрессии. При неэффективности метотрексата или его непереносимости всё чаще применяют анти-ФНО и другие биологические средства. Прогноз при ювенильном идиопатическом артрите (ЮИА) у детейИногда возможно развитие спонтанных ремиссий, но объективные прогностические показатели такого исхода неизвестны. Результаты длительных наблюдательных исследований свидетельствуют, что прогноз при ювенильном идиопатическом артрите (ЮИА) существенно хуже, чем полагали ранее. Не менее чем у 30% пациентов в зрелом возрасте сохраняется активный артрит, у многих формируются стойкие остаточные явления в виде ограничения подвижности в суставах, низкого роста и внесуставных нарушений. Полученные данные стали основанием для внедрения более агрессивных схем терапии, чем ранее применявшиеся. — Также рекомендуем «Наследственные болезни скелета у детей: клиника, диагностика» Оглавление темы «Заболевания детей»:
|
Источник
Ювенильный идиопатический артрит (ЮИА) это наиболее распространенное ревматическое заболевание среди детей. В классификации Международной лиги ревматологических ассоциаций (League of Associations for Rheumatology, ILAR) (Durban, 1997 г.) выделяют следующие типы артрита. Системный вариант — это артрит, сопровождающийся лихорадкой в сочетании с летучей эритематозной сыпью, и/или серозитом, и/или генерализованной лимфаденопатией, и/или гепатомегалией, и/или спленомегалией. Олигоартикулярный вариант — это артрит с поражением от 1 до 4 суставов в течение первых 6 месяцев болезни, эта форма артрита является типичной для детей и не наблюдается у взрослых. Выделяется два подтипа олигоартрита: персистирующий олигоартрит — поражается от 1 до 4 суставов за весь период болезни и прогрессирующий олигоартрит — поражается 5 суставов и более после 6 месяцев болезни. Полиартикулярный вариант (негативный/позитивный по ревматоидному фактору) — это артрит с поражением 5 суставов или более в течение первых 6 месяцев болезни, ревматоидный фактор отрицательный/положительный соответственно. Псориатический артрит — поражение, проявляющееся артритом и псориазом или артритом и двумя из следующих симптомов: дактилитом/изменением ногтей/семейным псориазом, подтвержденным дерматологом у лиц 1-й степени родства. Энтезитный артрит — основными клиническими проявлениями являются артрит и энтезит или артрит, либо энтезит с двумя из следующих признаков: чувствительность сакроилеальных сочленений и/или боль в спине (воспаление)/обнаружение HLA-B27 в крови/семейный анамнез (HLA-B27-ассоциированные болезни у лиц 1-й или 2-й степени родства). Другие артриты — это артриты, причина возникновения которых неизвестна, персистирующие в течение 6 недель, не укладывающиеся в характеристику какой-либо категории или отвечающие критериям более чем одной категории. Группа неопределенных артритов включает пациентов, которые не удовлетворяют критериям включения в любую из категорий или которые отвечают критериям более чем одной категории [1].
У больных ЮИА часто встречается устойчивость к терапии различными препаратами, в том числе нестероидными противовоспалительными средствами (НПВС), а также к внутрисуставным инъекциям и физиотерапии [2]. Для лечения ЮИА используется несколько групп препаратов: НПВС, глюкокортикоиды (ГК), иммуносупрессивные препараты и биологически-активные вещества, полученные генно-инженерным путем. Применение НПВС и ГК оказывает обезболивающий и противовоспалительный эффекты, но не способствует предотвращению деструкции суставов и инвалидизации больных.
Известно, что иммуносупрессивная и биологическая терапии зачастую приостанавливают развитие системных проявлений и прогрессирование деструкции суставов. Иммуносупрессивная терапия должна быть дифференцированной, длительной и непрерывной, начинаться сразу после верификации диагноза в течение первых 3–6 месяцев болезни [3].
«Золотым стандартом» в терапии ЮИА можно считать метотрексат (МТХ) [2] — цитостатический препарат из группы антиметаболитов, антагонистов фолиевой кислоты.
МТХ оказывает выраженное иммуносупрессивное действие даже в относительно низких дозах, не характеризующихся заметной гематологической токсичностью. Несмотря на это, при приеме МТХ рекомендовано проводить клинико-лабораторный мониторинг, который необходим для предупреждения побочных эффектов [4]. По данным различных авторов около 70% пациентов, получающих терапию МТХ, входят в ремиссию по заболеванию.
В 1988 г. МТХ был разрешен Управлением по надзору за качеством пищевых продуктов и лекарственных средств США (Food and Drugs Administration of the United States, FDA) для лечения ревматоидного артрита [4]. В настоящее время МТХ является основным препаратом в лечении ЮИА [2]. Популярные терапевтические рекомендации по назначению МТХ основаны на рандомизированном двойном слепом плацебо-контролируемом исследовании, проведенном в 1992 г. В ходе исследования сравнивались группы пациентов с устойчивым к терапии артритом: получающие низкую дозу МТХ (10 мг/м2/нед), получающие очень низкую дозу МТХ (5 мг/м2/нед) и получающие плацебо. Результатом исследования стало повышение дозы МТХ у «плохоотвечающих» на терапию пациентов, так как уже появился длительный опыт применения МТХ. Отчеты еще одного исследования поддерживают использование высоких доз МТХ (25–30 мг/м2 или 0,8–1 мг/кг) у пациентов ЮИА, не отвечающих на стандартную дозу (10–15 мг/м2 или 0,3–0,5 мг/кг) [5]. Однако только одно исследование применения МТХ у детей сравнило эффективность высоких доз (30 мг/м2) МТХ со средней дозой МТХ (15 мг/м2) [6]. Никакой разницы в эффективности и токсичности терапии замечено не было. Более того, это исследование включило только детей с ЮИА, которые до исследования уже имели опыт терапии стандартной дозой МТХ без эффекта. Современные тенденции раннего и агрессивного лечения артритов сопровождаются практическим использованием высоких начальных доз МТХ как попыткой предотвратить поздние осложнения и нетрудоспособность, несмотря на отсутствие объективных клинических исследований, сравнивающих токсичность и эффективность при начальной высокой дозе и стандартной дозе МТХ для поддержки такой практики. По этой причине ученые не могут прийти к единому мнению, с какой дозы стоит начинать терапию МТХ у детей с ЮИА [7].
Ретроспективные данные о терапии метотрексатом у детей и подростков впервые были опубликованы в 1986 г. В метаанализе Giannini и соавт. сравнили МТХ (5–10 мг/м2/нед) с пенициламином, гидроксихлорокином и ауранофином. Только при применении МТХ в дозе 10 мг/м2/нед была отмечена положительная динамика по сравнению с плацебо. Эффективность терапии МТХ у детей была оценена в контролируемом исследовании, которое показало, что МТХ несколько эффективнее лефлуномида. В ходе исследования дети, в том числе подростки, в возрасте 3–17 лет, получали лефлуномид или МТХ в течение 16 недель. Группа, получающая МТХ, дала лучший ответ на терапию [2].
В 2011 г. Американской коллегией ревматологии (American College of Rheumatology, ACR) были выпущены рекомендации по лечению ювенильного идиопатического артрита. Авторами были рассмотрены 4 схемы терапии [8].
Первая схема относится к больным с поражением до 4 суставов. При отсутствии высокой активности рекомендуется начинать с монотерапии НПВС, в случае неэффективности и прогрессирования рекомендовано переходить к внутрисуставному введению ГК, в дальнейшем предусматривалось назначение МТХ. МТХ может быть заменен на сульфасалазин, у больных с энтезитассоциированной формой ЮИА. В случае высокой активности или быстрого прогрессирования рекомендовано начинать с внутрисуставных введений ГК или назначения в/м МТХ. При неэффективности этих схем или прогрессирования заболевания назначаются блокаторы фактора некроза опухоли альфа (ФНО-альфа).
Вторая схема предназначена для больных с поражением 5 суставов и более, таким пациентам рекомендовано назначение МТХ (или лефлуномида), а также возможно назначение НПВС и ГК (локально). Через 3–6 месяцев при отсутствии положительной динамики или сохранении активности рекомендуется назначать ингибиторы ФНО-альфа. В случае, если в течение 4 месяцев положительная динамика не получена, авторы предлагают назначение другого препарата анти-ФНО-альфа или абатацепта.
Для лечения детей с системным вариантом ЮИА используются две вышеописанные схемы. Третья схема предусматривает терапию пациентов с активными системными проявлениями, таким детям рекомендовано назначение системных ГК, в случае невысокой активности можно начинать с курса НПВС. В дальнейшем рекомендован переход на ингибитор интерлейкина-1 (ИЛ-1) (анакинру). В тяжелых случаях заболевания ингибитор ИЛ-1 предлагается как препарат выбора для начального лечения. В четвертой схеме описывается терапия пациентов с системным ЮИА, в настоящий момент имеющих активный артрит. Таким больным рекомендовано начинать терапию с МТХ в сочетании с НПВС и ГК (локально), затем через 3 месяца решать вопрос о назначении блокаторов ФНО-альфа или ингибитора ИЛ-1 (рис. 1).
По рекомендациям Американской коллегии ревматологии по лечению ЮИА 2011 г., больным, получающим терапию МТХ, необходимо проводить клинический анализ крови, определять уровни аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и креатинина в сыворотке крови перед назначением терапии, а также через 1 месяц после первого введения препарата. При повышении дозы МТХ необходимо контролировать показатели крови через 1–2 месяца после изменения дозировки. При нормальном течении заболевания и стабильной дозе МТХ рекомендовано повторять анализ крови 1 раз в 3–4 месяца [8].
.gif)
В 2012 г. в журнале «Клиническая иммунология» были опубликованы немецкие рекомендации по лечению ЮИА [9]. При олигоартрикулярном варианте рекомендовано начинать терапию с НПВС, затем применяются внутрисуставные введения ГК, при неэффективности такой терапии назначается МТХ. Пациентам с полиартикулярной формой ЮИА в дебюте, кроме НПВС, рекомендовано назначать ГК как локально, так и системно. На втором этапе назначается МТХ. При сохранении активности добавляется терапия анти-ФНО-альфа, а при невысокой активности и недостаточном эффекте МТХ рекомендуется заменить его на препараты анти-ФНО-альфа. У больных с системным вариантом ЮИА, кроме НПВС, в дебюте назначаются ГК в виде пульс-терапии, на следующем этапе назначается МТХ, который в дальнейшем рекомендовано комбинировать с биологической терапией (рис. 2).
Ruperto и соавт. [10] провели исследование по применению более высоких доз для парентерального введения метотрексата (средняя доза 15 мг/м2/нед и высокая доза 30 мг/м2/нед). Результатом исследования стало, что больные, получившие высокие (30 мг/м2/нед) дозы МТХ, не дали большего терапевтического ответа, чем те пациенты, кто получил в средней дозе по 15 мг/м2.
Для корректного назначения МТХ необходимо рассчитать площадь поверхности тела (ППТ), для этого можно использовать формулу — ППТ = (рост × вес/3600), где ППТ — это площадь поверхности тела (м2), рост — рост (см), вес — масса тела (кг), кроме того, для определения ППТ можно использовать специальные таблицы (табл. 1).
_575.gif)
Для достижения лучшего эффекта от терапии метотрексатом рекомендуется комбинирование с НПВС, а также с биологическими препаратами [2]. В 2011 г. в Финляндии K. J. Aaltonen и соавт. было проведено большое исследование по применению анти-ФНО-препаратов у детей с различными формами ЮИА. Результатом этого исследования стал вывод, что при комбинации препаратов анти-ФНО с МТХ эффективность значительно выше, чем после применения этих препаратов по отдельности [11].
В клинических рекомендациях для педиатров по детской ревматологии под редакцией А. А. Баранова и Е. И. Алексеевой изложены общепринятые схемы лечения ювенильного артрита и дозирования основных препаратов. Согласно этим рекомендациям у больных с олигоартритом МТХ применяется в дозе 10–15 мг/м2/нед, при полиартритическом варианте в дозе 15–25 мг/м2/нед, а при системном варианте рекомендовано назначать МТХ в дозе 20–25 мг/м2/нед (в случае неэффективности у больных с системным артритом назначается пульс-терапия с МТХ в дозе 50 мг/м2/нед, в течение 8 недель) [12].
Нами было проведено исследование, целью которого стала попытка определения эффективной концентрации МТХ в сыворотке крови у больных с ЮИА.
Было обследовано 103 ребенка больных ЮИА, среди которых — 65 (63,11%) девочек и 38 (36,89%) мальчиков с различными формами ювенильного идиопатического артрита. Детей с полиартритом — 46 (44,66%), с олигоартритической формой ЮИА — 25 детей (24,27%), системный вариант артрита диагностирован у 14 детей (13,59%), энтезитассоциированный артрит встречался у 18 больных (17,48%) (рис. 3).
Все дети, включенные в исследование, получали базисную терапию метотрексатом в дозе 15 мг/м2 в течение трех месяцев и более. У 35 пациентов (34%) к терапии МТХ добавлена биологически активная терапия (тоцилизимуб, этанерцепт, инфликсимаб, голимумаб, абатацепт), 11 пациентов (10,68%) получают в дополнение к терапии МТХ сульфасалазин (ССЗ), 24 ребенка (23,3%) — циклоспорин А (ЦсА), 37 детей (35,92%) — получают преднизолон или метилпреднизолон (в таблетках или в виде пульс-терапии). Обращает внимание, что у 46 (44,66%) пациентов наблюдается положительный эффект от монотерапии МТХ, не требующий назначения дополнительных препаратов (рис. 4).
.gif)
С. A. Wallace и соавт. разработали критерии «неактивной» болезни. «Неактивная» болезнь — это отсутствие суставов с активным артритом, отсутствие лихорадки, сыпи, серозита, спленомегалии или генерализованной лимфоаденопатии, связанной с ЮИА, отсутствие обострения увеита, нормальные значения скорости оседания эритроцитов (СОЭ) или уровня С-реактивного белка и объективный осмотр, подтверждающий отсутствие активной болезни [13]. Все больные были разделены нами на две группы: с активной и неактивной болезнью. Концентрация МТХ в сыворотке крови в этих группах никак не отличалась (табл. 2).
По полученным нами данным, концентрация МТХ в сыворотке крови находилась в диапозоне от 0,76 ммоль/л до 3,96 ммоль/л. Достоверных различий в зависимости от активности заболевания, вида артрита, длительности терапии МТХ получено не было. Таким образом, определение концентрации МТХ в сыворотке крови у больных ЮИА не позволяет прогнозировать эффективность проводимой терапии.
МТХ обладает хорошим профилем безопасности. Для снижения риска развития побочных эффектов больным назначают фолиевую кислоту (в дозе 1–5 мг) в те дни, когда МТХ не используется, так как при одновременном приеме фолиевая кислота может снижать эффективность МТХ [12]. Важной особенностью применения этого препарата является использование 1 раз в неделю.
Использование цитостатической терапии (МТХ) является препаратом выбора во всех странах при терапии различных форм ЮИА и является «золотым стандартом» лечения пациентов с этим заболеванием.
Литература
- Ravelli A., Martini A. Juvenile idiopathic arthritis // Lancet. 2007. 369, 767–778.
- Niehues T., Lankisch P. Recommendations for the Use of Methotrexate in Juvenile Idiopathic Arthritis // Pediatric Drugs. 2006. P. 347–356.
- Алексеева Е. И., Бзарова Т. М. Ювенильный артрит: возможности медикаментозного и немедикаментозного лечения на современном этапе // Лечащий Врач. 2011. № 8.
- Khan Z. A., Tripathi R., Mishra B. Methotrexate: a detailed review on drug delivery and clinical aspects // Expert Opin. Drug Deliv. 2012. Vol. 9 (2). P. 151–169.
- Wallace C. A., Sherry D. D. Preliminary report of higher dose methotrexate treatment in juvenile rheumatoid arthritis // J Rheumatol. 1992. Vol. 19. P. 1604–1607.
- Ruperto N., Murray K. J., Gerloni V. et al. A randomized trial of parenteral methotrexate comparing an intermediate dose with a higher dose in children with juvenile idiopathic arthritis who failed to respond to standard doses of methotrexate // Arthritis Rheum. 2004. Vol. 50. P. 2191–2201.
- Becker M. L., Rose C., Cron R. et al. Effectiveness and Toxicity of Methotrexate in Juvenile Idiopathic Arthritis: Comparison of 2 Initial Dosing Regimens // J Rheumatol. 2010. P. 870–875.
- Beukelman T., Patkar N., Saag K. et al. 2011 American College of Rheumatology Recommendations for the Treatment of Juvenile Idiopathic Arthritis: Initiation and Safety Monitoring of Therapeutic Agents for the Treatment of Arthritis and Systemic Features // Arthritis Care & Research. 2011. P. 465–482.
- Dueckers G., Guellac N., Arbogast M. Evidence and consensus based GKJR guidelines for the treatment of juvenile idiopathic arthritis // Clinical Immunology. 2012. 142. P. 176–193.
- Kahn P. Juvenile Idiopathic Arthritis Current and Future Therapies // Bulletin of the NYU Hospital for Joint Diseases. 2009, 67 (3). P. 291–302.
- Aaltonen K., Virkki L., Malmivaara A. et al. Systematic Review and Meta-Analysis of the Efficacy and Safety of Existing TNF Blocking Agents in Treatment of Rheumatoid Arthritis // Plos ONE. 2012. Vol. 7, Issue 1. P. 1–14.
- Клинические рекомендации для педиатров: детская ревматология. Лекарственные средства, применяемые для лечения ревматических болезней у детей. Баранов А. А., Алексеева Е. И. 2011, с. 206–207.
- Wallace C. A. Current management of juvenile idiopathic arthritis // Best Practice & Research Clinical Rheumatology. 2006. P. 279–300.
Ф. В. Рохлина
Г. А. Новик, доктор медицинских наук, профессор
ГБОУ ВПО СПбГМПУ МЗ РФ, Санкт-Петербург
Контактная информация об авторах для переписки: faina.rokhlina@gmail.com
Источник