Клинические рекомендации по артриту

Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
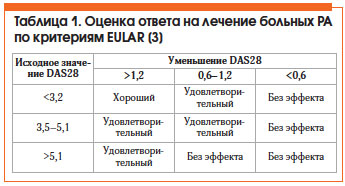
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

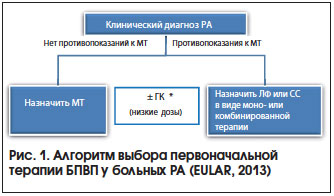
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
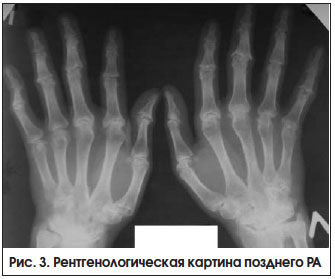
III. Пациент с поздним РА и остеопоротическими переломами
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
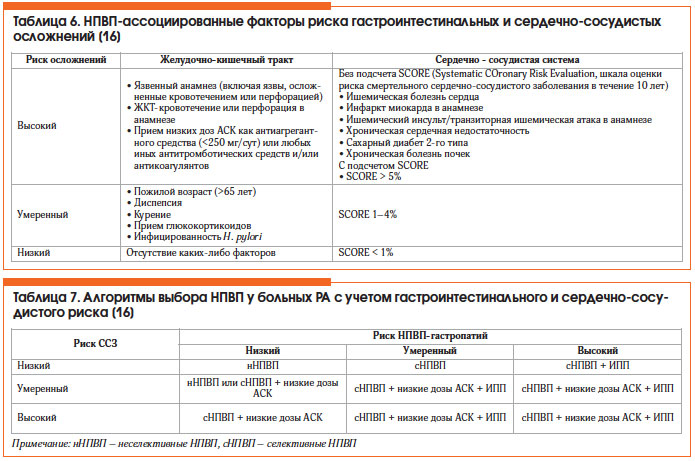
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник
В статье представлены обновленные на основании доказательной системы GRADE и новых систематических обзоров и метаанализов клинические рекомендаций по лечению больных остеоартритом 2019 года. СЛУШАТЬ АУДИОЗАПИСЬ СТАТЬИ.

Введение
Остеоартрит (ОА) — это хроническое прогрессирующее заболевание, при котором в зависимости от тяжести болезни требуется комплексный подход к лечению. ОА чаще возникает во второй половине жизни, и, по данным эпидемиологических исследований, частота его возрастает из-за увеличения продолжительности жизни человека. Второй, не менее важной, причиной его возникновения является «эпидемия» ожирения, которое не только ассоциируется с развитием ОА, но и обусловливает более быструю прогрессию болезни [1]. Эти факторы определяют и высокую коморбидность больного ОА, при которой наблюдается повышение риска развития кардиоваскулярных заболеваний (КВЗ), нежелательных явлений (НЯ) со стороны желудочно-кишечного тракта (ЖКТ), почек, влияющих на выбор антиостеоартритической терапии.
Современная модель доказательной медицины основывается на принципе использования баз данных, путем анализа которых принимаются клинические решения и рекомендации. Рекомендации, в свою очередь, создаются на основе баланса между относительной пользой и вредом от лечения, с одной стороны, и важности лечения для пациента и его предпочтений — с другой.
Работа над рекомендациями по лечению больных ОА крупных суставов берет свое начало в 1995 г., когда эксперты Американского колледжа ревматологов предложили клинические рекомендации по управлению ОА крупных суставов. Немного позже последовательно появились рекомендации, созданные под эгидой EULAR (European League Against Rheumatism — Европейская антиревматическая лига) по управлению ОА коленных, тазобедренных суставов и суставов кистей [2–4]. Далее были предложены совместные европейские и американские рекомендации по ведению больных ОА [5–7].
Углубленное изучение патогенетических путей развития болезни привело к пониманию того, что ОА включает в себя несколько подтипов болезни, которые можно гипотетически разделить, например, по установленным факторам риска развития ОА либо по первоначальным изменениям тех или иных тканей, образующих сустав (остеогенный, воспалительный и др.). И, безусловно, меняющееся представление об ОА ставит новые задачи по его лечению, а именно создание рекомендаций для определенного фенотипа ОА. Это обусловлено прежде всего весьма противоречивыми результатами многочисленных систематических обзоров и метаанализов, на основании которых разрабатываются клинические рекомендации по лечению ОА.
Подходы к лечению ОА
Первая попытка персонифицированного подхода к лечению ОА коленных суставов была предпринята экспертами OARSI (Osteoarthritis Research Society International — Международное общество по изучению остеоартрита) [8], которые предложили дифференцированный подход к лечению на основании выделения фенотипов ОА по локализации поражения и наличию или отсутствию коморбидности (рис. 1).
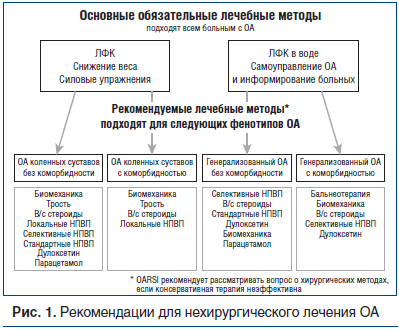
В июле 2014 г. [9] был опубликован алгоритм ведения больных ОА коленных суставов в реальной клинической практике, последовательно отражающий основные принципы лечения ОА. Он был создан комитетом, состоящим из клиницистов и ученых разных стран, Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (ESCEO), и учитывал эффективность и безопасность лечебных мероприятий.
Существующие многочисленные рекомендации по лечению ОА содержат данные по эффективности тех или иных методов лечения, но различные уровни доказательств относительно безопасности и НЯ терапии ОА. На очередном конгрессе ESCEO в 2019 г., состоявшемся в Париже, были обновлены прежние рекомендации на основании доказательной системы GRADE и новых систематических обзоров и метаанализов.
Лечение больных ОА должно проводиться с использованием комбинации нефармакологических и фармакологических методов. Нефармакологические методы помимо образовательных программ, лечебной физкультуры и снижения массы тела должны включать ортопедические приспособления для коррекции оси сустава. Интересно, что недавно появились рекомендации по немедикаментозным методам для врачей первичного звена (рис. 2), которые с учетом гетерогенности боли при ОА рекомендуют психосоциальные вмешательства и коррекцию нарушений сна [10].
![Рис. 2. Рекомендации EULAR по ведению пациентов с ОА [10] Рис. 2. Рекомендации EULAR по ведению пациентов с ОА [10]](https://www.rmj.ru/upload/medialibrary/a78/2-2.png)
Что касается медикаментозного лечения, то пошаговое назначение препаратов сохранено (рис. 3). Шаг 1 — это базисное лечение ОА. На первых этапах при небольших болях рекомендовался прием парацетамола. Парацетамол длительное время использовался в качестве анальгетического средства при ОА благодаря его безопасности, несмотря на относительно небольшой анальгетический эффект. В последние годы стало увеличиваться количество данных о повышении частоты развития КВЗ, НЯ со стороны ЖКТ, почек и печени при длительном его применении. Conaghan et al. [11] представили клинический обзор литературы по безопасности парацетамола, рекомендуя c осторожностью использовать его при хронической боли.
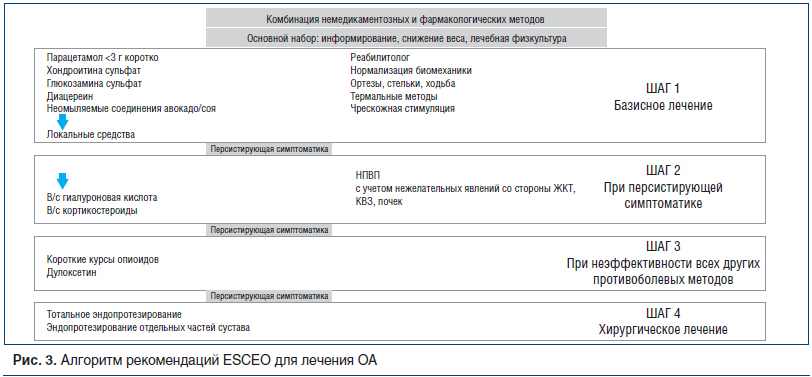
Симптоматические медленнодействующие препараты (SYSADOA) — класс разнообразных препаратов, которые положительно влияют на симптомы ОА и имеют доказательства болезнь-модифицирующего действия при их длительном применении [12–14]. Метаанализы плацебо-контролируемых исследований SYSADOA доказали, что глюкозамина сульфат (ГС), хондроитина сульфат (ХС) и диацереин, неомыляемые соединения авокадо/соя обладают положительным действием (от небольшого до умеренного) при ОА [14]. ESCEO рекомендуют использование этих препаратов, но только фармацевтически качественных, как первое базисное лечение ОА. Применение в нескольких исследованиях кристаллизованного ГС продолжительностью от 6 мес. до 3 лет при ОА доказало его преимущество перед плацебо по влиянию на боль (0,27 (95% доверительный интервал (95% ДИ): 0,12–0,43) и функцию суставов (0,33 (95% ДИ: 0,17–0,48) [15]. Другими словами, размер эффекта оказался таким же, как при применении коротких курсов нестероидных противовоспалительных препаратов (НПВП), а применение его в течение 3 лет замедляло прогрессирование ОА [16]. В России появились инъекционная и пероральная формы ГС — Сустагард®Артро, изучен синергизм препарата с 7 наиболее часто назначаемыми НПВП, его антитромботические эффекты, безопасность его применения при сопутствующем сахарном диабете, установлено синергичное действие ГС одновременно на транскриптом, протеом и реактом. Комплексное противовоспалительное действие ГС, снижающее синтез провоспалительных цитокинов и ослабляющее их воздействие на клетки, является фактором, влияющим на патогенез не только ОА, но и коморбидных ему патологий, сопровождающихся хроническим воспалением [17, 18].
ХС тоже способен замедлять прогрессирование ОА, кроме того, этот препарат обладает довольно выраженным действием на боль — размер анальгетического эффекта, по некоторым данным, достигает 0,75. Недавно опубликованное исследование показало эффективность ХС в отношении уменьшения структурных изменений в суставах с параллельным симптоматическим клинически значимым действием [19], что нашло подтверждение и в последующих работах. Эффективность и безопасность инъекционной формы ХС (Хондрогард®) изучались у 70 пациентов с ОА коленных суставов в ФГБНУ НИИР им. В.А. Насоновой. Терапия ХС в виде внутримышечных инъекций была эффективна у подавляющего большинства больных. Отмечено статистически значимое улучшение как отдельных показателей: боли, скованности, функциональной недостаточности (ФН), так и индекса WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index) в целом. Из 63 пациентов, отметивших положительный эффект проводимой терапии, полностью прекратили прием НПВП 44% человек. Уменьшили дозу в 2 раза или стали принимать НПВП не чаще 1 раза в 3 дня 33% больных [20].
Несмотря на противоречивость некоторых рекомендаций по лечению ОА, SYSADOA широко с успехом используются во многих странах и как рецептурные препараты, и как продаваемые без рецепта. Профиль безопасности препаратов этой группы был представлен в систематическом обзоре и метаанализе исследований по сравнению SYSADOA с плацебо при ОА [21]. ХС и ГС, только фармацевтически качественные, рекомендуются как безопасные и эффективные SYSADOA. Ограниченные данные относительно безопасности представлены по неомыляемым соединениям авокадо/соя, которые содержат ингредиенты из многих натуральных растительных экстрактов, показана безопасность запатентованного препарата. Применение диацереина ассоциируется с отдельными небезопасными явлениями, поэтому польза препарата должна оцениваться для каждого пациента с учетом подходящей дозы и характеристик больного [22].
Локальные НПВП в целом рекомендуются до назначения пероральных НПВП, они обладают умеренным действием на боль, сравнимым с эффектом пероральных НПВП, но лучшим профилем безопасности благодаря низкой системной адсорбции. Эти данные систематического обзора и метаанализа представлены Honvo et al. [23]. Было отмечено незначимое увеличение кожных и подкожных НЯ, большинство из них относились к диклофенаку. Локальные НПВП могут рассматриваться как безопасное лечение, особенно по отношению к ЖКТ.
При персистирующей симптоматике назначаются системные НПВП. Их средняя эффективность при лечении боли ассоциируется с широким диапазоном токсичности со стороны ЖКТ, КВЗ и почек. В литературном обзоре Cooper et al. [24] представили резюме по безопасности неселективных НПВП с 2011 г. Отмечено, что токсичность как в отношении ЖКТ, так и в отношении сердечно-сосудистой системы присуща всем НПВП [25]. Практически все НПВП потенциально могут вызывать острое повреждение почек, и коморбидные больные ОА с такими патологиями, как сахарный диабет 1 типа, артериальная
гипертензия и сердечная недостаточность, имеют увеличенный риск развития НЯ.
Curtis et al. представили систематический обзор и метаанализ ингибиторов циклооксигеназы 2 типа
(ЦОГ-2) [26]. Хотя ингибиторы ЦОГ-2 были созданы для того, чтобы избежать НЯ со стороны верхних отделов ЖКТ, результаты этого анализа показали наличие повышенного риска со стороны указанных отделов, особенно абдоминальной боли, у всех препаратов данного класса. Эти препараты ассоциируются с увеличением риска КВЗ. Даже при удалении из метаанализа рофекоксиба риск развития сердечной недостаточности и отеков остается значимым, поэтому предлагается осторожный подход к использованию НПВП и ингибиторов ЦОГ-2 при выборе лечения, с учетом индивидуальных характеристик пациента и ограничением длительности применения препаратов — интермиттирующего или курсового — для минимизации НЯ.
Внутрисуставное введение гиалуроновой кислоты (ГК) рекомендуется в случае наличия противопоказаний для приема НПВП, у пожилых больных с коморбидностью или у больных, не ответивших на проводившуюся ранее терапию [27]. Несмотря на возрастающее количество доказательств эффективности ГК, особенно при ОА коленных суставов, и широкое использование ГК в клинической практике, все еще обсуждается соотношение польза/риск применения этих препаратов. Данные систематического обзора и метаанализа Honvo et al. [28] не позволяют определенно высказаться в отношении безопасности ГК (только низко- и среднемолекулярной), поэтому требуется дальнейшее накопление данных.
Опиоиды рассматриваются только как фармакологическое лечение ОА при наличии очень интенсивной боли, когда нет ответа на другие методы лечения, когда уже возникает вопрос о хирургическом лечении [27]. Систематический обзор и метаанализ, проведенный Fuggle et al. [29], подтверждают безопасность использования опиоидов при ОА, но они ассоциируются с увеличенным риском развития НЯ со стороны ЖКТ, кожи и центральной нервной системы, поэтому опиоиды рекомендуется назначать при неэффективности всех других противоболевых методов и только на короткий период времени.
При неэффективности терапевтического лечения и ухудшении качества жизни проводится оперативное лечение.
Заключение
Таким образом, обновленный алгоритм лечения больных ОА на основании принципов доказательной медицины предлагает комплексный подход к лечению ОА, с помощью системы доказательств GRADE обосновывает необходимость назначения базисной терапии препаратами SYSADOA уже на первом этапе лечения, с пошаговым назначением лекарственных препаратов, что, безусловно, будет полезным для практикующих врачей.
Источник
