Лечение остеопороза у кроликов
Метаболизм представляет собой сложную систему получения из пищи и окружающей среды необходимых для полноценного развития и жизнедеятельности организма веществ, затем вывода непереваренных остатков пищи и невостребованных организмом продуктов обмена. Через пищеварительную систему организм получает белки, жиры, углеводы, витамины и соли – без этих элементов невозможна и жизнедеятельность. Нарушение обмена веществ в организме является причиной недостаточной усвояемости необходимых витаминов и минералов, их дефициту. Это сказывается на общем состоянии живого организма, может привести к развитию серьезных заболеваний.
Деформации костей и скелета
Несоблюдение правил составления рациона для кроликов, питание некачественными, неподходящими кормами может привести к дефициту кальция в организме кроликов. Сбой в фосфорно-кальциевом балансе, недостаток витаминов становятся причинами нарушения усвояемости кальция, что в свою очередь негативно сказывается на состоянии скелета, структуры кости.
Симптомы деформации костной ткани
Рахит, одна из разновидностей деформации кости, характерен для молодых крольчат в период развития организма и активного роста скелета. Наиболее частая причина возникновения заболевания – нарушение обмена веществ в организме или воспалительные процессы желудочно-кишечного тракта. Эти процессы в организме провоцируют дефицит кальция, его низкую усвояемость, что и становится причиной развития рахита в организме. Особое распространение болезнь получает в холодное время года, когда рацион грызунов становится менее разнообразным. Первые симптомы болезни костей у кроликов – ослабление аппетита, нарушение пищевых привычек, позывы у животного грызть несъедобные предметы – клетку или ее деревянную обшивку. Симптомы рахита у кроликов – утолщенные суставы на лапах, задержка в росте. Если рахит не выявить на ранней стадии, то симптомы заболевания усугубятся. Запущенная форма рахита выражается в деформации конечностей, на спине может образоваться горб. Заболевание воздействует и на нервную систему: поведение кролика характеризуется повышенной возбудимостью, иногда рахит провоцирует судороги.

У взрослых особей, особенно у самок в период беременности и кормления потомства, деминерализация костной ткани из-за нарушения обмена веществ в организме и несбалансированного питания проявляется в виде остеомаляции. У пожилых особей может наблюдаться размягчение костной ткани или остеопороз. Основной причиной развития этих болезней кроликов считается нехватка в организме витамина D, фосфора или нарушение усвояемости этих компонентов. Дефицит вызывает недостаточное насыщение костных тканей минералами, кальцием и фосфором. Причиной дисбаланса обычно выступает нарушение обмена веществ у кроликов. Результат развития заболевания в организме – изменение формы костей, состава костной ткани. Этот процесс приводит к частым переломам костей, их длительному срастанию.
Первые симптомы остеомаляции и остеопороза у кроликов:
- тусклый шерстяной покров;
- нарушение пищевого поведения, поедание навоза, подстилки;
- привычный корм представляет меньший интерес;
- повышенный тонус мышц.
С развитием заболевания у грызунов проявляется нарушение работы кишечника. Состояние подавленное, малоподвижное, могут наблюдаться судороги. Запущенная форма остеомаляции у кроликов выражается в деформации и истончении костей, частых переломах, потере веса, хромоте.
Если деформацию костей у кроликов вызывает дефицит солей и минералов в организме, то профилактику и лечение этих недугов следует начинать с коррекции питания грызунов. Развитие рахита, остеомаляции и остеопороза у кроликов может также спровоцировать нехватка солнечного света – именно под воздействием ультрафиолета в организме естественным путем происходит синтез витамина D. При первых признаках болезни костей у кроликов животных помещают в чистые просторные клетки, в которые беспрепятственно может проникать солнечный свет. В рацион следует добавить витаминные комплексы, в состав которых входят витамины A, D, E, например, тривитамин. Благотворно сказывается на состоянии больных рахитом и остеомаляцией кроликов добавление в пищу рыбьего жира, костной муки, минеральных солей, кальция, яичной муки, мела или фосфорноизвестковой соли (фосфорнокислой извести). Летом рацион кролика обогащается сеном и зеленью: люцерной, клевером, пыреем, а в холодное время года пророщенное зерно будет полезной добавкой к рациону. Лечению кроликов с деформацией костной ткани способствуют сеансы обработки клеток кварцевой лампой, 10-15 сеансов по 10-15 минут.
Кормовая свекла способствует вымыванию кальция из организма, поэтому объем свеклы в рационе стоит сократить, а переизбыток в рационе злаков (кукурузы, пшеницы, овса) вызывает пониженную усвояемость кальция.
Гиповитаминоз у кроликов
Дефицит витаминов в организме животного может стать следствием нарушения обмена веществ у кролика, неполного усвоения витаминов и минералов из пищи, несбалансированного рациона. Усугубляют ситуацию недавно перенесенные заболевания, беременность и лактация самок, заражения паразитами.
Симптомы дефицита витаминов у кроликов:
- вялость и малоподвижность;
- замедления темпов роста и развития у молодых особей;
- тусклая шерсть.
При недостатке витамина А у кролика могут наблюдаться конъюнктивит, сухость роговиц, ухудшение зрения, воспаление слизистых кишечника и нарушение его работы. К-гиповитаминоз понижает свертываемость крови. Дефицит витамина D снижает усвояемость кальция, что негативно сказывается на состоянии костей, провоцируя развитие таких болезней кроликов, как рахит, остеопороз и остеомаляция. Е-гиповитаминоз проявляется в снижении репродуктивной активности у кроликов, а у молодых особей нехватка витамина Е провоцирует сбои в работе коры головного мозга. Дефицит витамина В определяется по расстройствам нервной системы: судороги, параличи или конвульсии, а также проявляется в форме дерматитов, анемии или экзем. Диагностировать авитаминоз позволяет анализ крови животного, а также исследование кормовой базы.
Профилактика и лечение гиповитаминоза заключается в формировании полноценного рациона грызунов, в первую очередь следует внимательно отнестись к питанию беременных и кормящих самок, молодняка. Корм кролика должен быть разнообразным, обогащенным зеленью (клевер, люцерна, пырей, пророщенное зерно, дикорастущее разнотравье), бобовыми, корнеплодами и бахчевыми. Рацион грызунов должен быть дополнен витаминными и минеральными добавками промышленного производства.
Полезные для кроликов добавки:
- костная мука;
- рыбий жир;
- тривитамин;
- сухое молоко;
- витаминные концентраты;
- мел;
- пиридоксин;
- пищевые фосфаты.
Подошвенный дерматит у кроликов
Пододерматит – распространенная болезнь кроликов. Характеризуется потерей шерсти на задних лапах, которые в последствии могут усугубиться язвами и выделением из ран гноя. Проявляется подошвенный дерматит в затрудненных, болезненных передвижениях, у кролика пропадает аппетит. Если недуг запустить, то он может привести к истощению, заражению крови и летальному исходу.
Причины возникновения подошвенного дерматита:
- нарушение обмена веществ в организме;
- грубое напольное покрытие;
- избыточный вес;
- антисанитарные условия содержания.
Для начальной стадии заболевания характерно шелушение кожи и потеря шерсти на небольших участках кожи. Позднее на коже, пораженной дерматитом, появляются микротрещины, которые являются благотворной средой для размножения бактерий и грибков. Без необходимого на данном этапе лечения в ранах появляется гной, прилегающие к пораженным участкам ткани может поразить некроз. Следующий этап пододерматита – воспаление сухожилий и мышц, возможно заражение крови.
Профилактика подошвенного дерматита заключается в сбалансированном питании, богатом минералами и витаминами, особенно важно для предотвращения пододерматита добавлять в рацион кроликов витамин В. В клетках должен быть мягкий пол, чтобы исключить механические травмы конечностей у кроликов. Важно регулярно проводить уборку и дезинфекцию в клетках. Предотвращает пододерматит и своевременная подрезка ногтей.
На ранних этапах подошвенный дерматит лечится корректировкой рациона питания, сменой настила в клетках на более мягкий, регулярной уборкой в клетках. При появлении царапин и микротрещин на лапах рекомендуется промывать раны раствором фурацилина и накладывать на пораженные участки повязки с противомикробными мазями (левомеколь или левосин). Если началось воспаление тканей, необходима терапия антибиотиками, желательно в комплексе с препаратами, поддерживающими печень, пребиотиками для сохранения микрофлоры кишечника. Не стоит определять самому, какой антибиотик дать кролику и в какой дозировке. Такие решения должен принимать ветеринарный врач после осмотра животного, при необходимости забора соответствующих анализов.
Источник
Аннотация:
Изобретение относится к экспериментальной медицине, в частности к моделированию остеопороза для изучения состояний, связанных с остеопорозом, и особенностей клинического течения травм, лечения травм у пациентов с этим заболеванием. Моделирование проводят у кроликов путем односторонней овариоэктомии и введения через 3 дня после этого гидрокортизона. Инъекции гидрокортизона производят по схеме: 1, 14 день 0,1 мл (мг); 2, 3, 12, 13 дни — 0,2 мл (мг); 4-11 дни 0,3 мл (мг). Способ обеспечивает создание адекватной модели остеопороза при снижении летальности экспериментальных животных и проявлений синдрома отмены гормона. 2 ил.
Основные результаты:
Способ моделирования остеопороза у кролика в эксперименте путем овариоэктомии и введения глюкокортикоида, отличающийся тем, что кролику проводят одностороннюю овариоэктомию, а затем через 3 дня производят инъекции гидрокортизона по схеме: 1, 14 день — 0,1 мл (мг); 2, 3, 12, 13 дни — 0,2 мл (мг); 4-11 дни — 0,3 мл (мг).
Изобретение относится к области медицины (экспериментальной медицины), в частности, при изучении состояний, связанных с остеопорозом, особенностей клинического течения травм, лечения травм у пациентов с остеопорозом, когда необходимо создать модель остеопороза в эксперименте.
В проанализированной нами литературе описаны модели экспериментального остеопороза у животных. Для этого используется введение гидрокортизона [3, 4], удаление яичников [1, 2, 5]. Надо отметить, что применение глюкокортикоидов приводит к большому количеству летальных осложнений у животных. Связано это с несовершенством методики введения гормонов. Есть разработанные схемы применения гормонов у собак и крыс [3, 6]. Однако в экспериментальной медицине в качестве экспериментальных животных одними из наиболее широко используемых животных являются кролики. С рядом преимуществ, например меньшей степенью фенотипического полиморфизма, относительной простотой воспроизведения популяции, использование кроликов связано с большей их смертностью ввиду худшей, по сравнению с крупными животными, переносимостью медикаментозных и хирургических вмешательств. Так, при применении больших доз глюкокортикоидов летальность лабораторных животных была неприемлемо высокой. Более выигрышными представляются модели, в которых используется комбинация удаления яичников и применения глюкокортикоидов [7]. Такая комбинация методов позволила авторам снизить дозу глюкокортикоидов и, следовательно, негативные последствия их применения. Дальнейшее совершенствование методов достижения остеопороза возможно по пути снижения инвазии, для получения остеопороза при меньшем количестве летальных исходов, а также осложнений, не позволяющих сразу включать животного в исследование. Техническим результатом является методика, позволяющая снизить летальность экспериментальных животных, получив при этом модель остеопороза, годную для изучения данной патологии, например для изучения особенностей проведения операций и послеоперационного ведения в условиях остеопороза, а также для изучения особенностей действия медикаментов в условиях остеопороза. Это возможно при снижении «агрессивности» вмешательств, направленных на стимуляцию остеопороза у кроликов, что позволяет снизить экстремальное влияние стероидных гормонов и предупредить синдром отмены. Результат достигается путем сочетания различных методов воздействия с разнесением их во времени и постепенного наращивания дозы медикаментозного вмешательства, т.е. кролику проводят одностороннюю овариоэктомию, а затем через 3 дня производят инъекции гидрокортизона по схеме: 1, 14 день 0,1 мл (мг); 2, 3, 12, 13 дни — 0,2 мл (мг); 4-11 дни 0,3 мл (мг).
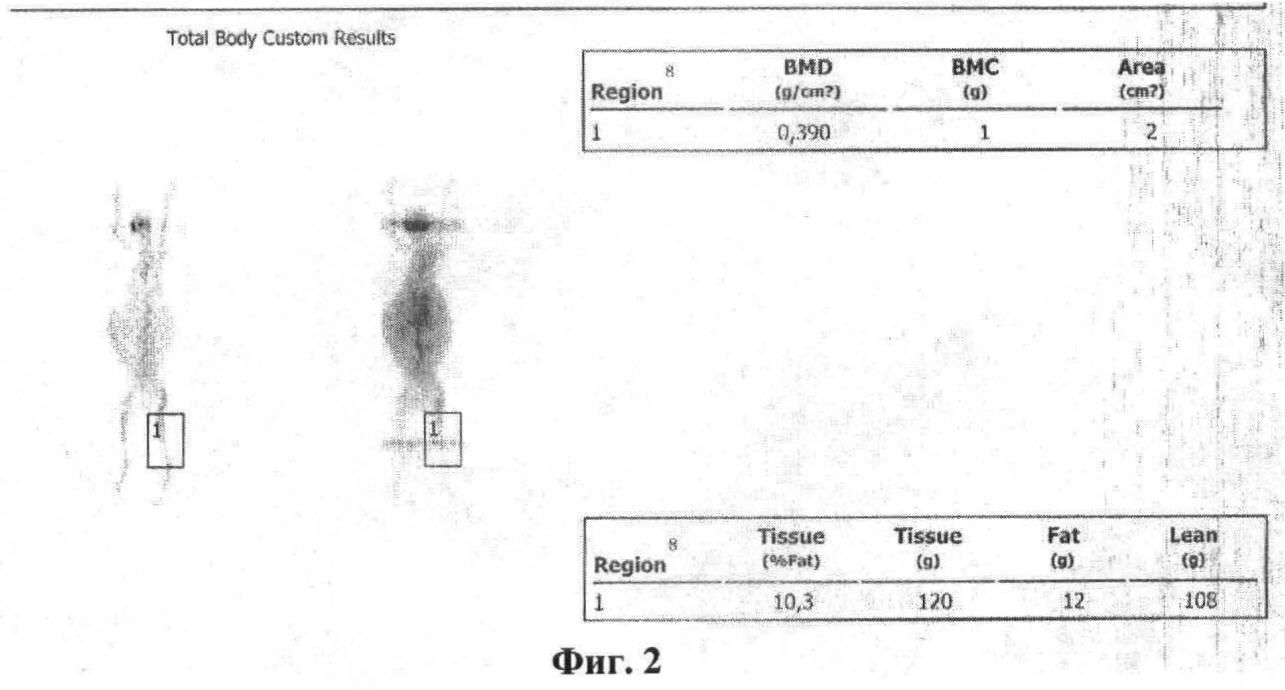
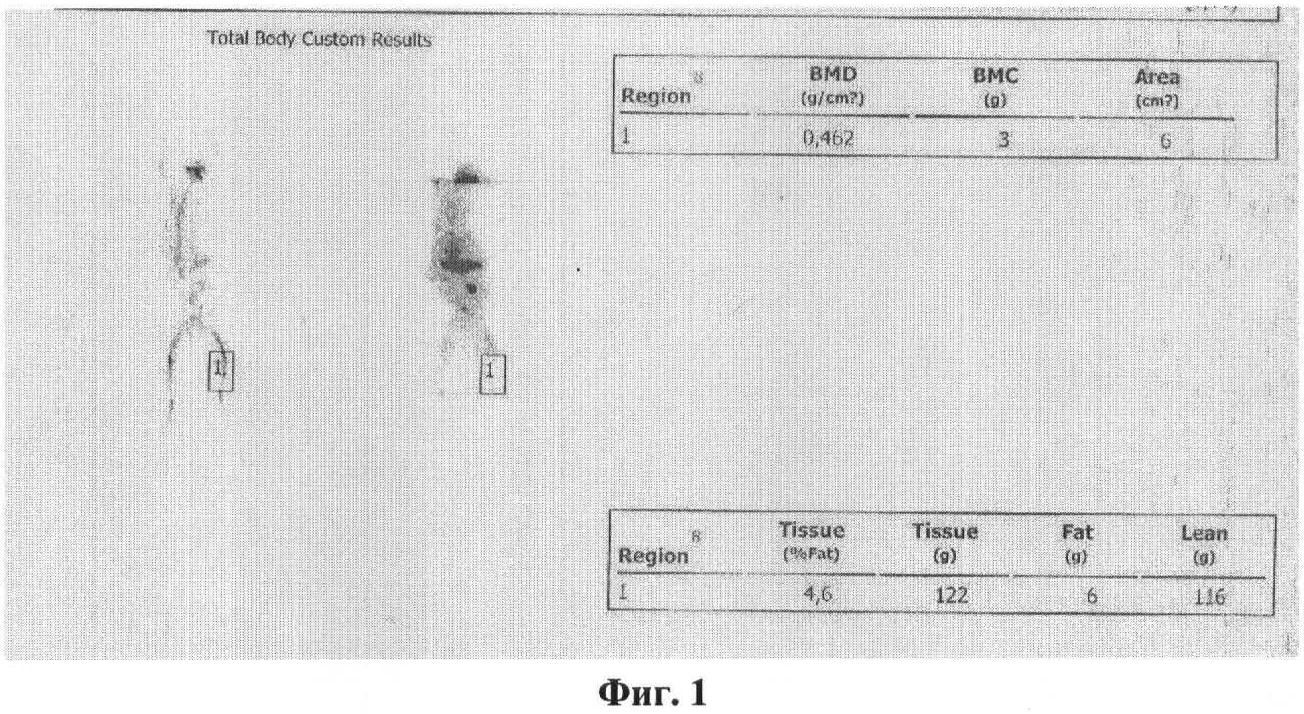
На фигурах изображены: сканы с бланков результатов рентгеновской денситометрии (выполнена для контроля формирования остеопороза).
Фигура 1: результаты рентгеновской денситометрии лапки кролика до воздействия.
Фигура 2: результаты рентгеновской денситометрии лапки кролика после воздействия.
Способ осуществляется следующим образом: самкам кроликов породы «шиншилла» весом 2,5-3,5 кг проводили одностороннюю овариоэктомию, через 3 дня производили инъекции гидрокортизона по следующей схеме:
1, 14 день 0,1 мл (мг)
2, 3, 12, 13 дни — 0,2 мл (мг)
4-11 дни 0,3 мл (мг)
Наступление остеопороза контролировали при помощи рентгеновской денситометрии (см. фигуры 1, 2).
По цифровым показателям индекса BMD видно, что удалось достичь снижения минеральной плотности костной ткани в результате воздействия. Информативность графической части отображения результатов исследования потеряна при цифровой обработке скана.
Нами была проведена серия опытов с целью изучения влияния антиостеопоротического препарата Бивалос на дистракционный регенерат. При этом группе кроликов n=48 предварительно сформирован экспериментальный остеопороз. Далее животные поделены на опытную и контрольную группы в зависимости от наличия в терапии препарата. На предварительной фазе эксперимента по описанной выше методике нам удалось добиться значимого снижения минеральной плотности костной ткани у всех животных. При этом отмечено 2 летальных исхода в послеоперационном периоде на фоне терапии гидрокортизоном (эти животные были исключены из исследования и заменены 2 другими особями, успешно перенесшими одностороннюю овариоэктомию и терапию глюкокортикоидами).
Список использованной литературы
1. Салеева Г.Т. РЕНТГЕНОСТРУКТУРНЫЙ АНАЛИЗ ПЕРИИМПЛАНТАТНОЙ ЗОНЫ // Маэстро. — 2003. — № 2. — С.51-52.
2. Валеева И.Х., Киясов А.П., Орлов С.Б., Салеева Г.Т., Титова М.А. С-КЛЕТКИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ОСТЕОПОРОЗЕ // Морфология. — 2003. — № 2. — С.68-72.
3. Зиганшин А.У., Зиганшина Л.Е., Бурнашова З.А., Валеева И.Х. ВЛИЯНИЕ ДИМЕФОСФОНА И КСИДИФОНА НА ПОКАЗАТЕЛИ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ И АНТИОКСИДАНТНОЙ СИСТЕМЫ КРЫС, ДЛИТЕЛЬНО ПОЛУЧАВШИХ ПРЕДНИЗОЛОН // Экспериментальная и клиническая фармакология. — 2002. — № 2. — C.40-43.
4. Кропотов А.В., Колодняк О.Л., Колдаев В.М. ВЛИЯНИЕ ЭКСТРАКТА ЭЛЕУТЕРОКОККА И ИПРИФЛАВОНА НА РАЗВИТИЕ ГЛЮКОКОРТИКОИДНОГО ОСТЕОПОРОЗА // Бюллетень экспериментальной биологии и медицины. — 2002. — № 3. — С.295-297.
5. Файтельсон А.В., Дубровин Г.М., Гудырев О.С., Покровский М.В., Иванов А.В. ФАРМАКОЛОГИЧЕСКАЯ КОРРЕКЦИЯ ЭКСПЕРИМЕНТАЛЬНОГО ОСТЕОПОРОЗА И ПЕРЕЛОМОВ НА ЕГО ФОНЕ // Вестник травматологии и ортопедии им. Н.Н.Приорова. — 2010. — №3.
6. Якупов P.P., Рахматуллин С.И. ЭКСПЕРИМЕНТАЛЬНЫЙ ОСТЕОПОРОЗ У КРЫС // Бюллетень Восточно-Сибирского научного центра СО РАМН. — 2009. — №1. — С.290-292.
7. Castaneda S., Calvo E., Largo R., Gonzalez-Gonzalez R., de la Piedra C., Diaz-Curiel M., Herrero-Beaumont G. CHARACTERIZATION OF A NEW EXPERIMENTAL MODEL OF OSTEOPOROSIS IN RABBITS // J. Bone Miner. Metab. — 2008. — №26(1). — P.53-59.
Способ моделирования остеопороза у кролика в эксперименте путем овариоэктомии и введения глюкокортикоида, отличающийся тем, что кролику проводят одностороннюю овариоэктомию, а затем через 3 дня производят инъекции гидрокортизона по схеме: 1, 14 день — 0,1 мл (мг); 2, 3, 12, 13 дни — 0,2 мл (мг); 4-11 дни — 0,3 мл (мг).

Источник
Аннотация:
Изобретение относится к экспериментальной медицине, в частности к моделированию остеопороза для изучения состояний, связанных с остеопорозом, и особенностей клинического течения травм, лечения травм у пациентов с этим заболеванием. Моделирование проводят у кроликов путем односторонней овариоэктомии и введения через 3 дня после этого гидрокортизона. Инъекции гидрокортизона производят по схеме: 1, 14 день 0,1 мл (мг); 2, 3, 12, 13 дни — 0,2 мл (мг); 4-11 дни 0,3 мл (мг). Способ обеспечивает создание адекватной модели остеопороза при снижении летальности экспериментальных животных и проявлений синдрома отмены гормона. 2 ил.
Основные результаты:
Способ моделирования остеопороза у кролика в эксперименте путем овариоэктомии и введения глюкокортикоида, отличающийся тем, что кролику проводят одностороннюю овариоэктомию, а затем через 3 дня производят инъекции гидрокортизона по схеме: 1, 14 день — 0,1 мл (мг); 2, 3, 12, 13 дни — 0,2 мл (мг); 4-11 дни — 0,3 мл (мг).
Изобретение относится к области медицины (экспериментальной медицины), в частности, при изучении состояний, связанных с остеопорозом, особенностей клинического течения травм, лечения травм у пациентов с остеопорозом, когда необходимо создать модель остеопороза в эксперименте.
В проанализированной нами литературе описаны модели экспериментального остеопороза у животных. Для этого используется введение гидрокортизона [3, 4], удаление яичников [1, 2, 5]. Надо отметить, что применение глюкокортикоидов приводит к большому количеству летальных осложнений у животных. Связано это с несовершенством методики введения гормонов. Есть разработанные схемы применения гормонов у собак и крыс [3, 6]. Однако в экспериментальной медицине в качестве экспериментальных животных одними из наиболее широко используемых животных являются кролики. С рядом преимуществ, например меньшей степенью фенотипического полиморфизма, относительной простотой воспроизведения популяции, использование кроликов связано с большей их смертностью ввиду худшей, по сравнению с крупными животными, переносимостью медикаментозных и хирургических вмешательств. Так, при применении больших доз глюкокортикоидов летальность лабораторных животных была неприемлемо высокой. Более выигрышными представляются модели, в которых используется комбинация удаления яичников и применения глюкокортикоидов [7]. Такая комбинация методов позволила авторам снизить дозу глюкокортикоидов и, следовательно, негативные последствия их применения. Дальнейшее совершенствование методов достижения остеопороза возможно по пути снижения инвазии, для получения остеопороза при меньшем количестве летальных исходов, а также осложнений, не позволяющих сразу включать животного в исследование. Техническим результатом является методика, позволяющая снизить летальность экспериментальных животных, получив при этом модель остеопороза, годную для изучения данной патологии, например для изучения особенностей проведения операций и послеоперационного ведения в условиях остеопороза, а также для изучения особенностей действия медикаментов в условиях остеопороза. Это возможно при снижении «агрессивности» вмешательств, направленных на стимуляцию остеопороза у кроликов, что позволяет снизить экстремальное влияние стероидных гормонов и предупредить синдром отмены. Результат достигается путем сочетания различных методов воздействия с разнесением их во времени и постепенного наращивания дозы медикаментозного вмешательства, т.е. кролику проводят одностороннюю овариоэктомию, а затем через 3 дня производят инъекции гидрокортизона по схеме: 1, 14 день 0,1 мл (мг); 2, 3, 12, 13 дни — 0,2 мл (мг); 4-11 дни 0,3 мл (мг).
На фигурах изображены: сканы с бланков результатов рентгеновской денситометрии (выполнена для контроля формирования остеопороза).
Фигура 1: результаты рентгеновской денситометрии лапки кролика до воздействия.
Фигура 2: результаты рентгеновской денситометрии лапки кролика после воздействия.
Способ осуществляется следующим образом: самкам кроликов породы «шиншилла» весом 2,5-3,5 кг проводили одностороннюю овариоэктомию, через 3 дня производили инъекции гидрокортизона по следующей схеме:
1, 14 день 0,1 мл (мг)
2, 3, 12, 13 дни — 0,2 мл (мг)
4-11 дни 0,3 мл (мг)
Наступление остеопороза контролировали при помощи рентгеновской денситометрии (см. фигуры 1, 2).
По цифровым показателям индекса BMD видно, что удалось достичь снижения минеральной плотности костной ткани в результате воздействия. Информативность графической части отображения результатов исследования потеряна при цифровой обработке скана.
Нами была проведена серия опытов с целью изучения влияния антиостеопоротического препарата Бивалос на дистракционный регенерат. При этом группе кроликов n=48 предварительно сформирован экспериментальный остеопороз. Далее животные поделены на опытную и контрольную группы в зависимости от наличия в терапии препарата. На предварительной фазе эксперимента по описанной выше методике нам удалось добиться значимого снижения минеральной плотности костной ткани у всех животных. При этом отмечено 2 летальных исхода в послеоперационном периоде на фоне терапии гидрокортизоном (эти животные были исключены из исследования и заменены 2 другими особями, успешно перенесшими одностороннюю овариоэктомию и терапию глюкокортикоидами).
Список использованной литературы
1. Салеева Г.Т. РЕНТГЕНОСТРУКТУРНЫЙ АНАЛИЗ ПЕРИИМПЛАНТАТНОЙ ЗОНЫ // Маэстро. — 2003. — № 2. — С.51-52.
2. Валеева И.Х., Киясов А.П., Орлов С.Б., Салеева Г.Т., Титова М.А. С-КЛЕТКИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ОСТЕОПОРОЗЕ // Морфология. — 2003. — № 2. — С.68-72.
3. Зиганшин А.У., Зиганшина Л.Е., Бурнашова З.А., Валеева И.Х. ВЛИЯНИЕ ДИМЕФОСФОНА И КСИДИФОНА НА ПОКАЗАТЕЛИ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ И АНТИОКСИДАНТНОЙ СИСТЕМЫ КРЫС, ДЛИТЕЛЬНО ПОЛУЧАВШИХ ПРЕДНИЗОЛОН // Экспериментальная и клиническая фармакология. — 2002. — № 2. — C.40-43.
4. Кропотов А.В., Колодняк О.Л., Колдаев В.М. ВЛИЯНИЕ ЭКСТРАКТА ЭЛЕУТЕРОКОККА И ИПРИФЛАВОНА НА РАЗВИТИЕ ГЛЮКОКОРТИКОИДНОГО ОСТЕОПОРОЗА // Бюллетень экспериментальной биологии и медицины. — 2002. — № 3. — С.295-297.
5. Файтельсон А.В., Дубровин Г.М., Гудырев О.С., Покровский М.В., Иванов А.В. ФАРМАКОЛОГИЧЕСКАЯ КОРРЕКЦИЯ ЭКСПЕРИМЕНТАЛЬНОГО ОСТЕОПОРОЗА И ПЕРЕЛОМОВ НА ЕГО ФОНЕ // Вестник травматологии и ортопедии им. Н.Н.Приорова. — 2010. — №3.
6. Якупов P.P., Рахматуллин С.И. ЭКСПЕРИМЕНТАЛЬНЫЙ ОСТЕОПОРОЗ У КРЫС // Бюллетень Восточно-Сибирского научного центра СО РАМН. — 2009. — №1. — С.290-292.
7. Castaneda S., Calvo E., Largo R., Gonzalez-Gonzalez R., de la Piedra C., Diaz-Curiel M., Herrero-Beaumont G. CHARACTERIZATION OF A NEW EXPERIMENTAL MODEL OF OSTEOPOROSIS IN RABBITS // J. Bone Miner. Metab. — 2008. — №26(1). — P.53-59.
Способ моделирования остеопороза у кролика в эксперименте путем овариоэктомии и введения глюкокортикоида, отличающийся тем, что кролику проводят одностороннюю овариоэктомию, а затем через 3 дня производят инъекции гидрокортизона по схеме: 1, 14 день — 0,1 мл (мг); 2, 3, 12, 13 дни — 0,2 мл (мг); 4-11 дни — 0,3 мл (мг).


Источник
