Миозит при ревматоидном артрите
Мышцы поражаются у большинства больных РА. Мышечная слабость и атрофия отмечаются не менее чем у 75% больных. Причиной этих симптомов служит уменьшение мышечной активности в связи с болью в суставах и особенно их контрактурами. Эта причина, однако, не может считаться единственной. Еще в 1873 г. J. Paget писал, что мышечная атрофия при РА пропорциональна не столько ограничению движений, сколько выраженности боли.
Спустя почти столетие J. De Andrade (1968) доказал в эксперименте, что атрофия мышц у животных с артритами выражена сильнее, чем вызванная иммобилизацией. О том же свидетельствуют частые клинические наблюдения, касающиеся быстро развивающейся амиотрофии при тяжелом РА. Темпы ее развития при этом более быстрые, чем при обычной иммобилизации, тем более что в подобных случаях общий объем движений часто остается немалым.
Поэтому основными причинами мышечной патологии у больных РА следует считать как ограничение мускульной активности, так и катаболическое влияние воспалительного процесса (возможно, опосредуемое эффектом интерлейкина-1 и фактором некроза опухоли, вырабатываемых макрофагами). Последнее может значительно усугубляться сопутствующей лихорадкой, частым ухудшением аппетита, нерациональным питанием (в частности, бедным белками).
Несомненно, что у ряда больных возникает и собственно ревматоидный миозит, имеющий, однако, в большинстве подобных случаев весьма малое клиническое значение. Для его диагностики определяющую роль играет сочетание мышечных самостоятельных болей (особенно в сочетании с болью при пальпации соответствующих мышц), нарастание в крови уровня «мышечных» ферментов (трансаминаз, альдолазы и особенно креатинфосфокиназы) и воспалительных изменений при гистологическом исследовании мышечных биоптатов.
Трактовка данных биопсий вне связи с клиническими и биохимическими показателями должна быть очень осторожной. Микроскопический анализ мышечной ткани нередко обнаруживает сосудистые изменения и клеточные инфильтраты, формально соответствующие представлениям о воспалении, у лиц без какой-либо мышечной патологии. Возможно, что речь идет о реакции на транзиторные физиологические сдвиги (большее накопление молочной кислоты и т. д.).
Не подтвердилось также мнение об относительной специфичности для РА так называемого узелкового полимиозита, представляющего собой узелковые клеточные инфильтраты диаметром 1—2 мм, обильно рассеянные в эндомизии и перимизии и состоящие из скоплений лимфоцитов и плазматических клеток, в редких случаях — тучных клеток, нейтрофилов и эозинофилов. L. Sokoloff и соавт. (1950) показали, что подобные изменения наблюдались у 56% больных РА, у 29% больных неревматическими заболеваниями и у 23% здоровых.
Повышение уровня мышечных ферментов в крови имеет большое значение для диагноза ревматоидного миозита. Однако необходимо принимать во внимание, что содержание этих ферментов у больных РА может повыситься также вследствие внутримышечных инъекций, мышечной биопсии, индивидуальных реакций на некоторые лекарства (хлорохин, ацетилсалициловая кислота, D-пеницилламин) и даже значительной физической нагрузки. В связи с этим диагностика ревматоидного миозита надежна лишь при сочетании клинических симптомов с ферментемией и гистологическими воспалительными изменениями или (что менее убедительно) при комбинировании двух компонентов этой триады.
Четко очерченный синдром миозита у больных РА редок. Относительно чаще он встречается при ревматоидном васкулите, однако и в этих случаях (при локализации васкулита в мышцах) его клиническое значение обычно невелико. Поэтому особый интерес вызывает наблюдение Г. Н. Жуковской (1987) больного классическим серопозитивным и эрозивным РА (без васкулита), у которого миозит в течение длительного времени настолько превалировал над суставными проявлениями, что правильный диагноз был поставлен более чем через год.
Необходимо иметь в виду, что заметная мышечная патология у больных РА в редких случаях может быть связана с влиянием некоторых лекарств. Так, глюкокортикостероиды (прежде всего содержащие фтор — триамцинолон, дексаметазон), особенно при их длительном назначении в больших дозах, вызывают у отдельных больных так называемую стероидную миопатию. Ее симптомы обычно развиваются постепенно и относятся преимущественно к проксимальным мышцам ног, а затем и рук (боли, быстрая утомляемость, затруднения при подъеме на лестницу и при вставании с низкого стула).
Эти симптомы нередко оцениваются как признаки обострения основного заболевания, что ведет к увеличению дозы стероидов и тем самым к усугублению миопатических проявлений. Уровень сывороточных мышечных ферментов при стероидной миопатии нормален. Ценный лабораторный признак — повышенное выделение креатина с мочой. При гистологическом исследовании мышц не обнаруживают достоверных воспалительных изменений; отмечаются лишь неспецифические дистрофические симптомы — потеря поперечной исчерченности, атрофия волокон и т. д. После уменьшения дозы гормональных препаратов и особенно полной отмены их признаки стероидной миопатии исчезают, чему способствует лечебная физкультура, направленная на упражнения для соответствующих мышц.
Назначение D-пеницилламина у некоторых больных может вызвать патологию мышц двух различных типов. Относительно чаще встречается синдром миастении (myasthenia gravis). Он проявляется в постепенном нарастании слабости различных мышечных групп с соответствующими функциональными нарушениями (слабость, утомляемость, диплопия, нарушения глотания и речи, птоз, затруднения при выполнении простых движений).
Повышения уровня мышечных ферментов в крови и гистологической картины миозита не наблюдается. У некоторых больных . определяются антитела к тканевым компонентам мышечных поперечных полос и к ацетилхолиновым рецепторам мышц (последнее обстоятельство может быть непосредственной причиной мышечной слабости). После отмены D-пеницилламина симптомы миастении постепенно исчезают; при недостаточном восстановлении мышечной силы назначают прозерин.
У единичных больных при назначении D-пеницилламина описано развитие истинного полимиозита с миалгиями, слабостью проксимальных мышц конечностей, нарастанием уровня мышечных ферментов и характерной гистологической картиной (инфильтрация лимфоцитами и макрофагами, участки дегенерации и регенерации мышечных волокон). Для лечения этого осложнения необходимо отменить D-пеницилламин, в серьезных случаях — назначить глюкокортикостероиды.
Хлорохиновая миопатия также представляет собой очень редкое лекарственное осложнение. Она характеризуется постепенно прогрессирующей слабостью проксимальных мышц ног, затем — рук, позже — более дистальных мышечных групп. Уровень мышечных ферментов в крови может быть повышен. Характерный гистологический признак — вакуолизация мышечных волокон. Отмена хлорохина приводит к полному, но медленному выздоровлению.
Назначение гидроксихлорохина (плаквенила) не вызывает миопатии. Таким образом, в основе изменений мышц при РА могут лежать принципиально различные причины: миозит, атрофия вследствие недостаточных упражнений, вызванные воспалительным процессом катаболические сдвиги в обмене веществ, недостаточное белковое питание и, наконец, редкие и сугубо индивидуальные (возможно, генетически обусловленные) реакции на определенные лекарственные препараты.
Поэтому в каждом конкретном случае явной мышечной патологии у больного РА необходим соответствующий клинический и анамнестический анализ с определением в крови уровня мышечных ферментов; по показаниям проводят биопсию наиболее пораженных отделов мышц.
Сигидин Я.А.
Опубликовал Константин Моканов
Источник
Что такое аутоиммунный миозит?
Аутоиммунный миозит — это группа аутоиммунных ревматических заболеваний, которые вызывают воспаление и слабость мышц (полимиозит) или кожи и мышц (дерматомиозит).
Эти заболевания приводят к воспалению мышц (миозит), мышечной слабости, обусловливающей потерю трудоспособности, и иногда болезненности. Слабость обычно наблюдается в плечах и бедрах, но также может поражать симметричные мышцы тела.
Причины аутоиммунного миозита
Аутоиммунный миозит обычно развивается у взрослых в возрасте от 40 до 60 лет, либо у детей в возрасте от 5 до 15 лет.
Вероятность его развития у женщин в два раза выше, чем у мужчин. У взрослых заболевание может возникать независимо либо в комплексе болезней соединительной ткани, например, при смешанном заболевании соединительной ткани, системной красной волчанке или системном склерозе.
Причина аутоиммунного миозита не установлена. В развитии заболевания могут принимать участие вирусы или аутоиммунные реакции. Онкологические заболевания также могут вызывать это расстройство. Не исключено, что иммунный ответ, направленный против злокачественной опухоли, может также быть направлен на компоненты мышечной ткани. Эта болезнь может быть наследственной.
Различают четыре типа аутоиммунного миозита:
- Полимиозит.
- Дерматомиозит.
- Некротизирующие иммуноопосредованные миопатии.
- Миозит с включениями.
Дерматомиозит обычно вызывает изменения кожи, которых не бывает при полимиозите, что помогает в дифференциальной диагностике обоих заболеваний. Образцы ткани мышц, полученные при биопсии, также выглядят по-разному под микроскопом.
Некротизирующие иммуноопосредованные миопатии — это заболевания, при которых происходит гибель мышечных клеток (миоцитов), но не поражаются другие ткани, кроме мышечной.
Миозит с включениями представляет собой отдельное заболевание, симптомы которого похожи на симптомы хронического полимиозита неизвестной этиологии. Однако это заболевание развивается у пожилых лиц, часто поражает другие мышцы (например, мышцы кистей и стоп), имеет более длительное течение, плохо отвечает на лечение, а мышцы имеют другой вид под микроскопом.
Симптомы и признаки

Симптомы аутоиммунного миозита аналогичны у людей всех возрастов, однако оказалось, что воспаление мышц у детей часто развивается более внезапно, чем у взрослых. Симптомы, которые могут начаться во время инфекции или непосредственно после нее, включают:
- симметричную мышечную слабость (особенно в верхней части рук, бедер и голеней);
- боль в суставах (хотя чаще наблюдается незначительная мышечная боль);
- затруднения при глотании;
- жар;
- утомляемость и снижение массы тела.
Также может возникать феномен Рейно, для которого характерно внезапное побледнение пальцев и ощущение покалывания в них, либо онемение в ответ на воздействие холода или эмоциональное расстройство.
Мышечная слабость может развиваться медленно или внезапно, с постепенным усугублением в течение недель или месяцев. В связи с тем, что поражение в первую очередь затрагивает мышцы вблизи центра тела, возможны серьезные трудности с такими движениями, как поднятие руки выше уровня плеч, движение вверх по ступенькам и подъем с кресла или сиденья унитаза. При поражении мышц шеи может стать невозможным даже подъем головы с подушки. Лицам со слабостью плечевых или бедренных мышц может потребоваться использование инвалидного кресла или постоянный постельный режим. Повреждение мышц верхней части пищевода может приводить к трудностям с глотанием и регургитации пищи. При этом поражения мышц кистей, стоп и лица обычно не происходит.
Боль и воспаление в суставах присутствует приблизительно у 30 % больных. Боль и отек преимущественно незначительны.
Внутренние органы обычно не затрагиваются, кроме горла и пищевода. Однако не исключено поражение легких и сердца, приводящее к нарушениям сердечного ритма (аритмии), одышке и кашлю. Симптомы повреждения желудочно-кишечного тракта, которые могут наблюдаться у детей, но обычно отсутствуют у взрослых, вызваны воспалением кровеносных сосудов (васкулитом). Такие симптомы могут включать кровавую рвоту, черный, дегтеобразный стул и сильную боль в животе, в ряде случаев с образованием отверстия (перфорации) во внутренней оболочке кишечника.
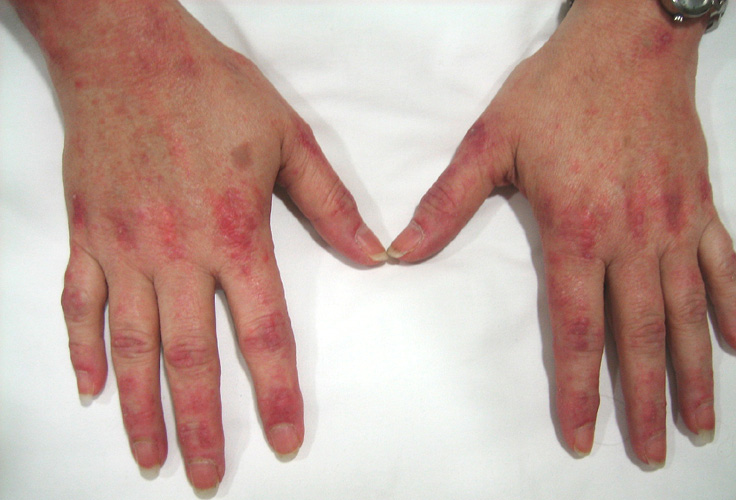
У лиц с дерматомиозитом возникают кожные изменения. Как правило, одновременно с мышечной слабостью и другими симптомами появляется сыпь. Темная или лиловая сыпь появляется на коже лица, с красноватой лиловой отечностью вокруг глаз (симптом «фиолетовых очков»). Сыпь может быть выпуклой и шелушащейся и наблюдаться почти на любом участке кожи, но чаще всего встречается на костяшках пальцев, локтях, коленях, на наружной стороне верхней части бедер и частично на кистях рук и стоп. Возможно покраснение и уплотнение кожи вокруг ногтей.
Когда сыпь сходит, на коже может возникать буроватая пигментация, рубцевание, сморщивание или депигментированные бледные пятна. Сыпь на коже волосистой части головы может напоминать псориаз и сильно зудеть. Также наблюдается чувствительность к солнечному свету и язвы на коже. Под кожей или в мышечной ткани, особенно у детей, могут возникать бугорки вследствие отложения кальция. Приподнятые красноватые бугорки могут появляться в области пястно-фаланговых суставов (так называемые папулы Готтрона), а иногда и в области межфаланговых суставов.
Иногда эти характерные кожные изменения наблюдаются при отсутствии мышечной слабости и воспаления. В этом случае заболевание называется амиопатическим дерматомиозитом.
Диагностика
Для диагностики аутоиммунного миозита используются следующие критерии:
- мышечная слабость в плечах или бедрах и голенях;
- иногда характерная сыпь;
- повышенные уровни в крови определенных ферментов мышечной ткани (особенно креатинкиназы), что указывает на повреждение мышц;
- патологические изменения электрической активности мышц по результатам электромиографии или изменения во внешнем виде мышц на снимках, полученных с помощью магнитно-резонансной томографии (МРТ);
- характерные изменения в мышечной ткани, обнаруженные при биопсии и наблюдаемые под микроскопом (наиболее достоверное подтверждение).
Биопсия мышц назначается часто и является самым надежным способом диагностики аутоиммунного миозита, особенно в сомнительных случаях. Другие лабораторные обследования не могут однозначно идентифицировать аутоиммунный миозит, но могут помочь исключить другие нарушения, обнаружить риск осложнений и определить степень тяжести заболевания.
Анализы крови проводятся для измерения уровней антинуклеарных антител (АНА) и других антител, которые присутствуют у большинства лиц с аутоиммунным миозитом. Хотя результаты анализов крови могут помочь диагностировать аутоиммунный миозит, сами по себе они не могут служить подтверждением диагноза аутоиммунного миозита, поскольку обнаруженные с их помощью аномалии иногда присутствуют у здоровых людей или у лиц с другими заболеваниями. Диагноз аутоиммунного миозита устанавливается на основании всей собранной врачом информации, включая симптомы, результаты физикального обследования и результаты всех обследований.
МРТ также может помочь выбрать участок для биопсии. Чтобы исключить другие заболевания мышц, отбирают образцы мышечной ткани для выполнения специфических исследований.
Врачи часто назначают скрининг на онкологические заболевания среди людей в возрасте 40 лет и старше, страдающих дерматомиозитом, или среди людей в возрасте 60 лет и старше, страдающих полимиозитом, поскольку у таких больных возможно наличие скрытых злокачественных опухолей.
Лечение аутоиммунного миозита

Часто на состоянии больных благоприятно сказывается умеренное ограничение физической деятельности в периоды наиболее сильных проявлений воспаления мышц.
Как правило, назначается преднизон (кортикостероидный препарат) для приема внутрь в высоких дозах. Этот препарат приводит к медленному повышению силы мышц, снимает боль и отек, обеспечивая контроль заболевания. Лицам с тяжелым заболеванием с затруднениями при глотании или слабостью дыхательных мышц назначают внутривенные кортикостероиды, такие как метилпреднизолон. Многие взрослые больные вынуждены продолжать прием преднизона в низких дозах либо альтернативного лекарственного препарата в течение многих лет или даже неопределенного срока, для профилактики рецидива.
С целью контроля ответа заболевания на лечение кортикостероидами врачи периодически назначают анализ крови для определения уровней мышечных ферментов. Уровни обычно снижаются до нормальных или почти нормальных, а мышечная сила возвращается через 6-12 недель. МРТ также может выявить участки воспаления, что дает врачу возможность определить ответ заболевания на назначенное лечение. Как только уровни ферментов вернутся к норме, дозу преднизона можно постепенно снижать. При повышении уровней мышечных ферментов доза увеличивается.
Хотя при лечении больных с аутоиммунным миозитом кортикостероиды обычно назначаются в первую очередь, эти препараты вызывают побочные эффекты (например, высокий уровень сахара в крови, перепады настроения, катаракта, риск переломов и глаукомы), особенно при назначении в высоких дозах и на длительный срок. Поэтому для уменьшения срока использования кортикостероидов и минимизации побочных эффектов в дополнение к преднизону можно назначать иммунодепрессанты (такие как метотрексат, такролимус, азатиоприн, микофенолата мофетил, ритуксимаб или циклоспорин). В качестве еще одного метода лечения может назначаться иммуноглобулин (вещество, содержащее различные антитела в больших количествах) для введения в вену (внутривенно). Некоторые больные получают комбинацию кортикостероидов, иммунодепрессантов и иммуноглобулина.
Если мышечная слабость обусловлена злокачественной опухолью, ответ на лечение преднизоном, как правило, незначителен. Однако тяжесть такого состояния обычно облегчается, если есть возможность эффективного лечения злокачественной опухоли.
У больных, получающих кортикостероиды, возрастает опасность переломов вследствие остеопороза. Для предотвращения остеопороза таким больным назначают препараты, используемые для лечения остеопороза, например, бисфосфонаты, пищевые добавки витамина D и кальция. Больным, получающим иммунодепрессанты, также назначают препараты для профилактики инфекций, вызванных такими грибами, как Pneumocystis jirovecii.
Больные аутоиммунным миозитом входят в группу повышенного риска развития атеросклероза и находятся под тщательным наблюдением врача.
Прогноз
До 50% больных (особенно детей), получивших лечение в течение 5 лет после установления диагноза, часто достигают длительного периода бессимптомного течения (ремиссия), а некоторые могут даже полностью выздороветь. Однако в любое время возможен возврат (рецидив) заболевания. После постановки диагноза продолжительность жизни приблизительно 75 % пациентов составляет минимум 5 лет. Этот показатель еще выше среди больных детского возраста.
У взрослых больных повышается риск смерти вследствие тяжелой и прогрессирующей мышечной слабости, затруднений при глотании, недостаточного питания, вдыхания пищи с последующим развитием пневмонии (аспирационная пневмония) или дыхательной недостаточности, которая часто развивается одновременно с пневмонией.
У детей, имеющих ювенильную форму дерматомиозита, может развиться тяжелое воспаление кровеносных сосудов (васкулит), кровоснабжающих кишечник, которое при отсутствии лечения в конечном итоге может привести к перфорации кишечника.
Течение полимиозита характеризуется большей тяжестью и резистентностью к лечению среди больных с поражениями сердца и легких. Полимиозит и, особенно, дерматомиозит, связаны с повышением риска развития онкологических заболеваний. У больных злокачественными заболеваниями основной причиной смертности является опухоль, а не аутоиммунный миозит.
Источник
