Может ли хеликобактер вызывать артрит
Представлены результаты исследования частоты инфицированности и оценки эффективности альтернативной схемы эрадикационной терапии Helicobacter pylori у больных ревматическими заболеваниями
Helicobacter pylori (H. pylori) – самая распространенная инфекция человека: не менее половины жителей Земли являются носителями этой бактерии. Взаимодействие H. pylori и иммунной системы формирует широкий спектр биологических реакций, от относительно спокойного сосуществования микро- и макроорганизма до выраженного воспалительного процесса и серьезных аутоиммунных нарушений. Эта бактерия известна как основной этиологический фактор хронического гастрита, язвы желудка и двенадцатиперстной кишки, а также аденокарциномы желудка [1, 2]. Кроме того, инфекция H. pylori ассоциируется с развитием ряда аутоиммунных заболеваний, таких как аутоиммунная гемолитическая анемия, тромбоцитопеническая пурпура, IgA-нефропатия и др. (всего более 90 наименований). Имеются данные, свидетельствующие о взаимосвязи H. pylori и развитии ревматических заболеваний (РЗ) – ревматоидного артрита, прогрессирующего системного склероза, синдрома Шегрена [3]. Однако для ревматологов клиническое значение H. pylori, прежде всего, определяется его ролью в развитии лекарственных осложнений противоревматической терапии.
Речь пойдет о НПВП-гастропатии – поражении верхних отделов желудочно-кишечного тракта (ЖКТ), которое возникает на фоне приема нестероидных противовоспалительных препаратов (НПВП). Хотя НПВП и H. pylori считаются независимыми факторами развития эрозивно-язвенных изменений ЖКТ, имеется ряд исследований, показывающих их негативный синергизм. Согласно последним международным рекомендациям по диагностике и лечению H. pylori-ассоциированной патологии (Маастрихтское соглашение V), выявление и эрадикация этого микроорганизма настоятельно рекомендуется в случае развития НПВП-гастропатии. Тестирование на H. pylori и проведение курса антихеликобактерной терапии также показано лицам, нуждающимся в приеме НПВП и имеющим такие факторы риска, как язвенный анамнез, выраженная диспепсия и сопутствующий прием препаратов, влияющих на свертывание крови [4].
К сожалению, российские ревматологи и терапевты не так часто проводят эрадикацию H. pylori в своей повседневной практике, передавая решение вопроса о целесообразности данной терапии «узким специалистам» – гастроэнтерологам. В определенной степени это связано с недостаточными знаниями проблемы заболеваний и состояний, ассоциированных с H. pylori. С другой стороны, многие российские врачи избегают назначения комбинированной антибактериальной терапии, опасаясь известных нежелательных реакций (НР) – прежде всего, развития дисбиоза кишечника и диареи, связанной с избыточным ростом условно-патогенной флоры.
Решить проблему может альтернативный режим эрадикации H. pylori. В частности, большой интерес представляет схема антибактериальной терапии, включающая нифурател и предложенная Научным обществом гастроэнтерологов России в рамках национальных российских рекомендаций по лечению заболеваний, ассоциированных с H. pylori [5].
Нифурател – производное нитрофурана, препарат широкого спектра действия, активный в отношении H. pylori; кроме антибактериальной активности, он также обладает противогрибковым и противопротозойным эффектом. Принципиальным достоинством нифуратела является способность подавлять условно-патогенную флору кишечника, не нарушая при этом микробного равновесия. Собственно, этот препарат активно используется в качестве системного кишечного антисептика. Поэтому риск развития НР со стороны кишечника при использовании такой схемы антихеликобактерной терапии может быть существенно меньше в сравнении со стандартными схемами, включающими макролиды. При этом также снижается необходимость в назначении пробиотиков для восстановления биоценоза кишечника [6–8].
С целью изучения влияния H. pylori на развитие НПВП-гастропатии и оценки эффективности альтернативной схемы эрадикационной терапии, содержащей нифурател (Макмирор®), нами проведено открытое исследование ГРАНАТ («Геликобактер в Ревматологии: Апробация Нифуратела при Антигеликобактерной Терапии»).
Материал и методы
На первом этапе исследования был проведен скрининг для определения частоты инфекции H. pylori у больных РЗ, регулярно принимавших НПВП. С этой целью всем пациентам, находившимся на стационарном лечении в клинике ФГБНУ «НИИР им. В.А. Насоновой» в период с 01.02.2017 по 31.03.2017 (2 календарных месяца) и направленным для проведения эзофагогастродуоденоскопии (ЭГДС), было выполнено тестирование на инфицированность данным микроорганизмом. Критериями включения в исследование принимались общие показания к ЭГДС (наиболее часто – регулярный прием НПВП, диспепсия или патология ЖКТ в анамнезе), регулярное, не менее 2-х недель, использование НПВП до момента направления на ЭГДС, а также подписанное информированное согласие.
Всего тестирование на H. pylori проведено 109 больным. Характеристика исследуемой группы представлена в таблице 1. В исследуемой группе преобладали женщины среднего возраста, страдающие ревматоидным артритом. Из НПВП пациенты в основном получали нимесулид, диклофенак и мелоксикам; существенная часть из них, кроме того, получали глюкокортикоиды и базисные противовоспалительные препараты (БПВП), в основном метотрексат. Серьезные факторы риска НПВП-гастропатии, такие как наличие язвенного анамнеза и прием низких доз аспирина, имелись менее чем у 10% обследованных. 
При выполнении ЭГДС оценивалось наличие эрозий (поверхностные дефекты слизистой, не имеющие видимой глубины) и язв желудка и/или дефекта стенки желудка/двенадцатиперстной кишки с видимой глубиной, ≥5 мм в диаметре.
H. pylori выявляли путем «настольного» уреазного теста. Предварительно всем больным во время ЭГДС выполнялась биопсия слизистой антрального отдела и нижней трети тела желудка (по 1 образцу); затем эти образцы помещались на специальную пластинку (ХЕЛПИЛ-бланк). Положительная уреазная реакция проявляется ярко-синей окраской индикатора ХЕЛПИЛ-бланка. Тест считался положительным при явном изменении окраски индикатора после контакта с биоптатом слизистой из любого участка желудка.
На втором этапе исследования оценивали эффективность режима эрадикационной терапии с применением нифуратела: омепразол 20 мг 2 р./сут + амоксициллин 1000 мг р./сут + нифурател (Макмирор®) 400 мг 2 р./сут в течение 10 дней. Это лечение проводилось всем больным, инфицированным H. pylori, у которых при выполнении эндоскопического исследования были выявлены эрозии и/или язвы желудка или имелся язвенный анамнез (всего 32 пациента).
Результат лечения оценивался спустя 6 нед. после курса антибактериальной терапии. Для оценки эрадикации (отсутствия) H. pylori в организме больных проводилась полимеразная цепная реакция (ПЦР) в кале.
Все данные, полученные в ходе исследования, с согласия больных вносились в анонимные исследовательские карты. Электронная база данных была создана при помощи программы Microsoft Office Excel 2011, статистический анализ проводился с использованием программы SPSS 17.0. Средние значения приведены в формате M+m. Для оценки статистической значимости отличия количественных параметров применен t-тест Стьюдента, качественные параметры оценивались с помощью показателя χ2, точного теста Фишера и показателя отношения шансов (ОШ).
Проведение настоящего исследования одобрено комитетом по этике при ФГБНУ «НИИР им. В.А. Насоновой» (протокол № 26 от 03.11.2016).
Результаты исследования
Уреазный тест оказался положительным у 61 больного (56,0%). Эрозии и язвы верхних отделов ЖКТ выявлены у 40 пациентов (36,7%), причем единичные эрозии (менее 10) – у 23 (21,1%), множественные эрозии (более 10) – у 8 (7,3%), язвы желудка – у 9 больных (8,3%).
Группы больных, инфицированных и не инфицированных H. pylori, достоверно не различались по среднему возрасту и полу (p<0,05). Имелась четкая достоверная разница в частоте эрозий и язв у больных, инфицированных и не инфицированных H. pylori (рис. 1). Как видно, эти изменения гораздо чаще отмечались у пациентов с положительным уреазным тестом (p<0,001). В частности, язвы желудка были выявлены у 7 инфицированных больных и лишь у 2-х неинфицированных. 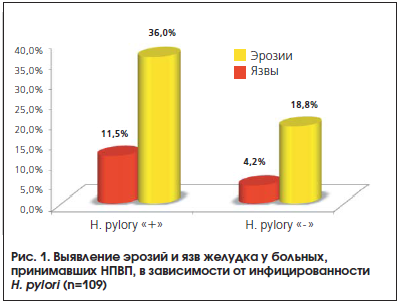
Суммарно риск (ОШ) выявления эрозии и/или язвы желудка у больных, инфицированных H. pylori, составил 3,68 (95% ДИ 1,56–8,68). Следует также отметить, что наличие гастралгий существенно чаще отмечалось у больных с H. pylori – у 19 (31,1%), чем у больных с отрицательным уреазным тестом – у 7 (14,6%), p=0,027.
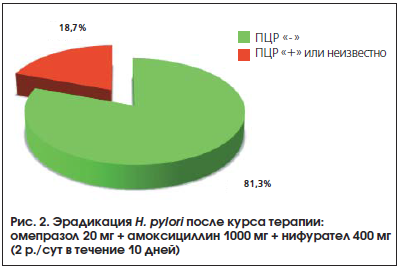
Эрадикация H. pylori проводилась у 32 больных. Полный курс антибиотиков проведен практически у всех пациентов, лишь у одного из них лечение было прервано из-за развития кожной аллергической реакции. Кроме этого случая, других значимых НР не отмечено.
Через 6 нед. после окончания антихеликобактерной терапии эрадикация H. pylori (отрицательная ПЦР) была достигнута у подавляющего большинства больных (рис. 2). Инфицированность этим микроорганизмом сохранилась лишь в 4-х случаях. Результаты лечения еще 2-х пациентов остались неизвестными. 
Обсуждение
Согласно полученным данным, H. pylori выявлен более чем у половины больных РЗ, принимавших НПВП. Надо признать, что небольшие размеры исследуемой группы не позволяют делать какие-либо выводы о реальной распространенности этой инфекции среди российских пациентов, тем более что ряд российских исследований демонстрируют существенно более высокий уровень инфицированности H. pylori в российской популяции – до 80–90% [9, 10].
Следует принять во внимание особенности контингента больных, включенных в наше исследование. На госпитализацию в клинику ФГБНУ «НИИР им. В.А. Насоновой» направляются пациенты из самых разных регионов нашей страны, причем обычно в состоянии обострения основного заболевания. Многие из них ранее получали антибиотики, а также ингибиторы протонной помпы (ИПП) в качестве гастропротекторов. Хорошо известно, что антибактериальная терапия и прием ИПП способны подавлять уреазную активность H. pylori, тем самым определяя ложноотрицательные результаты уреазного теста. Тем не менее обнаружение H. pylori более чем у 50% обследованных лиц указывает на серьезность данной проблемы и необходимость ее дальнейшего изучения.
Полученные нами результаты демонстрируют четкую взаимосвязь между наличием H. pylori и выявлением эрозий и язв желудка. Эти данные соответствуют литературным. Так, в 2002 г. J. Huang et al. провели метаанализ 16 рандомизированных контролируемых исследований (РКИ) (n=1625), в которых изучалась частота развития неосложненных и осложненных язв у пациентов, принимавших НПВП. Суммарно язвы были выявлены у 341 из 817 (41,7%) инфицированных H. pylori и у 209 из 808 (25,9%) неинфицированных (ОШ 2,12; 95% ДИ 1,68–2,67). Расчет показал, что сочетание H. pylori и приема НПВП повышало риск развития ЖКТ-кровотечения в 6,13 раза [11].
Похожие данные получены в относительно недавнем исследовании С. Sostres et al., которые исследовали причины развития язвенного кровотечения у 666 пациентов. Соответствующий по полу и возрасту контроль также составил 666 человек. H. pylori выявлен у 74,3% и 54,8% (ОШ 2,6; 95% ДИ 2,0–3,3), прием НПВП зарегистрирован у 34,5% и 13,4% (ОШ 4,0; 95% ДИ 3,0–5,4). В случае сочетания H. pylori и приема НПВП риск развития кровотечения резко возрастал (ОШ 8,0; 95% ДИ 5,0–12,8) [12].
Как уже отмечено выше, тестирование на H. pylori и проведение эрадикации при его выявлении у больных с высоким риском развития НПВП-гастропатии четко рекомендуется Маастрихтским соглашением V [4]. Это обосновано серией исследований, подтвердивших снижение риска серьезных ЖКТ-осложнений у пациентов, которым до назначения НПВП проводилась успешная антихеликобактерная терапия. С другой стороны, у лиц с уже развившейся патологией эрадикация H. pylori не снижает риска рецидивов язв и ЖКТ-кровотечения, если терапия НПВП продолжается, а дополнительная профилактика гастропротекторами не проводится.
Такой вывод подтверждают два метаанализа. Первый из них был представлен в 2005 г. М. Vergara et al., которые оценили результаты 5 РКИ (n=939). Согласно полученным данным, язвы желудка на фоне приема НПВП развились суммарно у 7,4% пациентов, прошедших эрадикацию, и у 13,3% – в группах контроля (ОШ 0,43; 95% ДИ 0,20–0,93). Необходимо отметить, что эрадикация обеспечила не только снижение частоты язв, но и снижение ЖКТ-кровотечений: их число составило 0 и 4 случая (ОШ 0,13; 95% ДИ 0,02–0,92). Однако анализ эффективности эрадикации H. pylori показал четкие различия в подгруппах пациентов, до включения в исследование еще не принимавших НПВП («НПВП-наивных») и уже получавших эти препараты. У первых эрадикация обеспечила значительное снижение риска развития НПВП-гастропатии (ОШ 0,26; 95% ДИ 0,14–0,49), у вторых же не да-вала положительного результата (ОШ 0,95; 95% ДИ 0,53–1,72) [13].
Более поздняя работа С. Tang et al. показала схожие результаты. По данным 7 РКИ, у больных после эрадикации и без нее число язв составило 6,4% и 11,8% соответственно (ОШ 0,50; 95% ДИ 0,36–0,74). Но также было отмечено существенное отличие между «НПВП-наивными» больными и лицами, длительно принимавшими НПВП. Если у первых эрадикация была однозначно эффективна для снижения частоты НПВП-гастропатии (ОШ 0,26; 95% ДИ 0,14–0,49), то у вторых достоверного уменьшения риска ЖКТ-осложнений не отмечено (ОШ 0,74; 95% ДИ 0,46–1,20) [14].
Яркими примерами отсутствия влияния эрадикации H. pylori на частоту рецидивов НПВП-индуцированных язв (после их успешного заживления) при продолжении НПВП-терапии могут служить классическое РКИ HELP-NSAID [15] и меньшее по масштабу открытое российское исследование [16].
Поэтому все больные, у которых развилась НПВП-гастропатия, в дальнейшем (после успешного заживления эрозий и язв желудка), при использовании НПВП, должны в качестве профилактики получать эффективный гастропротектор, например ИПП. Это положение четко отмечено в Маастрихтском соглашении V: «Утверждение 8. Тестирование на H. pylori следует выполнять у принимающих аспирин и НПВП с язвенным анамнезом… Таким образом, лечение ИПП является обязательным для тех, кто получает НПВП, коксибы или даже низкую дозу аспирина после язвенного кровотечения и эрадикации H. pylori при положительном тесте на эту инфекцию» [4].
Проводить эрадикацию H. pylori у больных, у которых на фоне приема НПВП развились язвы или ЖКТ-кровотечение, конечно же, необходимо. Ведь негативное действие инфекции H. pylori не исчерпывается только развитием НПВП-гастропатии. Нельзя забывать о хроническом гастрите и риске аденокарциномы, а также возможности заражения других лиц. В частности, до сих пор неизвестно, как протекает инфекция H. pylori на фоне снижения иммунитета, вызванного приемом синтетических и биологических БПВП для лечения ревматоидного артрита.
Необходимо отметить, что большинство пациентов с наиболее распространенными РЗ, такими как ревматоидный артрит и остеоартрит, не используют НПВП постоянно. На фоне активной патогенетической терапии основного РЗ потребность в обезболивающих средствах может быть сведена до минимума или вовсе исчезнуть. Если у пациента развилась НПВП-гастропатия и при этом выявлен H. pylori, устранение обоих этих факторов (отмена НПВП и эрадикация H. pylori) позволит в дальнейшем снизить риск развития патологии верхних отделов ЖКТ до минимума. В том случае, если потребность в НПВП возникнет вновь, отсутствие H. pylori станет важным фактором предупреждения рецидива поражения ЖКТ.
Наше исследование показало хороший результат применения альтернативной схемы эрадикации H. pylori с использованием нифуратела. Позитивный результат достигнут у 80% больных. При этом переносимость терапии оказалась благоприятной: лишь у одного пациента возникла аллергическая реакция, которая потребовала отмены лечения. Конечно, небольшой размер исследуемой группы и открытый характер исследования ограничивают оценку полученных результатов. Тем не менее, полученные данные представляют интерес как первый опыт применения альтернативной схемы антихеликобактерной терапии у пациентов с РЗ.
Наши результаты подтверждают данные о хорошей эффективности эрадикационных схем на основе нифуратела, показанные, в частности, в детской практике [7, 17]. Так, в работе О.Г. Шадрина и соавт. частота эрадикации H. pylori при использовании этого препарата достигала почти 90% [18].
Как уже отмечено выше, нифурател имеет серьезное преимущество в сравнении с другими антихеликобактерными средствами – он обладает свойствами кишечного антисептика. Нифурател относится к производным нитрофурана и имеет широкий спектр действия; важно, что к нему очень редко формируется устойчивость микроорганизмов. Подавление условно-патогенной флоры и пробиотическое действие нифуратела позволяют избежать развития дисбиотических нарушений и поддерживать нормальное состояние микробиоты кишки. Это принципиально важно при лечении ЖКТ-осложнений, вызванных НПВП. Дело в том, что негативное действие этих препаратов не ограничивается только верхними отделами ЖКТ. У больных, регулярно принимающих НПВП, нередко развивается поражение тонкой кишки – НПВП-энтеропатия. Данная патология относительно редко проявляет себя в виде манифестных форм – кишечного кровотечения, перфорации или формирования стриктур, но часто становится причиной развития медленно прогрессирующей железодефицитной анемии [19]. Имеются данные, что прием антибиотиков и ИПП – это основные компоненты «стандартной» эрадикационной терапии – существенно повышает риск развития НПВП-энтеропатии [20]. Напротив, кишечные антисептики, подавляющие условно-патогенную флору кишки (контаминация этих микроорганизмов играет ключевую роль в развитии энтеропатии), способны предотвращать развитие НПВП-энтеропатии [21]. Поэтому включение в схему эрадикационной терапии нифуратела представляется ценным элементом комплексной защиты ЖКТ от негативного действия НПВП.
Необходимы дальнейшие исследования в этом направлении. Однако полученные данные уже сейчас можно рассматривать как серьезное подтверждение целесообразности более широкого применения нифуратела для лечения и профилактики лекарственных осложнений в ревматологической практике.
Источник
23 января 2019125259 тыс.
Хеликобактер пилори – уникальный патогенный микроорганизм, являющийся возбудителем такого опасного заболевания, как хеликобактериоз. Это патология, которая зачастую поражает желудок, но может также развиваться в ДПК.
Свое название бактерия получила за счет среды, в которой она обитает – пилорического отдела желудка. Особенностью микроорганизма является то, что она способна противостоять даже желудочной кислоте. Бактерия имеет жгутики, с помощью которых она свободно перемещается по стенкам желудка, либо надежно на них закрепляется.
Helicobacter Pylori способна приводить к развитию множества заболеваний ЖКТ, поскольку, размножаясь, она вызывает раздражение его слизистых оболочек и, как следствие, воспалительные процессы. При этом речь идет не только о гастрите или язвенной болезни, но и о развитии онкологического процесса. Если своевременно начать лечение, можно предотвратить опасные последствия, которые могут быть вызваны жизнедеятельностью этой бактерии.
История открытия
Спиралевидные болезнетворные микроорганизмы, обитающие в желудке человека, были описаны еще 100 лет назад польским профессором В. Яворским. Через некоторое время ученый Г. Бидзодзеро обнаружил такие же бактерии на слизистых оболочках желудка у животных. Долгие годы на эту инфекцию закрывали глаза, не подозревая о ее опасности, но в конце 70-х годов прошлого века ученый Роберт Уоррен отметил, что бактерии эти обитают на воспаленной желудочной слизистой оболочке.
Как оказалось, жизнедеятельность этих микроорганизмов была изучена, пусть и не до конца, и описана немецкими учеными. Однако в те времена этому не придавали особого значения. Уоррен же, объединив усилия с Барри Маршаллом, начал проводить исследования для детального изучения особенностей этих бактерий. На протяжении длительного периода времени выделить культуру микроорганизмов не удавалось, но ученым, все же, улыбнулась удача. Во время пасхальных праздников сотрудники лаборатории случайно оставили чашки с бактериальными посевами не на 2, а на 5 дней. Благодаря этому случаю учеными был зафиксирован рост колоний неизвестных микроорганизмов.
Бактерии получили первоначальное название Campylobacter pyloridis, поскольку по своим признакам они напоминали микроорганизмы, относящиеся к роду Campylobacter. В 1983 году ученые впервые опубликовали результаты своих исследований. Однако немного позже исследователям пришлось опровергнуть свои прежние открытия, поскольку вскоре выяснилось, что к роду кампилобактерий обнаруженные представители патогенной микрофлоры не имеют отношения. На основании этого обнаруженные микроорганизмы были переименованы в Хеликобактер пилори.
Чтобы доказать способность микроорганизма вызывать ЯБЖ, Б. Маршалл в 1985 году проглотил его культуру. Однако произошло развитие не язвы, а гастрита, который прошел самостоятельно. Благодаря этому эксперименту ученому удалось доказать, что бактерия Helicobacter Pylori является причиной развития гастрита. В 2005 году Уоррен и Маршалл получили Нобелевскую премию по медицине и физиологии за свое сенсационное открытие.
Особенности бактерии
Первой особенностью данного микроорганизма является его способность противостоять очень кислой желудочной среде, в то время как большинство бактерий и вирусов просто погибает. Хеликобактер пилори же может подстраиваться к уровню желудочной кислотности, используя 2 механизма:
- При попадании в желудок бактерия начинает перемещаться по слизистым оболочкам. Делает она это с помощью своих жгутиков. Укрываясь в слизистых желудка, микроорганизм защищает их клетки от избыточного количества кислот. Говоря проще, бактерия «выбирает» самую оптимальную для себя среду обитания.
- H. pylori провоцирует выработку аммиака, который снижает кислотность желудка. За счет этого микроорганизм может удобно располагаться на стенках органа, оставаясь на своем месте в течение многих лет.
Второй особенностью бактерии является его способность вызывать воспалительные процессы в ЖКТ. Размножаясь, она вызывает медленное разрушение желудочных клеток, а вещества, выделяемые ею, вызывают хронические воспалительные процессы и гастриты. При ослаблении слизистых ДПК и желудка начинают образовываться язвочки и эрозии, которые повышают риск развития рака. По этой причине многие гастроэнтерологи небезосновательно считают Helicobacter Pylori провокатором онкологических процессов в желудке.
Избавиться от патологии можно только после похождения курса антибиотикотерапии. С помощью противомикробных препаратов происходит регуляция уровня кислотности желудка. Конкретные лекарства может назначить только гастроэнтеролог, проведя необходимые обследования и направив пациента на дополнительные инструментальные диагностические процедуры.
Как передается H. pylori?
Заражение данной бактерией можно, в основном, двумя путями – орально-фекальным и орально-оральным. Однако бытует мнение, что микроорганизм может быть передан от кошки к хозяину, либо при переносе инфекции мухами. Более всего заражению подвержены маленькие дети.
Передача от одного человека к другому происходит 3 способами:
- Ятрогенным, когда инфицирование обусловлено проводимыми диагностическими процедурами. Так, занести инфекцию можно во время проведения эндоскопии или других плохо простериллизованных медицинских инструментов, которые имели прямой контакт со слизистой желудка пациента.
- Фекально-оральным. Бактерия выделяется вместе с каловыми массами. Заразиться бактерией можно при контакте с загрязненной водой или продуктами питания.
- Орально-оральным. Гастроэнтерологи уверены, что H. pylori обитает и в ротовой полости. Поэтому инфекция может передаваться при поцелуях, использовании чужой зубной щетки или плохо вымытых столовых приборов.
Хотя Helicobacter Pylori способна вызывать гистологический гастрит у всех зараженных людей, признаки патологии проявляются в редких случаях. Реже, чем гастрит развивается ЯБЖ, а крайне редко – рак желудка.
Симптомы заражения
После попадания в желудок бактерия начинает активно выделять продукты своей жизнедеятельности. Они раздражают слизистую, вследствие чего развивается воспаление. Клинические симптомы Helicobacter Pylori зависят от его формы.
Таковых существует пять, рассмотрим каждую из них подробнее:
- Латентная или бессимптомная форма, когда у зараженного человека не возникает никакой тревожной симптоматики, особенно если его иммунитет достаточно силен, чтобы противостоять хеликобактер. Но даже если клиническая картина не проявляется, человек все равно является носителем, и может заражать других. При длительном пребывании бактерии в желудке возможно возникновение тяжелых осложнений, одним из которых является рак желудка.
- Острый гастрит – заболевание, проявляющееся болью в эпигастрии, тошнотой, потерей аппетита. Болезнь может переходить в хроническую форму с периодическими рецидивами.
- Хронический гастрит. Именно эта патология является одним из главных проявлений хеликобактериоза. В период обострения пациент жалуется на боли в желудке, приступы тошноты, иногда со рвотой, головные боли, потерю аппетита. Больного не покидает изжога, чувство вздутия, отрыжка, приступы метеоризмов. Также возникают неспецифические симптомы в виде кровоточивости десен и неприятного запаха изо рта.
- Хронический гастродуоденит, когда патологический процесс затрагивает ДПК. Клиническая картина напоминает симптоматику гастрита, но при гастродуодените возможны расстройства стула, в частности, запоры. Пациент теряет аппетит, жалуется на тошноту, у него нарушается сон. Изменения слизистых оболочек обнаруживаются только во время проведения эндоскопии. Поражения могут быть легкими, умеренными или тяжелыми.
- ЯБЖ, которая может возникать и по другим причинам (алкоголизм, табакокурение, частые стрессы, вредная работа и др.). Эрозии и язвочки образуются при более глубоком поражении слизистых оболочек желудка. Проявляется патология большим количеством симптомов: болями в желудке, тошнотой, появлением белого налета на языке, тошнотой, метеоризмами, рвотой, несварением желудка, тяжестью в подложечной области, изжогой и др.
Если же говорить о вне желудочных симптомах, то у больного хеликобактериозом отмечается появление подкожной или кожной сыпи в виде мелких белых или розовых прыщиков. Как правило, локализуются они на лице. Зачастую это заболевание становится причиной развития атопического дерматита, псориаза, экземы, плоского лишая, эритемы.
Анализ на хеликобактер пилори
Диагностика может быть инвазивной (эндоскопия с последующей биопсией желудочных тканей) и неинвазивной (лабораторные исследования). Конечно, самой точной и достоверной является инвазивная методика, ведь за счет забора тканей слизистой желудка медицинским специалистом проводится тщательное исследование биоматериала на предмет обнаружения очагов воспаления и непосредственно самих бактерий. Помимо микроскопического исследования, образец желудочной ткани может быть подвергнут разным лабораторным тестам.
Все лабораторные исследования направлены на выявление хеликобактер пилори и оценку ее жизнедеятельности. На протяжении своего жизненного цикла микроорганизм расщепляет желудочную мочевину до аммиака, таким образом, создавая для себя благоприятные условия обитания. Если поместить кусочек желудочной слизистой, зараженной Helicobacter Pylori, в мочевину, произойдет выделение аммиака. За счет этого уровень щелочности раствора повысится, но эти изменения можно будет обнаружить только с помощью специальных тест-полосок. Действуют индикаторы по принципу лакмусовой бумаги.
Но для выявления заболевания вовсе не обязательно проводить ФГДС или исследование биоптата – можно использовать и другую методику. Тест с 13 мочевиной помогает абсолютно безболезненно выявить наличие инфекции и незамедлительно начать лечение.
Возможные осложнения
При своевременном начале терапии опасные последствия можно предотвратить. К тому же риск заражения других людей будет полностью исключен.
Если говорить об осложнениях, то они могут проявить себя посредством развития:
- хронического или атрофирующего гастрита;
- ЯБЖ и ДПК;
- онкологии желудка;
- эндокринных патологий, вызванных атрофией эпителиального покрытия желудка.
Во избежание подобных последствий самолечением заниматься строго не рекомендуется. Лучше доверить этот вопрос квалифицированному врачу-гастроэнтерологу.
Лечение хеликобактер пилори
Перед началом лечения Helicobacter Pylori проводится оценка степени поражения желудка и обсемененности его стенок. Дело в том, что у некоторых людей со временем эти микроорганизмы становятся одной из разновидностей условно-патогенной микрофлоры, поэтому могут никак себя не проявлять.
Если бактерия не вредит здоровью своего носителя, манипуляцию по ее удалению не проводят. Но для излечения инфекции понадобится применение мощных антибактериальных препаратов. Они, в свою очередь, способны значительно ослабить иммунитет и вызвать развитие дисбактериоза кишечника.
На заметку. Нельзя прибегать к использованию народных средств для лечения хеликобактериоза. Использование отваров и настоев может только на время «усыпить» симптоматику болезни, заставив пациента отложить визит к доктору. Болезнь же тем временем будет только прогрессировать, что в будущем может стать причиной серьезных осложнений.
Терапевтические схемы
Схема лечения хеликобактер пилори требует комплексного врачебного подхода. Обычно пациенту прописывают 2 препарата, которые подбираются индивидуально. Плюс ко всему в обязательном порядке назначается одно средство из группы ингибиторов протонной помпы.
Продолжительность лечения определяется гастроэнтеролог после тщательного обследования больного и оценки степени тяжести заболевания. Продолжительность курса терапии составляет 14-21 день. После его окончания врач проводит повторные лабораторные исследования для подтверждения полного выздоровления пациента.
Антибиотики
Несмотря на то, что Helicobacter Pylori относится к группе болезнетворных бактерий, не все противомикробные препараты способны ее уничтожить.
Микроорганизм быстро вырабатывает сопротивляемость к антибактериальным веществам, что значительно затрудняет процесс выздоровления. Иногда врачу приходится комбинировать сразу несколько лекарств, чтобы добиться положительной динамики, к тому же кислая среда желудка может препятствовать активации компонентов лекарств и замедлять процесс терапии.
Антибиотикотерапия при хеликобактериозе подразумевает применение следующих препаратов:
Самым высоким эффектом при лечении воспаления слизистых оболочек желудка и образовавшихся на нем язвочек обладает препарат Амоксициллин и его аналог Флемоксин Солютаб. Возможно использование других антибактериальных препаратов – Аугментина и Амоксиклава. В их состав входит клавулановая кислота, которая препятствует выработке микроорганизмами специфических ферментов. Это, в свою очередь, предотвращает выработку резистентности микроорганизмом H. pylori.
Препараты висмута трикалия дицитрата
Чаще всего для лечения заболеваний, вызванных хеликобактериозом, используется препарат Де-Нол, в состав которого входит активное вещество трикалия дицитрат. Благодаря этому происходит значительное снижение выработки биологических соединений, которые способствуют росту и размножению патогенной микрофлоры.
Действие Де-Нола направлено на:
- нарушение проницаемости клеточных мембран;
- изменение мембранной структуры клеток.
При химическом взаимодействии трикалия дицитрата с протеиновыми соединениями слизистой желудка происходит формирование высокомолекулярных комплексов. Благодаря этому на поверхности язвочек и эрозий образуется прочная защитная пленка, которая препятствует попаданию желудочного сока на поврежденные участки слизистой оболочки желудка.
После прохождения полного курса терапии Де-Нолом происходит повышение резистентности слизистой органов ЖКТ к пепсину и хлористоводородной кислоте.
Блокаторы протонной помпы
Для эффективного и более быстрого избавления от Helicobacter Pylori в схему лечения включают блокаторы протонной помпы. За счет компонентов, входящих в их состав, происходит запуск сложных биологических процессов, которые приводят к снижению выработки желудком соляной кислоты.
К самым эффективным блокаторам (ингибиторам) протонной помпы относят следующие препараты:
- Омепразол (Омез, Ультоп).
- Рабепразол (аналоги – Хайрабезол, Берета).
- Пантопразол (аналоги – Контролок, Нольпаза).
При снижении кислотности желудка происходит запуск процесса восстановления поврежденных тканей. Он создает неблагоприятные условия для размножения патогенных микроорганизмов, и в частности, H. pylori.
К тому же ингибиторы протонной помпы значительно повышают эффективность антибиотиков, используемых для лечения заболеваний, вызванных этой бактерией. С учетом этого гастроэнтерологи часто снижают дозу противомикробных препаратов. Это благоприятно сказывается на состоянии микрофлоры кишечника и общем иммунитете больного.
Лечебная диета
Для нормализации работы ЖКТ на протяжении всего курса лечения и после его окончания больному необходимо соблюдать специальную лечебную диету. Она подразумевает выполнение следующих правил:
- Питание должно быть дробным, то есть, кушать нужно мало, но часто.
- Исключить жареную, жирную, пряную, острую пищу, сдобу и кондитерские изделия.
- Соблюдать питьевой режим.
- Отказаться от спиртного и слабоалкогольных напитков.
- Исключить из рациона маринады, соления, газированную воду, фастфуды и другую вредную пищу.
Поначалу соблюдать такую жесткую диету будет непросто, но, заботясь о своем здоровье, пациент должен это сделать. Со временем он привыкнет к такому питанию, и не будет замечать ограничений в еде.
Вот примерное меню для больных Helicobacter Pylori:
- Завтрак состоит из геркулесовой каши, сырников из свежего творога и фруктового компота.
- На полдник разрешается есть творожное суфле и выпивать чашку ромашкового чая.
- На обед можно есть суп на основе куриного бульона с нежирным мясом, паровые рыбные котлеты и тушеные или свежие овощи.
- На второй полдник – фруктовый или молочный кисель с запеченными яблоками.
- На ужин можно кушать индейку, приготовленную на пару, и отварной картофель.
- На поздний ужин разрешается употреблять кефир или отвар из плодов шиповника.
Блюда подбираются индивидуально, в зависимости от стадии заб?
