Нарушение обмена нуклеопротеидов при подагре

Самым частым нарушением обмена пуринов является повышенное образование мочевой кислоты с развитием гиперурикемии. Особенностью является то, что растворимость солей мочевой кислоты (уратов) в плазме крови невелика и при превышении порога растворимости в плазме (около 0,7 ммоль/л) они кристаллизуются в периферических зонах с пониженной температурой.
В зависимости от длительности и тяжести гиперурикемия проявляется:
- Появление тофусов (греч. tophus — пористый камень, туф) — отложение уратных кристаллов в коже и подкожных слоях, в мелких суставах ног и рук, в сухожилиях, хрящах, костях и мышцах.
- Нефропатии в результате кристаллизации мочевой кислоты с поражением почечных канальцев и мочекаменная болезнь.
- Подагра — поражение мелких суставов.
Для диагностики нарушений используют определение концентрации мочевой кислоты в крови и моче.
Нарушения обмена пуринов
Подагра
Когда гиперурикемия принимает хронический характер, говорят о развитии подагры (греч. poclos — нога, agra — захват, дословно — «нога в капкане»).
В крови мочевая кислота находится в форме ее солей — уратов натрия. Из-за низкой растворимости ураты способны оседать в зонах с пониженной температурой, например, в мелких суставах стоп и пальцев ног. Накапливающиеся в межклеточном веществе ураты некоторое время фагоцитируются, но фагоциты не способны разрушить пуриновое кольцо. В результате это приводит к гибели самих фагоцитов, к выходу лизосомальных ферментов, активации свободнорадикального окисления и развитию острой воспалительной реакции — развивается подагрический артрит. В 50-75% случаев первым признаком заболевания является мучительная ночная боль в больших пальцах ног.
Длительное время подагру считали «болезнью гурманов», однако затем внимание исследователей переместилось к наследственному изменению активности ферментов метаболизма пуринов:
- увеличение активности ФРДФ-синтетазы — приводит к избыточному синтезу пуринов,
- уменьшение активности гипоксантин-гуанин-фосфорибозил-трансферазы — из-за этого ФРДФ не используется для реутилизации пуриновых оснований, а участвует в первой реакции их синтеза. В результате возрастает количество разрушающихся пуринов и одновременно повышается их образование.
Оба ферментативных нарушения рецессивны и сцеплены с X-хромосомой. Подагрой страдает 0,3-1,7% взрослого населения земного шара, соотношение заболевших мужчин и женщин составляет 20 : 1.
Еще Гиппократом было замечено, что болезнь поражает состоятельных граждан, и была заподозрена связь между недугом и чрезмерным употреблением мясной, жирной пищи и вина. По этой причине подагра получила название болезнь аристократов, болезнь изобилия, болезнь мушкетеров, королевская болезнь.
Основы лечения
Диета — снижение поступления предшественников мочевой кислоты с пищей и уменьшение ее образования в организме. Для этого из рациона исключаются продукты, содержащих много пуриновых оснований — пиво, кофе, чай, шоколад, мясные продукты, печень, красное вино. Предпочтение отдается вегетарианской диете с количеством чистой воды не менее 2 л в сутки.
Реакция превращения аллопуринола
К лекарственным средствам лечения подагры относят аллопуринол, по структуре схожий с гипоксантином. Ксантиноксидаза окисляет аллопуринол в аллоксантин, и последний остается прочно связанным с активным центром фермента и ингибирует его. Фермент осуществляет, образно говоря, самоубийственный катализ. Как следствие, ксантин не превращается в мочевую кислоту, и поскольку гипоксантин и ксантин лучше растворимы в воде, то они более легко выводятся из организма с мочой.
Гиперурикемия — необходимое, но недостаточное условие для развития подагры (уратной микрокристаллической болезни). Иными словами, гиперурикемия — отличный от подагры клинический синдром.
Мочекаменная болезнь
Мочекаменная болезнь заключается в образовании солевых кристаллов (камней) разной природы в мочевыводящих путях. Непосредственно образование мочекислых камней составляет около 15% от всех случаев этой болезни. Мочекислые камни в мочевыводящих путях откладываются примерно у половины больных подагрой.
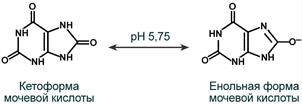
Две переходные формы мочевой кислоты при pH 5,75
Наиболее часто такие камни представлены в дистальных канальцах и собирательных трубочках. Причиной отложения кристаллов мочевой кислоты является гиперурикемия и повышенное выведение уратов натрия с мочой. Главным провоцирующим фактором кристаллизации является увеличение кислотности мочи. При понижении рН мочи ниже 5,75 ураты (енольная форма) переходят в менее растворимую кетоформу и кристаллизуются в почечных канальцах.
Закисление мочи (в норме 5,5-6,5) возникает по различным причинам. Это может быть избыточное питание мясопродуктами, содержащими большое количество нуклеиновых кислот, аминокислот и неорганических кислот, что делает такую пищу «кислой» и снижает рН мочи. Также кислотность мочи усиливается при ацидозах различного происхождения (Кислотно-основное состояние).
Кристаллы в почках могут иметь различную природу: 70-75% больных мочекаменной болезнью имеют камни щавелевой кислоты (оксалаты), 15% — мочевой кислоты, 10% — кальций-фосфатные, карбонатные, цистиновые камни. Самый большой почечный камень был извлечен 29.12.1952 из почки 80-летней женщины в Лондоне. Камень весил 6 кг 294 г.
Основы лечения
Так же, как при подагре, лечение сводится к беспуриновой диете и использованию аллопуринола. В дополнение рекомендуется растительная диета, приводящая к защелачиванию мочи, что увеличивает в моче долю более растворимой в воде енольной формы мочевой кислоты. Вместе с этим, уже имеющиеся кристаллы мочевой кислоты (а также кристаллы оксалатов) способны растворяться при подщелачивании мочи.
Лекарственное лечение непременно должно сопровождаться соблюдением беспуриновой диеты с большим количеством чистой воды, в противном случае неизбежно появление ксантиновых кристаллов в тканях и ксантиновых камней в почках.
Синдром Леша-Нихана
Болезнь Леша-Нихана (частота 1:300000) — это полное врожденное отсутствие активности гипоксантин-гуанин-фосфорибозил-трансферазы, фермента, отвечающего за реутилизацию пуриновых оснований. Признак рецессивный и сцеплен с Х-хромосомой. Впервые его описали в 1964 г в США студент-медик Майкл Леш и педиатр Уильям Нихан.
Дети рождаются клинически нормальными, только к 4-6 месяцу обнаруживаются отклонения в развитии, а именно — отставание физического развития (с трудом держит голову), повышенная возбудимость, рвота, периодическое повышение температуры. Выделение мочевой кислоты можно обнаружить еще раньше по оранжевой окраске пеленок. К концу первого года жизни симптомы нарастают, развивается нарушение координации движений, хореоатетоз, корковый паралич, спазм мышц ног. Наиболее характерный признак заболевания проявляется на 2-3-м году жизни — аутоагрессия или самокалечение — неодолимое стремление детей кусать себе губы, язык, суставы пальцев на руках и ногах. Агрессия больных распространяется также на неживые предметы и окружающих людей. Нарушения интеллекта выражены, его снижение может быть до IQ≈60.
Лечение основано на беспуриновой диете с большим количеством чистой воды и с использованием аллопуринола. Производится контроль деятельности пациента с помощью физических ограничений и психологической терапии.
Источник
Нуклеопротеиды построены из белка и нуклеиновых кислот — дезоксирибонуклеиновой (ДНК) и рибонуклеиновой (РНК).
Нарушение обмена нуклеопротеидов выражается в избыточном образовании мочевой кислоты, развитии гиперурикемии и выпадении ее солей в тканях. Это наблюдается при: подагре; мочекаменной болезни; мочекислом инфаркте.
Подагра характеризуется переодическим выпадениемв суставах мочекислого натрия, что сопровождается болевым приступом. У больных обнаруживается повышенное содержание солей мочевой кислоты в крови (гиперурикемия) и моче (гиперурикурия). Соли обычно откладываются в синовии и хрящах мелких суставов ног и рук, голеностопных и коленных суставов, в сухожилиях и суставных сумках, в хряще ушных раковин. Ткани, в которых выпадают соли в виде кристаллов или аморфных масс, некротизируются. Вокруг отложений солей, как и очагов некроза, развивается воспалительная гранулематозная реакция сос скоплением гигантсиких клеток. По мере увеличения отложений солей и разрастания вокруг них соединительной ткани образуются подагрические шишки, суставы деформируются. Изменения почек заключаются в скоплении мочевой кислоты и солей мочекислого натрия в канальцах и собирательных трубках с обтурацией их просветов, развитии вторичных воспалительных и атрофических изменений (подагрические почки).
14. Нарушение минерального обмена (минеральные дистрофии)
Обмен кальция.
Нарушение обмена кальция в тканях организма называют обызвествлением.
В зависимости от преобладания общих или местных факторов в развитии кальцификации различают три формы обызвествления:
• метастатическое; • дистрофическое; • метаболическое.
Метастатическая кальцификация возникает при увеличении концентрации кальция или фосфора в крови (гиперкалъциемия). Кальцификация происходит наиболее часто в стенках артерий, альвеолярных перегородках легких, в слизистой оболочке желудка, в миокарде левого желудочка и в почках.
Причины метастатического обызвествления связаны с усиленным выходом солей кальция из депо и с пониженным выведением солей кальция из организма.
При микроскопии кальций окрашивается в интенсивно фиолетовый цвет (базофильно). В ранних стадиях кальцификации очаги скопления кальция кажутся гранулярными, а большие очаги аморфными. Гистохимически кальций выявляют методом серебрения Косса. Вокруг отложений извести наблюдается воспалительная реакция, иногда отмечаются скопления макрофагов, гигантских клеток, образование гранулемы. Внешний вид органов и тканей мало изменен.
Исход неблагоприятен: выпавшие соли практически не рассасываются.
При кальцификации почечного интерстициума (нефрокальциноз) может возникать хроническая почечная недостаточность. Обширная кальцификация кровеносных сосудов может приводить к ишемии, особенно в коже. Редко при обширном повреждении легочных альвеол возникают нарушения диффузии газов. Кроме этих случаев, кальцификация не нарушает функции паренхиматозных клеток в тканях.
При дистрофическом обызвествлении (петрификации) метаболизм кальция и фосфора не нарушен. Их уровень концентрации в сыворотке крови нормальный. Кальцификация происходит в результате местных нарушений в тканях. Отложения солей кальция имеют местный характер и обычно обнаруживаются в тканях омертвевших или находящихся в состоянии глубокой
дистрофии.
Основная причина дистрофического обызвествления — физико-химические изменения тканей, сопровождающиеся ощелачиванием среды в связи с усиленным потреблением кислорода и выделением углекислоты, изменением свойств белковых коллоидов (коагуляцией белка) и усилением активности фосфатаз. В таких тканях появляются разных размеров очаги каменистой плотности — петрификаты.
Метаболическое обызвествление (интерстициальный кальциноз). Механизм его развития до конца не ясен. Главное значение придают нестойкости буферных систем (рН и белковые коллоиды) крови и тканевой жидкости, в связи с чем кальций не удерживается в них даже при его невысокой концентрации, часто играет роль наследственная предрасположенность.
Интерстициальный кальциноз различают:
• системный; ограниченный.
Примером интерстициального системного кальциноза служит опухолеподобный кальциноз.
Интерстициальный ограниченный кальциноз, или известковая подагра, характеризуется отложением солей кальция в виде пластинок в коже рук, реже — ног.
Исход неблагоприятен: выпавший кальций обычно не рассасывается или рассасывается с трудом.
Имеют значение распространенность, локализация и характер обызвествления.
Обмен меди.
Нарушение обмена меди наиболее ярко проявляется при болезни Вильсона. При этом заболевании экскреция меди в желчь] нарушена, что ведет к увеличению содержания меди в организме ; с накоплением ее в клетках. Депонирование меди в гепатоцитах обусловлено пониженным образованием в печени церулоплазмина, который способен связывать в крови медь. Печень и базальные ядра мозга — наиболее часто повреждаемые ткани, поэтому болезнь Вильсона еще называется гепатоцеребральной дистрофией.
Обмен калия.
Увеличение количества калия в крови (гиперкалиемия) и в тканях отмечается при аддисоновой болезни и связано с поражением коры надпочечников, гормоны которого кошролируют баланс электролитов. При некоторых аденомах надпочечника может наблюдаться и гипокалиемия (альдистерама с развитием синдрома Кона).
Дефицит калия лежит в основе наследственного заболевания, именуемого «периодический паралич». Заболевание сопровождается приступами слабости и развитием двигательного паралича.
ОБРАЗОВАНИЕ КАМНЕЙ
Камни, или конкременты, представляют собой плотные образования, образующиеся из состава секрета или экскрета и свободно лежащие в полостных органах или выводных протоках желез.
Причины камнеобразования разнообразны и определяются как общими, так и местными факторами.
К общим факторам относятся нарушения обмена веществ.
Местные факторы:
• нарушение процессов секреции и резорбции в органе;
• воспалительные процессы.
Непосредственный механизм образования камня складывается из двух процессов:
• образования органической матрицы;
• кристаллизации солей.
Причем каждый из этих процессов в определенных ситуациях может быть первичным.
Наиболее часто камни образуются в желчных и мочевых путях, являясь причиной развития желчнокаменной и мочекаменной болезней. Они встречаются также в других полостях и протоках: в выводных протоках поджелудочной железы и слюнных желез, в бронхах и бронхоэкгазах (бронхиальные камни), в криптах миндалин, на зубах, в кишечнике.
Желчные камни могут быть холестериновыми, пигментными известковыми или холестериново-пигментно-известковыми (сложные, или комбинированные, камни). Мочевые камни могут состоять из мочевой кислоты и ее солей (ураты), фосфата кальция (фосфаты), оксалата кальция (оксалаты), цистина и ксантина. Бронхиальные камни состоят обычно из инкрустированной известью слизи.
Камни могут не иметь клинических проявлений и обнаруживаться случайно при патологоанатомическом вскрытии. Однако они могут повлечь и очень серьезные последствия. Нарушая выведение секрета, они ведут к тяжелым осложнениям общего или местного характера.
В результате давления камней на ткань может возникнуть омертвение — пролежень, что может сопровождаться развитием перфорации, спаек, свищей. Камни часто бывают причиной воспаления полостных органов и протоков, так как травмируют ткань, создают ворота инфекции, вызывают застой секрета или экскрета и составляют основу мочекаменной и желчнокаменной болезни.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Понятие «подагрическая нефропатия» включает различные формы поражения почек, вызванные нарушениями пуринового обмена и другими метаболическими и сосудистыми изменениями, свойственными подагре. Подагрой страдает 1-2% населения, преимущественно мужчины [1]. Если ранние бессимптомные нарушения пуринового обмена потенциально обратимы при условии своевременной диагностики и коррекции, то на стадии тофусной подагры с поражением сосудов и органов-мишеней (сердца, мозга, почек) прогноз заболевания неблагоприятен. Поражение почек развивается у 30-50% больных подагрой. При стойком повышении уровня мочевой кислоты крови > 8 мг/дл риск последующего развития хронической почечной недостаточности (ХПН) возрастает в 3-10 раз. У каждого 4-го больного подагрой развивается ХПН [2].

В развитии подагры играют роль как приобретенные, так и наследственные факторы. Особенно велика роль неправильного питания в сочетании с гиподинамией. За последние 20 лет в Европе и США наблюдается многократный рост заболеваемости подагрой параллельно с эпидемией морбидного ожирения, нефролитиаза и инсулиннезависимого сахарного диабета [1, 3]. Особенно часто развивается подагра в странах с высоким потреблением мясных продуктов на душу населения.
Cвойственные подагре метаболический синдром с резистентностью к инсулину, а также гиперфосфатемия способствуют образованию тяжелого атеросклероза почечных и коронарных артерий с развитием ишемической болезни сердца, реноваскулярной гипертонии, присоединению к уратному кальциевого нефролитиаза.
Ведущие патогенетические механизмы подагрической нефропатии связаны с повышением синтеза мочевой кислоты в организме, а также с развитием дисбаланса между процессами канальцевой секреции и реабсорбции уратов. Гиперпродукция мочевой кислоты вызвана дефицитом гипоксантин-гуанинфосфорибозилтрансферазы (ГГФТ). ГГФТ контролируется генами, локализованными в Х-хромосоме. Этим объясняется тот факт, что подагрой заболевают почти исключительно лица мужского пола. Полный дефицит ГГФТ приводит к синдрому Леша-Найхена, характеризующемуся ранним и особенно тяжелым течением подагры. Среди других вариантов ювенильной наследственной подагры — формы, вызванные мутацией канальцевого белка Тамма-Хорсфолла, нуклеарного печеночного фактора — RCAD (renal cyst and diabetes)-синдром (сочетание подагры с кистозной дисплазией почек и инсулиннезависимым сахарным диабетом) [4]. К гиперурикемии приводит также усиленное внутриклеточное разрушение аденозинтрифосфата (АТФ): дефект, свойственный гликогенозу (I, III, V типа), врожденной непереносимости фруктозы, хроническому алкоголизму [1]. В то же время у большинства больных первичной подагрой выявляются нарушения тубулярной функции почек: снижение секреции, усиление различных фаз реабсорбции. Важную роль в патогенезе играет cпособствующий кристаллизации уратов в моче дефект канальцевого ацидогенеза [2]. Дефект проявляется образованием при подагре мочи со стойко кислой реакцией (рН < 5).
Повреждающее почки действие гиперурикозурии приводит к уратному нефролитиазу с вторичным пиелонефритом, поражению уратами интерстициальной ткани почек с развитием хронического тубуло-интерстициального нефрита, а также к ренальной острой почечной недостаточности (ОПН) за счет внутриканальцевой обструкции кристаллами мочевой кислоты (острой мочекислой нефропатии).
Гиперурикемия за счет активации почечной ренинангиотензиновой системы и циклооксигеназы-2 усиливает продукцию ренина, тромбоксана и фактора пролиферации гладкомышечных клеток сосудов, а также индуцирует атерогенную модификацию липопротеинов очень низкой плотности (ЛПОНП).
В результате развивается афферентная артериолопатия с почечной гипертонией и последующим гломерулосклерозом и нефроангиосклерозом [5].
Уратный нефролитиаз. Характеризуется, как правило, двусторонним поражением, частыми рецидивами камнеобразования, иногда коралловидным нефролитиазом. Уратные камни рентгенонегативны, лучше визуализируются на эхографии. Вне приступа изменения в анализах мочи могут отсутствовать. Почечная колика сопровождается гематурией, уратной кристаллурией. При затянувшейся почечной колике нефролитиаз может осложниться атакой вторичного пиелонефрита, постренальной ОПН. При длительном течении приводит к гидронефротической трансформации почки, пионефрозу.
Хронический тубулоинтерстициальный нефрит. Проявляется стойким мочевым синдромом, часто сочетающимся с артериальной гипертонией. При этом протеинурия, не превышающая 2 г/л более чем у половины больных, сочетается с микрогематурией. Конкрементов обычно не обнаруживается, однако отмечаются эпизоды макрогематурии с преходящей олигурией и азотемией, провоцируемые дегидратацией. У 1/3 больных обнаруживаются двусторонние медуллярные кисты (0,5-3 cм в диаметре). Типично раннее присоединение гипостенурии и никтурии, а также гипертонии с гломерулосклерозом. Артериальная гипертония обычно носит контролируемый характер. Появление трудноконтролируемой гипертонии свидетельствует о прогрессировании гломерулосклероза и нефроангиосклероза или формировании атеросклеротического стеноза почечных артерий.
Острая мочекислая нефропатия. Манифестирует внезапно олигурией, тупыми болями в пояснице с дизурией и макрогематурией, нередко сочетающимися с атакой подагрического артрита, гипертоническим кризом, приступом почечной колики. Олигурия сопровождается выделением мочи красно-бурого цвета (уратная кристаллурия). При этом концентрационная способность почек относительно сохранна, экскреция натрия с мочой не увеличена.
В дальнейшем олигурия быстро переходит в анурию. При усугублении внутриканальцевой обструкции образованием многочисленных уратных конкрементов в мочевых путях и в мочевом пузыре азотемия нарастает особенно высокими темпами, что позволяет отнести этот вариант к ургентной форме внезапно наступающей подагрической нефропатии.
Диагноз и дифференциальная диагностика
Клинически диагноз подагры наиболее вероятен при pазвитии острого артрита на фоне проявлений метаболического синдрома — алиментарного ожирения абдоминального типа в сочетании с объем-натрийзависимой гипертонией, гиперлипидемией, гиперинсулинемией, микроальбуминурией. Лабораторная диагностика подагры основывается на выявлении нарушений обмена мочевой кислоты: обнаружении гиперурикемии (> 7 мг/дл), гиперурикозурии (> 1100 мг/сут ), стойко кислой рН мочи, протеинурии (микроальбуминурии), гематурии, кристаллурии. Инструментальная диагностика включает ультразвуковое исследование (идентификация рентгенонегативных уратных конкрементов), а также (в сложных случаях) биопсию пораженного сустава, тофуса. При этом информативно обнаружение внутриклеточных кристаллов мочевой кислоты в синовиальной жидкости и в содержимом тофусов (методом поляризационной микроскопии). Ультразвуковая допплерография проводится при трудноконтролируемой гипертонии у больных подагрой с целью исключения атеросклеротического стеноза почечных артерий.
Вторым этапом диагностики является разграничение подагры и вторичных гиперурикемий. Среди заболеваний, часто сопровождающихся нарушениями пуринового обмена, известны: хроническая свинцовая интоксикация (свинцовая нефропатия), хроническое злоупотребление алкоголем, анальгетическая нефропатия, распространенный псориаз, саркоидоз, бериллиоз, гипотиреоз, миелопролиферативные заболевания, поликистозная болезнь, цистиноз. Гиперурикемия при алкоголизме, как правило, протекает бессимптомно и характеризуется эксцессзависимостью [6]. Следует подчеркнуть неблагоприятное прогностическое значение гиперурикемии при нефропатии беременных [7], при иммуноглобулин А (IgA)-нефропатии [8] и при алкоголизме [6]. Большую опасность представляет синдром лизиса опухоли: острая мочекислая нефропатия, осложняющая химиотерапию онкологических заболеваний. Для хронического тубулоинтерстициального нефрита характерны гипертония, ранняя анемия, остеопороз. Нередок исход в ХПН. Диагностика основывается на обнаружении повышенной концентрации свинца в крови и моче после пробы с комплексонами (ЕДТА — от англ. этилендиаминтетрауксусная кислота) [9]. Индуцированную лекарствами вторичную гиперурикемию также необходимо дифференцировать с первичной подагрой. К лекарственным средствам, вызывающим гиперурикемию, относятся: тиазидные и (в меньшей степени) петлевые диуретики, салицилаты, нестероидные противовоспалительные препараты, никотиновая кислота, этамбутол, циклоспорин, противоопухолевые цитостатики и антибиотики, рибавирин. Особенно важна диагностика ХПН (подагрической «маски» уремии), резко нарушающей почечную элиминацию мочевой кислоты [2].
Течение и прогноз подагрической нефропатии
Подагрическая нефропатия обычно возникает на одном из этапов многолетнего течения хронической «тофусной» подагры с атаками подагрического артрита. В то же время в 30-40% случаев нефропатия является первым проявлением — почечной «маской» — подагры или развивается на фоне атипичного для подагры суставного синдрома (поражение крупных суставов, полиартрит, артралгии).
О далеко зашедшей подагре с риском поражения органов-мишеней свидетельствуют гипертония с нарушением циркадного ритма, формирование метаболического синдрома, микроальбуминурия, значительное повышение липидов (холестерин липопротеинов низкой плотности > 130 мг% ), C-реактивного белка. Cреди ранних признаков поражения органов-мишеней при подагре: стойкая протеинурия, умеренное снижение клубочковой фильтрации (до 60-80 мл/мин), гипертрофия левого желудочка, присоединение сахарного диабета. Для подагрической нефропатии типично латентное или рецидивирующее течение с двусторонними почечными коликами (уратный нефролитиаз), повторными эпизодами обратимой ренальной ОПН (острая мочекислая нефропатия). От клинической манифестации подагрической нефропатии до появления ХПН в среднем проходит 12 лет.
К факторам риска развития ХПН при подагре относятся — стойкая артериальная гипертония, протеинурия > 1 г/л, присоединение хронического пиелонефрита, сахарный диабет, старческий возраст больного подагрой, ювенильные формы подагры, хронический алкоголизм.
Лечение подагрической нефропатии
Лечение острой мочекислой нефропатии проводится в соответствии с принципами лечения ОПН, вызванной острой внутриканальцевой обструкцией. При отсутствии анурии, признаков обструкции мочеточников уратами (постренальной ОПН ) или двустороннего атеросклеротического стеноза почечных артерий (ишемической болезни почек) применяется консервативное лечение. Используется непрерывная интенсивная инфузионная терапия ( 400-600 мл/ч) с применением изотонического раствора хлорида натрия, 4% раствора гидрокарбоната натрия и 5% глюкозы, 10% раствора маннитола (3-5 мл/кг/ч), фуросемида (до 1,5-2 г/сут, дробными дозами). При этом диурез должен поддерживаться на уровне 100-200 мл/ч, а рН мочи достигать значения 6,5, что обеспечивает растворение уратов и выведение мочевой кислоты. Одновременно назначается аллопуринол в дозе 8 мг/кг/сут или уратоксидаза (0,2 мг/кг/сут, внутривенно). При отсутствии эффекта от указанной терапии в течение 60 ч больного переводят на острый гемодиализ. В том случае, если острая мочекислая нефропатия развилась как осложнение химиотерапии опухоли (гемобластоза) в рамках вторичной гиперурикемии — при синдроме лизиса опухоли, cразу показан экстренный гемодиализ (гемодиафильтрация) вместе с аллопуринолом в виду низкой эффективности консервативной инфузионной терапии.
Лечение хронических форм подагрической нефропатии должно быть комплексным и предусматривать решение следующих задач:
- коррекция нарушений пуринового обмена;
- коррекция метаболического ацидоза и рН мочи;
- нормализация величины и суточного (циркадного) ритма артериального давления (АД);
- коррекция гиперлипидемии и гиперфосфатемии;
- лечение осложнений (в первую очередь хронического пиелонефрита).
Диета должна быть малопуриновой, низкокалорийной и сочетаться с обильным щелочным питьем (2-3 л/сут). Суточная квота белков не должна превышать 1 г/кг, жиров — 1 г/кг. Длительное соблюдение такой диеты снижает уровень мочевой кислоты крови на 10% (урикозурию — на 200-400 мг/сут), способствует нормализации массы тела, липидов и фосфатов крови, а также уменьшению метаболического ацидоза. Целесообразно обогащение диеты цитратом калия или бикарбонатом калия, а также рыбьим жиром. Эйкозапентаеновая кислота — действующее начало рыбьего жира — за счет высокого содержания полиненасыщенных жирных кислот оказывает при подагре нефропротективное и кардиопротективное действие. Ее длительное применение уменьшает объем жировой ткани, протеинурию, инсулинорезистентность, дислипидемию, гипертонию. При подагрической нефропатии в стадии ХПН должна использоваться малобелковая диета (0,6-0,8 г/кг).
Перечислим препараты, влияющие на пуриновый обмен.
- Купирующие подагрический артрит: колхицин; нестероидные противовоспалительные препараты; глюкокортикостероиды.
- Ингибиторы ксантиноксидазы: аллопуринол (милурит); уратоксидаза (расбуриказа).
- Урикозурические препараты: бензбромарон, сульфинпиразон, пробенецид; блокаторы рецепторов ангиотензина II (А II); статины.
- Цитратные смеси: уралит; магурлит; лемарен.
К препаратам, контролирующим гипертонию при подагре, относятся:
- ингибиторы ангиотензинпревращающего фермента (АПФ);
- блокаторы рецепторов А II;
- антагонисты кальция;
- селективные β-адреноблокаторы;
- петлевые диуретики;
- статины;
- фибраты.
Аллопуринол (милурит) cнижает продукцию и уровень мочевой кислоты крови, ингибируя фермент кcантиноксидазу. Способствует растворению уратов. Гипоурикемическое действие аллопуринола коррелирует с его нефропротективным эффектом, связанным со снижением протеинурии, продукции ренина, свободных радикалов, а также с замедлением гломерулосклероза и нефроангиосклероза. Показания к применению аллопуринола: бессимптомная гиперурикемия в сочетании с гиперурикозурией > 1100 мг/сут, подагрический хронический тубулоинтерстициальный нефрит, уратный нефролитиаз, профилактика острой мочекислой нефропатии у онкологических больных и ее лечение.
Суточная доза аллопуринола (от 200 до 600 мг/сут) зависит от выраженности гиперурикемии. В виду возможности обострения подагрического артрита целесообразно начинать лечение аллопуринолом в стационаре и в течение 7-10 дней комбинировать препарат с нестероидными противовоспалительными препаратами или колхицином (1,5 мг/сут). В первые недели лечения уратного нефролитиаза аллопуринолом желательно cочетать его с препаратами, повышающими растворимость уратов в моче (магурлит, уралит, бикарбонат калия, диакарб). При хроническом тубуло-интерстициальном нефрите дозу аллопуринола уменьшают по мере снижения клубочковой фильтрации, а при выраженной ХПН (креатинин сыворотки > 500 мкмоль/л) он противопоказан. Аллопуринол усиливает эффект непрямых антикоагулянтов и усугубляет токсическое действие азатиоприна на костный мозг. При обнаружении гиперурикемии (подагры) у реципиента после трансплантации необходимо снижение дозы циклоспорина и салуретиков. При отсутствии эффекта заменяют азатиоприн на микофенолат мофетил и только после этого присоединяют аллопуринол [10].
Урикозурические препараты корригируют гиперурикемию путем увеличения экскреции мочевой кислоты с мочой. Применяются при бессимптомной гиперурикемии, подагрическом хроническом тубулоинтерстициальном нефрите. Противопоказаны при гиперурикозурии, при уратном нефролитиазе, при ХПН. Чаще применяются пробенецид (начальная доза 0,5 г/сут), cульфинпиразон (0,1 г/сут), бензобромарон (0,1 г/сут). Возможна комбинация аллопуринола с бензобромароном или сульфинпиразоном. Урикозурическим эффектом обладает также лозартан и другие блокаторы рецепторов-II.
Цитратные смеси (уралит, магурлит, блемарен) корригируют метаболический ацидоз, повышают рН мочи до 6,5-7 и за счет этого растворяют мелкие уратные конкременты. Показаны при уратном нефролитиазе. Уралит или магурлит принимают до еды 3-4 раза в сутки в суточной дозе 6-10 г. При лечении необходим постоянный контроль за рН мочи, так как ее резкое ощелачивание может привести к кристаллизации фосфатов. Цитратные смеси противопоказаны при ХПН, при активном пиелонефрите, должны с осторожностью применяться при гипертонии (содержат много натрия). Цитратные смеси не эффективны при крупных конкрементах, когда показана дистанционная литотрипсия или пиелолитотомия.
В задачи гипотензивной терапии при подагрической нефропатии входит обеспечение нефропротективного и кардиопротективного эффектов. Не должны использоваться препараты, задерживающие мочевую кислоту (тиазидные диуретики), усугубляющие гиперлипидемию (неселективные β-адреноблокаторы). Препаратами выбора являются ингибиторы АПФ, блокаторы рецепторов А II, антагонисты кальция, селективные β-адреноблокаторы.
Статины (ловастатин, флувастатин, правастатин) применяются у больных подагрой с уровнем холестерина липопротеинов низкой плотности > 130 мг%. Статины III поколения (аторвастатин) обладают независимым гипоурикемическим эффектом [11].
Наиболее эффективна при подагрической нефропатии комбинация ингибиторов АПФ с блокаторами рецепторов A II, статинами и аллопуринолом. При указанном сочетании усиливаются гипоурикемический, антипротеинурический, гиполипидемический и гипотензивный эффекты c восстановлением циркадного ритма АД и замедлением ремоделирования миокарда левого желудочка, снижается риск формирования метаболического синдрома и сахарного диабета, уменьшается концентрации в крови С-реактивного белка. В результате снижается риск развития острого инфаркта миокарда, острых нарушений мозгового кровообращения и исхода в ХПН.
Литература
- Бунчук Н. В. Подагра// Ревматические болезни/ под ред. В. А. Насоновой и Н. В. Бунчука. М., 1997. C. 363-374.
- Mухин Н. А., Балкаров И. М. Подагрическая почка// Нефрология/ под ред. И. Е. Тареевой. M., 2000. C. 422-429.
- Stamatelou K. K. , Francis M. E., Jones C. A. trends is reported prevalence of kidney stones in the U.S.// Kidney Int. 2003; 63: 1817-1823.
- Bingham C., Ellard S. et al. Atypical familial juvenile hyperuricemic nephropathy associated with a hepatocyte nuclear factor-1 beta gene mutation // Kidney Int. 2003; 63: 1645-1651.
- Kang D. H., Nakagawa T., Feng L. A Role of uric acid in progression of renal disease // J. Amer. Soc. Nephrol. 2002; 13: 2888-2897.
- Николаев А. Ю. Нарушения пуринового обмена при алкоголизме// Алкогольная болезнь/ под ред. В. С. Моисеева. M., 1990. C. 95-99.
- Karumanchi S. A., Maynard S. E., Stillman I. E. Preeclampsia: a renal perspective// Kidney Int. 2005; 67: 2101-2113.
- Ohno T., Hosoya T., Gomi H. Serum uric acid and renal prognosis in IgA-nephropathy // Nephron — 2001; 87: 333-339.
- Munter P., He J., Vupputuri S. Blood lead and CKD in the general US population: results from NHANES III. Kidney Int. 2003; 63: 1044-1050.
- Perez-Ruiz F., Gomez-Ullate P., Amenabar J. Long-term efficiacy of hyperuricaemia treatment of renal transplant patients // Nephrol. Dial. Transpl. 2003; 18: 603-606.
- Athyros V. G., Elisaf M., Papageorgiou A. A. Effect of ins versus untreated dyslipidemia on serum uric acid levels in patients with coronary heart disease: a subgroup analysis of the GREck Atorvain and Coronary-heart-disease Evaluation (GREACE) study // Amer. J. Kidney Dis. 2004; 43: 589-599.
А. Ю. Николаев, доктор медицинских наук, профессор
Ю. С. Милованов, кандидат медицинских наук, доцент
ММА им. И. М. Cеченова, Москва
Источник
