Научные статьи ревматоидный артрит
ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ НАУК, 2015, том 85, № 8, с. 744-754
С КАФЕДРЫ ПРЕЗИДИУМА РАН
Б01: 10.7868/80869587315080204
Ещё столетие назад главной угрозой для здоровья человека считались инфекционные заболевания, но с развитием вакцинологии, созданием антибиотикотерапии, общим совершенствованием медицинской практики стало очевидным, что опасность не всегда приходит извне, но зачастую кроется в самом человеческом организме. За последние десятилетия исследования в области иммунологии показали чрезвычайно сложное функциональное устройство иммунной системы и многообразие случаев, когда она начинает работать не на защиту, а во вред организму, вызывая тяжёлые аутоиммунные заболевания. Одним из таких заболеваний является ревматоидный артрит, исследованию и разработке различных методов лечения которого было посвящено сообщение академика Е.Л. Насонова, заслушанное на одном из заседаний Президиума РАН. Вниманию читателей предлагаются текст сообщения и материалы его обсуждения (в изложении).
ПРОБЛЕМЫ РЕВМАТОИДНОГО АРТРИТА В XXI СТОЛЕТИИ
Е.Л. Насонов
Иммуновоспалительные (аутоиммунные) заболевания относятся к числу наиболее тяжёлых болезней человека, их частота в популяции приближается к 10%. Одними из наиболее распространённых в этой группе являются иммуновоспалительные ревматические заболевания (ИВРЗ), поражающие взрослых и детей, в первую очередь ревматоидный артрит, а также ювенильные артриты, спондилоартриты и системные заболевания соединительной ткани. Актуальность проблемы ИВРЗ для современной медицины определяется их высокой частотой в популяции, трудностью ранней диагностики, быстрым развитием инвалидности и неблагоприятным жизненным прогнозом. Высокий риск преждевременной летальности связан не только с тяжестью самого иммуновоспалительного процесса, но и с развитием широкого спектра коморбидных состояний: кардиоваскулярных, онкологических, интерсти-циального заболевания лёгких и др. Поэтому ревматология в начале XXI в. превратилась в одну из бурно развивающихся областей медицинского знания, эффективно адаптирующую самые пере-
НАСОНОВ Евгений Львович — академик, директор Научно -исследовательского института ревматологии им. В.А. Насоновой (НИИР им. В.А. Насоновой).
sokrat@irramn.ru
довые достижения и вносящую большой вклад в прогресс мировой фундаментальной и клинической медицины [1].
Важность исследований ревматоидного артрита (РА) обусловлена не только тяжестью течения и широкой распространённостью этого хронического заболевания, но и тем, что оно представляет собой модель для изучения фундаментальных механизмов патогенеза и подходов к фармакотерапии других социально значимых форм неинфекционных заболеваний. РА отличается наличием широкого спектра относительно специфических генетических дефектов, которые могут приводить к патогенетически значимому разнообразию в профиле синтеза цитокинов, экспрессии сигнальных молекул воспалительного каскада и характере воспалительной инфильтрации синовиальной оболочки сустава. Это определяет вариа-бильность течения и исходов воспалительного процесса у пациентов со сходными клиническими проявлениями заболевания и потенциально может оказывать существенное влияние на эффективность терапии.
Для лечения ревматоидного артрита в начале XXI в. специально разработано более 10 инновационных генно-инженерных биологических препаратов (ГИБП) — моноклональные антитела и рекомбинантные белки. Они ингибируют активность важнейших цитокинов, выработка которых и вызываемые ими реакции в случае РА только усугубляют болезнь, — фактора некроза опухоли (ФНО-а), и интерлейкинов ИЛ-6, ИЛ-1, ИЛ-17, ИЛ-12/23, а также патологическую активацию Т-лимфоцитов и В-лимфоцитов. Многие из этих препаратов успешно применяются в клиниче-
Мембранные/циркулирующие белки лимфоцитов
Цитокины
Т-лимфоциты (СТЬА4)
Абатацепт
В-лимфоциты ^20 и BLyS)
Ритуксимаб Белимумаб
Фактор некроза опухоли-а
Инфликсимаб
Адалимумаб
Этанерцепт
Цертолизумаб
Голимумаб
Интерлейкин-6 Интерлейкин-1 Интерлейкин-12/23
Тоцилизумаб Канакинумаб Устукинумаб
RANKL
Деносумаб
Рис. 1. Генно-инженерные биологические препараты, ингибирующие активность различных агентов воспалительного процесса при иммуновоспалительных ревматических болезнях
ской практике во всём мире, в том числе в России [2].
В настоящее время в зависимости от мишени, на которую направлено действие ГИБП, среди них выделяют: ингибиторы ФНО-а (этанерцепт — ЭТЦ, инфликсимаб — ИНФ, адалимумаб — АДА, голимумаб — ГЛМ и цертолизумаб — ЦЗП); ингибитор рецепторов интерлейкина ИЛ-6 — тоцилизумаб (ТЦЗ); анти-В-клеточный препарат ритуксимаб (РТМ); блокатор активации Т-лимфоци-тов абатацепт (АБЦ) (рис. 1). За последние 10 лет российская ревматология накопила уникальный клинический опыт применения ГИБП (открытые многоцентровые исследования, данные Российского регистра больных РА — АРБИТР), подтверждающий их высокую эффективность и приемлемую безопасность у пациентов с тяжёлым РА, резистентных к базисным противовоспалительным препаратам (БПВП) [2, 3].
В патогенезе ревматоидного артрита важнейшее значение имеет ФНО-а — плейотропный ци-токин, обладающий провоспалительной и имму-номодулирующей активностью. Поэтому среди широкого спектра ГИБП ингибиторы ФНО-а занимают особое место. Препараты этого класса фактически открывают новое направление в фармакотерапии не только РА, но и других ревматических (спондилоартриты, псориатический и ювенильный идиопатический артриты) и неревматических (болезнь Крона, язвенный колит) заболеваний. Лечение ингибиторами ФНО-а воздействует на многие важнейшие звенья патогенеза РА, включая подавление синтеза медиаторов острофазового воспалительного ответа, деструкции костной и хрящевой ткани, ангиогенеза, блокирование перемещения лейкоцитов в зону вос-
паления, восстановление иммунного гомеостаза, опосредуемое нормализацией функции Т-регуля-торных клеток и др. Ингибиторы ФНО-а подразделяются на три основные структурные категории: моноклональные антитела (мАТ), пегилиро-ванный Fab-фрагмент мАТ и модифицированный рецептор ФНО второго типа — ФНОР2.
В настоящее время НИИР им. В.А. Насоновой располагает данными об эффективности терапии ревматоидного артрита ингибиторами ФНО-а и другими ГИБП у более чем 2 тыс. больных (рис. 2). Анализ полученных результатов свидетельствует об успешности лечения, проявившейся в достоверном снижении клинико-лаборатор-ных показателей активности ревматоидного воспаления и улучшении качества жизни пациентов. Однако, как показывает опыт длительного применения ингибиторов ФНО-а в реальной клинической практике, ремиссии удаётся достигнуть менее чем у трети пациентов, ещё треть невосприимчива к терапии. У части больных, проходящих такое лечение, развиваются нежелательные реакции, приводящие к прерыванию терапии, а некоторые пациенты имеют противопоказания для назначения ингибиторов ФНО-а. Такое положение послужило мощным стимулом для разработки новых подходов к лечению РА, связанных с воздействием на другие патогенетические механизмы.
Среди направлений научных исследований, связанных с разработкой так называемой антици-токиновой терапии, особое внимание привлекает ИЛ-6, обладающий широким спектром биологических эффектов, имеющих при ревматоидном артрите несомненное патогенетическое значение. Упомянутый ранее тоцилизумаб представля-
70 60
^ 50
%
3 40
4 о ю
(3 30
ч о
к
^ 20 10 0
Инфликсимаб Адалимумаб Ритуксимаб Тоцилизумаб Абатацепт Этанерцепт (п = 396) (п = 100) (п = 1239) (п = 202) (п = 51) (п = 188)
П Низкая активность (DA S28 < 3.2) | Ремиссия (DA S8 < 2.6)
Рис. 2. Эффективность терапии генно-инженерными биологическими препаратами, 28—48 недель
ет собой гуманизированные моноклональные антитела (IgG1), направленные в отличие от моно-клональных антител, ингибирующих ФНО-а, не на сам цитокин-мишень, а на мембранную и растворимую формы рецепторов ИЛ-6. Благодаря этому происходит ингибиция обоих сигнальных путей ИЛ-6 зависимой клеточной активации. Тот факт, что у многих больных, резистентных к ингибиторам ФНО-а, лечение ТЦЗ приводит к снижению воспалительной активности, свидетельствует о существовании независимых от ФНО-а механизмов патогенеза РА.
В 27 ревматологических центрах России было проведено локальное открытое многоцентровое исследование оценки качества жизни пациентов с умеренной или высокой активностью ревматоидного артрита и неадекватным ответом на базисные противовоспалительные препараты при добавлении к терапии тоцилизумаба (ЛОРНЕТ). Полученные результаты свидетельствуют о высокой эффективности терапии ТЦЗ при тяжёлом РА, резистентном к стандартным БПВП. В ходе специального анализа динамики иммунологических маркеров на фоне применения ТЦЗ было установлено достоверное уменьшение концентрации ревматоидных факторов (РФ) двух классов — ^М и IgA. Концентрация антител к циклическому цитруллинированному пептиду (АЦЦП) не менялась. Уровень антител к цитруллинированному виментину (АМЦВ) достоверно уменьшался на 70% и 82% после начала применения ТЦЗ у пациентов, хорошо реагирующих на лечение. Установлено, что среди больных РА, достигших ремиссии, регистрируется более высокий исходный уровень АМЦВ, чем у тех пациентов, у которых сохраняется активность заболевания
(р = 0.02). Пациенты с высоко позитивными результатами определения АМЦВ в сыворотке крови с большей вероятностью достигали ремиссии заболевания, чем АМЦВ-негативные обследуемые (ОШ: 18.4, р = 0.03). Успешное применение ТЦЗ в терапии РА создаёт предпосылки для разработки других препаратов, нацеленных на подавление интерлейкина-6. В перспективе может быть сформирован новый класс ГИБП — ингибиторы ИЛ-6, что будет не менее важным достижением фармакотерапии воспалительных заболеваний, чем создание ингибиторов ФНО-а [2, 4].
Особый интерес среди разнообразных иммунных нарушений, лежащих в основе развития РА, а также других ИВРЗ, представляет изучение дефектов В-клеточной регуляции [3]. Дефекты В-клеточной толерантности приводят к синтезу аутоантител, которые, активируя эффекторные звенья иммунного ответа, индуцируют развитие воспаления и деструкцию тканей ор
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
Пoхожие научные работыпо теме «Общие и комплексные проблемы естественных и точных наук»
Источник
Ревматоидный артрит

Диагностика. Комментарии
1. На ранней стадии ревматоидного артрита (РА) не всегда бывает развернутая клиническая картина. Важно обращать внимание на общие симптомы: утомляемость, снижение трудоспособности, вовлечение в процесс новых суставов, несмотря на прием симптоматических средств (НПВП), повышение СРБ при нормальных значениях СОЭ, наличие утренней скованности.
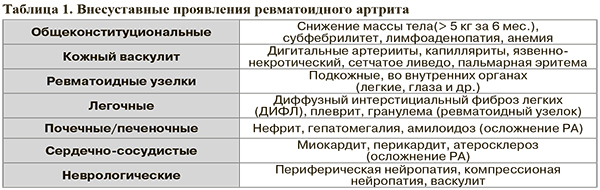
2. Возможные внесуставные проявления РА приведены в таблице 1.
3. Принципы начисления баллов для диагностики РА по критериям EULAR/ACR отражены в таблице 2.

4.
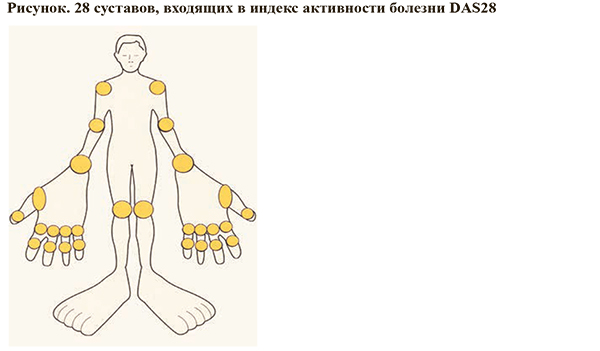
- 28 суставов, наиболее часто поражаемых при РА, приведены на рисунке.
- В интернете есть онлайн-калькулятор для вычисления индекса DAS28 (www.das-score.nl): внизу главной страницы указанного портала есть соответствующая онлайн-вкладка – Online DAS calculator.
- Интерпретация полученной величины DAS28:
- 2,6—3,1 — низкая активность РА;
- 3,2—5,0 — умеренная активность РА;
- от 5,1 и выше — высокая активность РА.
5. Рентгенография, МРТ, УЗИ позволяют определить эрозии суставов. Рентгенологические признаки РА, указываемые в формулировке диагноза, приведены в таблице 3.

6. Общий свод диагностических критериев РА Ассоциации ревматологов России (АРР), используемых для формулировки диагноза, включает несколько пунктов и соответствующих им подпунктов:
- основной диагноз:
- РА серопозитивный (код по МКБ М05.8);
- РА серонегативный (код по МКБ М06.0);
- особые клинические формы РА — синдром Фелти (код по МКБ М05.0) или болезнь Стилла взрослых (код по МКБ М06.4);
- клиническая стадия:
- очень ранняя (РА
- ранняя (РА 6—12 мес.);
- развернутая (РА > 1 года при наличии типичной симптоматики РА);
- поздняя (РА ≥ 2 лет + выраженная деструкция мелких (3—4 стадии) и крупных суставов, наличие осложнений);
- активность болезни:
- 0 = ремиссия (DAS28
- 1 = низкая (2,6
- 2 = средняя (DAS28 3,2—5,1);
- 3 = высокая (DAS28 > 5,1);
- внесуставные проявления: ревматоидные узелки, кожный васкулит, васкулит других органов, нейропатия (мононеврит, полинейропатия), плеврит (сухой, выпотной), перикардит (сухой, выпотной), синдром Шегрена, поражение глаз (склерит, эписклерит, васкулит сетчатки);
- инструментальная характеристика:
- наличие эрозий (рентген, МРТ, УЗИ);
- эрозивный;
- неэрозивный;
- рентгенологическая стадия (1—4) по Штейнброкеру;
- дополнительная иммунологическая характеристика:
- РА АЦЦП-позитивный;
- РА АЦЦП-негативный;
- функциональный класс:
- I — полностью сохранены самообслуживание, непрофессиональная и профессиональная деятельность;
- II — сохранены самообслуживание и профессиональная деятельность, но ограничена непрофессиональная деятельность;
- III — сохранено самообслуживание, но ограничены профессиональная и непрофессиональная деятельность;
- IV — ограничены самообслуживание, непрофессиональная и профессиональная деятельность.
- К возможным осложнениям РА относятся вторичный системный амилоидоз; вторичный артроз; остеопороз (системный); остеонекроз; туннельные синдромы; подвывих атлантоаксиального сустава, в том числе с миелопатией; нестабильность шейного отдела позвоночника; атеросклероз.

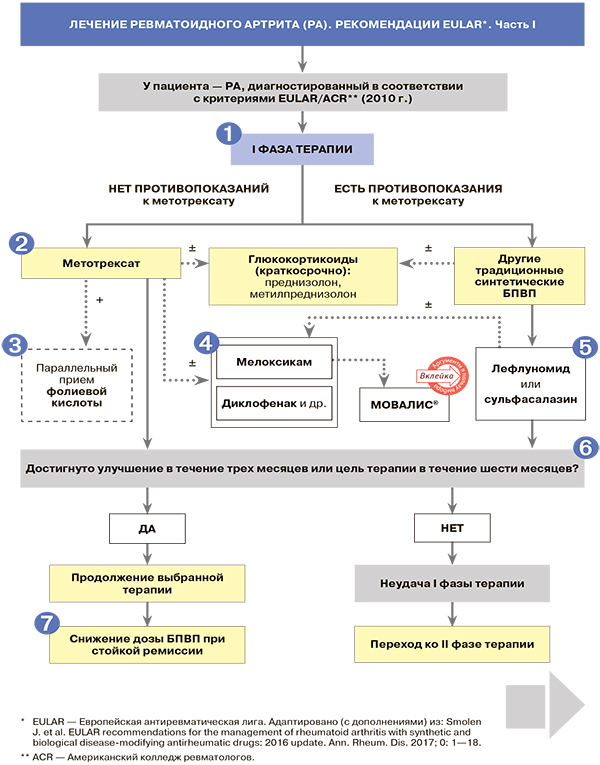
Лечение. Комментарии
1.
- Применение традиционных синтетических БПВП (метотрексат или лефлуномид/сульфасалазин) должно быть начато сразу после постановки диагноза ревматоидного артрита (РА). Отсрочка с назначением БПВП приводит к худшим исходам РА.
- У больных со стойким и/или эрозивным артритом терапия БПВП должна начинаться в первые три месяца от дебюта симптомов, даже если они формально не соответствуют диагностическим критериями РА.
2.
- Метотрексат должен назначаться всем пациентам с установленным диагнозом РА (уровень доказательности A) и недифференцированным артритом при высокой вероятности развития РА (С). На первом этапе определяется отсутствие (или наличие) противопоказаний к этому ЛС: активная инфекция, алкоголизм, выраженная печеночная недостаточность. Перед назначением препарата следует провести исследования сывороточных трансаминаз, альбумина, креатинина, клинический анализ крови, рентген органов грудной клетки, тесты на ВИЧ, гепатиты B/C и беременность.
- Минимальная терапевтическая доза метотрексата составляет 10 мг/нед., но при лечении РА она должна быть увеличена в течение первых же недель до 15 мг/нед. Далее дозировка корректируется (+2,5—5 мг каждые 2—4 недели) до 25—30 мг/нед. в зависимости от успеха лечения и переносимости препарата. При недостаточной эффективности (или плохой переносимости) таблеток метотрексата прежде, чем сменить терапию, следует перевести пациента на подкожную форму препарата (B). У больных с изначально высокой активностью РА рекомендуется стартовать с подкожной формы метотрексата (С).
3. На фоне лечения метотрексатом обязателен прием не менее 5—10 мг фолиевой кислоты в неделю (но не ранее, чем через 24 ч после приема метотрексата), что позволяет снизить риск нежелательных явлений.
4.
- НПВП как таковые не упоминаются в алгоритмах EULAR по ведению больных РА, что, однако, не отменяет оправданности их применения в качестве вспомогательного компонента лечения для уменьшения интенсивности воспаления в синовиальной оболочке, боли и скованности пораженных суставов.
- Согласно данным российских клинических рекомендаций по рациональному применению НПВП в клинической практике, ибупрофен, напроксен, индометацин могут конкурировать с низкодозной ацетилсалициловой кислотой (АСК) за связывание с активным центром ЦОГ-1 и нивелировать ее антиагрегантное действие. В то же время у мелоксикама, целекоксиба и кетопрофена не отмечено такого нежелательного взаимодействия с АСК.
Этот аспект немаловажен, потому что РА является одним из факторов развития сердечно-сосудистых заболеваний, то есть подбирать НПВП часто приходится коморбидному пациенту. Добавим, что согласно тем же рекомендациям, мелоксикам имеет и определенные преимущества в плане гастроинтестинальной переносимости: так, наряду с нимесулидом и ацеклофенаком, он реже других НПВП вызывает диспепсию и бессимптомные язвы.
5. В многочисленных исследованиях терапевтическая доза лефлуномида при РА определена как 20 мг/сут. Обычно используемая доза сульфасалазина для взрослых — 2,0 г/сут. в 2 приема. Для уменьшения риска побочных явлений рекомендуется постепенное наращивание дозы: 1-я неделя — 0,5 г ежедневно, 2-я — по 0,5 г 2 раза в день, 3-я — 0,5 г утром и 1 г вечером, с 4-й недели — по 1 г утром и вечером.
6. Целью терапии РА служит достижение стойкой ремиссии (DAS 28
7. Если у пациента наблюдается стойкая, длительная ремиссия, допустимо рассмотреть снижение дозы традиционного синтетического БПВП вплоть до полной его отмены.
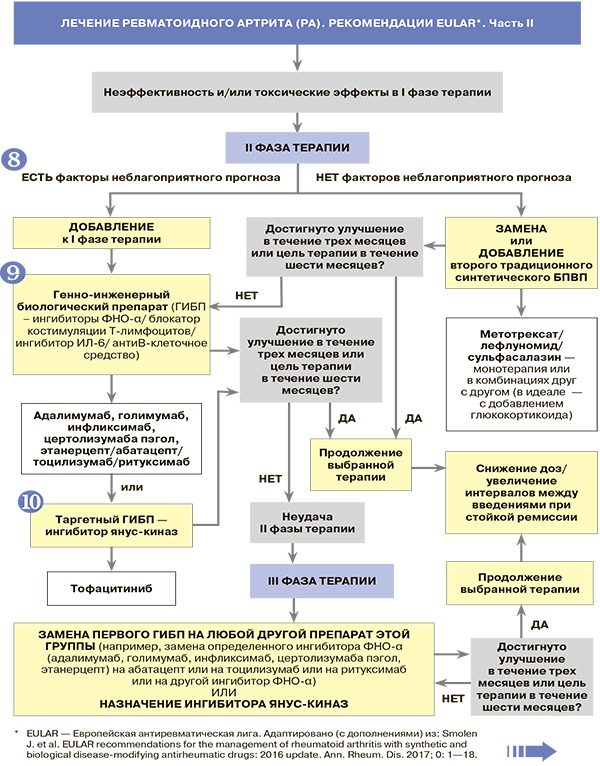
8. К факторам неблагоприятного прогноза при РА относятся РФ+/АЦЦП+ в высоких титрах, высокая активность РА (DAS28 > 5,1), ранние эрозии суставов.
9. Перед назначением генно-инженерных биопрепаратов (ГИБП) обязателен скрининг, нацеленный на исключение латентного туберкулеза, рентген органов грудной клетки в двух проекциях, анализ крови на ВИЧ, гепатиты В/С. Введение ГИБП проводится в центрах антицитокиновой терапии специально обученным и сертифицированным персоналом.
10. Если пациенту в рамках комбинированной терапии противопоказаны традиционные синтетические БПВП, то предпочтительным вариантом выбора для монотерапии РА EULAR-2016 признаны ингибитор интерлейкина-6 (тоцилизумаб) или ингибитор янус-киназ (тофацитиниб).
Источник
