Нимесулид при ревматоидном артрите

1. Насонов ЕЛ, Каратеев ДЕ, Чичасова НВ. Рекомендации EULAR по лечению ревматоидного артрита-2013: общая характеристика и дискуссионные проблемы. Научно-практическая ревматология. 2013;51(6):609–20. [Nasonov EL, Karateev DE, Chichasova NV. EULAR recommendations for the treatment of rheumatoid arthritis-2013: general characteristics and disputable problems. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2013;51(6):609–20. (In Russ.)]. DOI: https://dx.doi.org/10.14412/1995-4484-2013-609-22
2. Ziegler S, Huscher D, Karberg K, et al. Trends in treatment and outcomes of rheumatoid arthritis in Germany 1997–2007: results from the National Database of the German Collaborative arthritis Centers. Ann Rheum Dis. 2010 Oct;69(10):1803–8. doi: 10.1136/ard.2009.122101. Epub 2010 May 6.
3. Crofford LJ. Use of NSAIDs in treating patients with arthritis. Arthritis Res Ther. 2013;15 Suppl 3:S2. doi: 10.1186/ar4174. Epub 2013 Jul 24.
4. Simon LS. Nonsteroidal anti-inflammatory drugs and their risk: a story still in evelopment. Arthritis Res Ther. 2013;15 Suppl 3:S1. doi: 10.1186/ar4173. Epub 2013 Jul 24.
5. Hochberg MC. New directions in symptomatic therapy for patients with osteoarthritis and rheumatoid arthritis. Semin Arthritis Rheum. 2002;15:4–14. doi: 10.1053/sarh.2002.37215.
6. Emery P. Considerations for nonsteroidal anti-inflammatory drug therapy: benefits. Scand J Rheumatol. 1996; 25 (suppl.105):5–12.
7. Kvien TK, Greenwald M, Peloso PM, et al. Do COX-2 inhibitors provide additional pain relief and anti-inflammatory effects in patients with rheumatoid arthritis who are on biological disease-modifying anti-rheumatic drugs and/or corticosteroids? Post-hoc nalyses
8. from a randomized clinical trial with etoricoxib. BMC Musculoskelet Disord. 2015 Feb 13;16(1):26.
9. Moore RA, Derry S, Wiffen PJ, et al. Overview review: comparative efficacy of oral ibuprofen and paracetamol (acetaminophen) across acute and chronic pain condition. Eur J Pain. 2014 Dec 22. doi: 10.1002/ejp.649. Epub ahead of print.
10. Pincus T, Koch G, Lei H, et al. Patient Preference for Placebo, Acetaminophen (paracetamol) or Celecoxib Efficacy Studies (PACES): two randomised, double blind, placebo controlled, crossover clinical trials in patients with knee or hip osteoarthritis. Ann Rheum Dis. 2004 Aug;63(8):931–9. Epub 2004 Apr 13.
11. Bjordal J, Klovning A, Ljunggren A, Slшrdal L. Short-term efficacy of harmacotherapeutic interventions in osteoarthritic knee pain: A meta-analysis of randomised placebo-controlled trials. Eur J Pain. 2007 Feb;11(2):125–38. Epub 2006 May 8.
12. Rainsford KD. Anti-inflammatory drugs in the 21st century. Subcell Biochem. 2007;42:3–27.
13. Camu F1, Shi L, Vanlersberghe C. The role of COX-2 inhibitors in pain modulation. Drugs. 2003;63 Suppl 1:1–7.
14. Mehta V, Johnston A, Cheung R, et al. Intravenous parecoxib rapidly leads to COX-2 inhibitory concentration of valdecoxib in the central nervous system. Clin Pharmacol Ther. 2008 Mar;83(3):430–5. Epub 2007 Aug 8.
15. Dembo G, Park SB, Kharasch ED. Central nervous system concentrations of cyclooxygenase-2 inhibitors in humans. Anesthesiology. 2005 Feb;102(2):409–15.
16. Bianchi M, Martucci C, Ferrario P, et al. Increased tumor necrosis factor- and prostaglandin E2 concentrations in the cerebrospinal fluid of rats with inflammatory hyperalgesia: the effects of analgesic drugs. Anesth Analg. 2007 Apr;104(4):949–54.
17. Goldstein JL, Cryer B. Gastrointestinal injury associated with NSAID use: a case study and review of risk factors and preventative strategies. Drug Healthc Patient Saf. 2015 Jan 22;7:31–41. doi: 10.2147/DHPS.S71976. eCollection 2015.
18. Harirforoosh S, Asghar W, Jamali F. Adverse effects of nonsteroidal antiinflammatory drugs: an update of gastrointestinal, cardiovascular and renal complications. J Pharm Pharm Sci. 2013;16(5):821–47.
19. Lanas A, Boers M, Nuevo J. Gastrointestinal events in at-risk patients starting non-steroidal anti-inflammatory drugs (NSAIDs) for rheumatic diseases: the EVIDENCE study of European routine practice. Ann Rheum Dis. 2015 Apr;74(4):675–81. doi: 10.1136/annrheumdis-2013-204155. Epub 2013 Dec 18.
20. Burmester G, Lanas A, Biasucci L, et al. The appropriate use of non-steroidal ntiinflammatory drugs in rheumatic disease: opinions of a multidisciplinary European expert panel. Ann Rheum Dis. 2011 May;70(5):818–22. doi: 10.1136/ard.2010. 128660. Epub 2010 Sep 10.
21. Cannon C, Curtis S, FitzGerald G, et al. Cardiovascular outcomes with etoricoxib and diclofenac in patients with osteoarthritis and rheumatoid arthritis in the Multinational Etoricoxib and Diclofenac Arthritis Longterm (MEDAL) programme: a randomised comparison. Lancet. 2006 Nov 18;368(9549):1771–81.
22. Lindhardsen J, Gislason GH, Jacobsen S, et al. Non-steroidal anti-inflammatory drugs and risk of cardiovascular disease in patients with rheumatoid arthritis: a nationwide cohort study. Ann Rheum Dis. 2013 Jun 8. Epub ahead of print.
23. Goodson NJ, Brookhart AM, Symmons DP, et al. Non-steroidal antiinflammatory drug use does not appear to be associated with increased cardiovascular mortality in patients with inflammatory polyarthritis: results from a primary care based inception cohort of patients. Ann Rheum Dis. 2009 Mar;68(3):367–72. doi: 10.1136/ard.2007.076760. Epub 2008 Apr 13.
24. Franklin J, Farragher TM, Lunt M, et al. Excess risk of hospital admission for ardiovascular disease within the first 7 years from onset of inflammatory polyarthritis. Ann Rheum Dis. 2010 Sep;69(9):1660–4. doi: 10.1136/ard.2009.121871. Epub 2010 May 24.
25. Насонов ЕЛ. Эффективность и переносимость нестероидного противовоспалительного препарата. Нимесулид: новые данные. Русский Медицинский Журнал. 2001;(15):6–8. [Nasonov EL. The efficacy and tolerability of a nonsteroidal anti-inflammatory drug. Nimesulide: new data. Russkii Meditsinskii Zhurnal. 2001;(15):6–8. (In Russ.)].
26. Балабанова РМ., Белов БС, Чичасова НВ и др. Эффективность нимесулида при ревматоидном артрите. Фарматека. 2004;(7):55–8. [Balabanova RM., Belov BS, Chichasova NV, et al. The efficacy of nimesulide in rheumatoid arthritis. Farmateka. 2004;(7):55–8. (In Russ.)].
27. Rainsford KD; Members of the Consensus Report Group on Nimesulide. Nimesulide – a multifactorial approach to inflammation and pain: scientific and clinical consensus. Curr Med Res Opin. 2006 Jun;22(6):1161–70.
28. Bennett A. Nimesulide a well established cyclooxygenase-2 inhibitor with many other pharmacological properties relevant to inflammatory diseases. In: Therapeutic Roles of Selective COX-2 Inhibitors. Vein JR, Botting RM, editors. William Harvey Press: 524–40.
29. Pelletier JP, Mineau F, Fernandes J, et al. Two NSAIDs, nimesulide and naproxen, can reduce the synthesis of urokinase and IL-6 while increasing PAI-1, in human OA synovial fibroblasts. Clin Exp Rheumatol. 1997 Jul-Aug;15(4):393–8.
30. Barracchini A, Franceschini N, Amicosante G, et al. Can non-steroidal antiinflammatory drugs act as metalloproteinase modulators? An in vitro study of inhibition of collagenase activity. J Pharm Pharmacol. 1998 Dec;50(12):1417–23.
31. Wober W. Comparative efficacy and safety of nimesulide and diclofenac in patients with acute shoulder, and a meta-analysis of controlled studies with nimesulide. Rheumatology (Oxford). 1999 May;38 Suppl 1:33–8.
32. Pohjolainen T, Jekunen A, Autio L, Vuorela H. Treatment of acute low back pain with the COX-2-selective anti-inflammatory drug nimesulide: results of a randomized, double-blind comparative trial versus ibuprofen. Spine (Phila Pa 1976). 2000 Jun 15;25(12):1579–85.
33. Барскова ВГ, Якунина ИА, Насонова ВА. Применение нимесила при подагрическом артрите. Терапевтический архив. 2003;(5):60–4. [Barskova VG, Yakunina IA, Nasonova VA. The use of Nimesil in gouty arthritis. Terapevticheskii arkhiv. 2003;(5):60–4. (In Russ.)].
34. Каратеев АЕ, Каратеев ДЕ, учихина ЕЛ и др. Эффективность и безопасность монотерапии высокими дозами НПВП при раннем артрите. Русский Медицинский Журнал. 2006;(16):24–9. [Karateev AE, Karateev DE, Luchikhina EL, et al. The efficacy and safety of monotherapy with high doses of NSAIDs in early arthritis. Russkii Meditsinskii Zhurnal. 2006;(16):24–9. (In Russ.)].
35. Bradbury F. How important is the role of the physician in the correct use of a drug? An observational cohort study in general practice. Int J Clin Pract Suppl. 2004 Oct;(144):27–32.
36. Conforti A, Leone R, Moretti U, et al. Adverse drug reactions related to the use of NSAIDs with a focus on nimesulide: results of spontaneous reporting from a Northern Italian area. Drug Saf. 2001;24(14):1081–90.
37. Laporte JR, Ibanez L, Vidal X, et al. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents. Drug Saf. 2004;27(6):411–20.
38. Минушкин ОН. Использование препарата «Найз» у больных, страдающих сочетанной патологией суставов и поражением верхних отделов желудочно-кишечного тракта. Научо-практическая ревматология. 2003;(5):72–6. [Minushkin ON. The use Nise in patients with combined pathology of the joints and lesions of the upper gastrointestinal tract. Naucho-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2003;(5):72–6. (In Russ.)].
39. Каратеев АE, Каратеев ДE, Насонов ЕЛ. Гастродуоденальная переносимость нимесулида (НИМЕСИЛ, BerlinChemie) у больных с язвенным анамнезом: первое проспективное исследование безопасности селективных ЦОГ-2-ингибиторов у больных с высоким риском развития НПВП-индуцированных гастропатий. Научно-практическая ревматология. 2003;(1):45-8. [Karateev AE, Karateev DE, Nasonov EL. Gastroduodenal safety of Nimesulid (Nimesil, Berlin Chemie) in rheumatic patients with history of ulcer. Nauchnoprakticheskaya revmatologiya = Rheumatology Science and Practice. 2003;(1):45–8. (In Russ.)]. DOI: https://dx.doi.org/10.14412/1995-4484-2003-1132
40. Helin-Salmivaara A, Virtanen A, Veslainen R, et al. NSAID use and the risk of hospitalisation for first myocardial infarction in the general population: a national asecontrol study from Finland. Eur Heart J. 2006 Jul;27(14):1657–63. Epub 2006 May 26.
41. Барскова ВГ, Насонова ВА, Цапина ТН и др. Эффективность и безопасность применения нимесила у больных с подагрическим артритом. Клиническая медицина. 2004;82(12):49–54. [Barskova VG, Nasonova VA, Tsapina T, et al. The efficacy and safety of Nimesil in patients with gouty arthritis. Klinicheskaya meditsina. 2004;82(12):49–54. (In Russ.)].
42. Lü cker PW, Pawlowski C, Friedrich I, et al. Double-blind, randomised, multi-centre clinical study evaluating the efficacy and tolerability of nimesulide in comparison with etodalac in patients suffering from osteoarthritis of the knee. Eur J Rheumatol Inflamm. 1994;14(2):29–38.
43. Huskisson E, Macciocchi A, Rahlfs V, et al. Nimesulide versus diclofenac in the treatment of osteoarthritis of the hip or knee: an active controlled equivalence study. Curr Ther Res. 1999;60:253–65.
44. Kriegel W, Korff KJ, Ehrlich JC, et al. Double-blind study comparing the long-term efficacy of the COX-2 inhibitor nimesulide and naproxen in patients with osteoarthritis. Int J Clin Pract. 2001 Oct;55(8):510–4.
45. Каратеев АЕ. Российский опыт применения нимесулида: обзор клинических испытаний. Consilium medicum. 2011;13(9):89–95. [Karateev AE. Russian experience of nimesulide: an overview of clinical trials. Consilium medicum. 2011;13(9):89–95. (In Russ.)].
46. Каратеев АЕ, Алексеева ЛИ, Братыгина ЕА, Аширова ТБ. Оценка частоты развития побочных эффектов при длительном применении нимесулида в реальной клинической практике. Русский Медицинский Журнал. 2009;17(21):1466–72. [Karateev E, Alekseeva LI, Bratygina EA, Ashirova TB. The frequency of side effects with long-term use of nimesulide in real clinical practice. Russkii Meditsinskii Zhurnal. 2009;17(21):1466–72. (In Russ.)].
47. Каратеев АЕ. Сравнительная оценка влияния нимесулида на верхние отделы желудочно-кишечного тракта. Лечащий врач. 2014;(7):51–5. [Karateev AE. Comparative evaluation of the effect of nimesulide on the upper gastrointestinal tract. Lechashchii vrach. 2014;(7):51–5. (In Russ.)].
48. Boelsterli UA. Nimesulide and hepatic adverse affects: roles of reactive metabolites and host factors. Int J Clin Pract Suppl. 2002 Jul;(128):30–6.
49. Boelsterli UA. Mechanisms of NSAIDinduced hepatotoxicity: focus on nimesulide. Drug Saf. 2002;25(9):633–48.
50. Assessment report for Nimesulide containing medicinal products for systemic use. 20 January 2012 EMA/73856/2012 На сайте: https://www.ema.europa.eu
51. Irish Board Suspends Marketing of Drugs Containing Nimesulide https://www.imb.ie.
52. Press release. European Medicines Agency recommends restricted use of nimesulid- containing medicinal products. Doc. Ref. EMEA/432604/2007 На сайте: https://www.emea.europa.eu.
53. Press release. 23/06/2011 European Medicines Agency concludes review of systemic nimesulide-containing medicines. На сайте: https://www.ema.europa.eu/ema/
54. Traversa G, Bianchi C, Da Cas R, et al. Cohort study of hepatotoxity associated with nimesulide and other non-steroidal antiinflammatory drugs. BMJ. 2003 Jul 5;327(7405):18–22.
55. Lee CH, Wang JD, Chen PC. Increased risk of hospitalization for acute hepatitis in patients with previous exposure to NSAIDs. Pharmacoepidemiol Drug Saf. 2010 Jul;19(7):708–14. doi: 10.1002/pds.1966.
56. Gulmez SE, Larrey D, Pageaux GP, et al. Transplantation for acute liver failure in patients exposed to NSAIDs or paracetamol (acetaminophen): the multinational casepopulation SALT study. Drug Saf. 2013 Feb;36(2):135–44. doi: 10.1007/s40264-012- 0013-7.
57. Романов БК. Клинические исследования эффективности и безопасности препарата Нимулид. На сайте: https://www.coralmed-corp.ru [Romanov BK. Clinical studies of the efficacy and safety of Nimulid. https://www.coralmed-corp.ru (In Russ.)].
58. Балабанова РМ, Гришаева ТП, Степанец ОВ. Эффективность и переносимость нимулида у больных ревматическими заболеваниями. Научно-практическая ревматология. 2004;(1):48–50. [Balabanova RM, Grishaeva TP, Stepanets OV. Nimulid efficacy and tolerability in patients with rheumatic diseases. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2004;(1):48–50. (In Russ.)]. DOI: https://dx.doi.org/10.14412/1995-4484-2004-1383
59. Коган КМ, Золотарева ГД, Бернштейн ИЛ и др. Опыт применения препаратов НИМУЛИД и КОНДРОнова® окружными специалистами и врачамиревматологами г. Москвы. Научно-практическая ревматология. 2005;(4):58–62. [Kogan KM, Zolotareva GD, Bernshtein IL, et al. Practical expirience of nimulid and CONDROnova® administration by District specialists and rheumatologists of Moscow. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2005;(4):58–62. (In Russ.)]. DOI: ttp://dx.doi.org/10.14412/1995-4484- 2005-619
60. Каратеев АЕ, Насонов ЕЛ, Яхно НН и др. Клинические рекомендации «Рациональное применение нестероидных противовоспалительных препаратов (НПВП) в клинической практике». Современная ревматология. 2015;(1):4–23. [Karateev AE, Nasonov EL, Yakhno NN, et al. Clinical guidelines «Rational use of nonsteroidal antiinflammatory drugs (NSAIDs) in clinical practice». Sovremennaya revmatologiya = Modern Rheumatology Journal. 2015;(1):4–23. (In Russ.)]. DOI: https://dx.doi.org/10.14412/1996-7012-2015-1-4-23.
Источник
Заболевания суставов различной локализации являются одной из самых
частых причин обращения к врачу наряду с артериальной
гипертензией. Заболевания суставов являются социально значимыми
болезнями.
Во-первых, эти заболевания поражают значительную часть населения.
Наиболее распространенным заболеванием суставов является деформирующий
остеоартроз (ОА), особенно у лиц старше 65 лет, когда его
распространенность достигает 97% населения. Среди хронических
воспалительных заболеваний суставов наиболее частым является
ревматоидный артрит (РА) — заболевание, практически облигатно
приводящее к инвалидизации больных уже через 3–5 лет от дебюта
болезни.
Во-вторых, эти заболевания характеризуют развитие стойкого болевого
синдрома, который может быть связан с различными причинами.
Наиболее частая причина боли при патологии суставов — развитие
синовиита. Однако при ОА развитие боли может быть связано
и с другими патогенетическими звеньями болезни. В норме
болевые окончания имеют все структуры сустава, за исключением хряща. Но
при ОА происходит частичная васкуляризация и иннервация хряща.
Истончение и повреждение хряща снижает его амортизационные
свойства, увеличивается нагрузка на субхондральную кость
с развитием ее отека и боли. Кроме того, фибрилляция хряща
также индуцирует боль и воспаления.
Данные, полученные при изучении влияния боли на прогноз при ОА, свидетельствуют:
Около 20% больных не получают
адекватного лечения хронического болевого синдрома, так что уровень
боли у них по 10-сантиметровой визуальной аналоговой шкале (ВАШ)
составляет 5 см и более [1].Хроническая боль при ОА приводит к уменьшению продолжительности жизни женщин в среднем на 10–12 лет.
Продолжительность жизни пожилых больных с ОА в большей
степени зависит от интенсивности боли, чем от наличия сопутствующих
потенциально жизнеугрожающих заболеваний [2].Риск прогрессирования ОА
в равной степени связан с болевым синдромом, как
и с рентгенологическими изменениями.
Нестероидные противовоспалительные препараты (НПВП) обладают
анальгетическим, противовоспалительным и жаропонижающим эффектами.
Поэтому они являются незаменимыми в лечении артрологических
заболеваний. Быстрое развитие обезболивающего эффекта и определяет
облигатность их применения в лечении суставной патологии.
Позитивный лечебный эффект НПВП связан с ингибицией ЦОГ-2. Этот
фермент, участвующий в каскаде распада поврежденных при воспалении
и других поражениях клеточных мембран, отвечает за выделение
провоспалительных простагландинов и других медиаторов воспаления
не только в суставах, но и в других органах
и тканях, в первую очередь в стенках сосудов. Исходя из
вышесказанного, становится ясно, что использование селективных
ингибиторов ЦОГ-2 имеет важное клиническое и социальное значение.
В клинической практике селективные ингибиторы ЦОГ-2 заняли прочное
место, хотя до сих пор не весь потенциал их возможностей используется
практическими врачами. Нередко возникают «мифы» об их потенциальной
токсичности, в первую очередь в отношении сердечно-сосудистой
системы. В западной литературе была опубликована информация
о гепатотоксичности нимесулидов, основанная на единичных
и плохо документированных клинических случаях. Эти аспекты
хотелось особо обсудить в данном сообщении, взяв в качестве
примера препарат «Найз».
Препарат «Найз» относится к селективным ингибиторам ЦОГ-2, что
доказано в исследованиях in vivo [7] и in vitro на
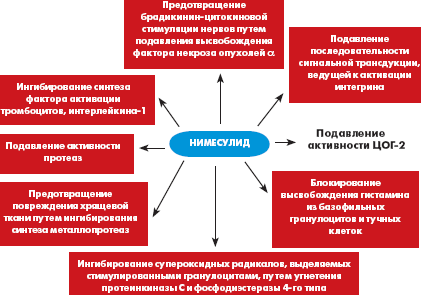
молекулярных моделях [6]. Кроме того, препарат обладает еще несколькими
важными механизмами действия (рис.). Наибольший опыт применения
препарата «Найз» в ревматологической практике в Российской
Федерации накоплен в лечении больных с ОА. Больные ОА, как
правило, имеют высокий риск развития желудочно-кишечных осложнений
в связи с возрастом, частым наличием сопутствующей
сосудистой, кардиальной, ренальной патологии и необходимостью
использовать сопутствующую терапию. Найз обычно используется этой
категорией больных в суточной дозе 200 мг/сутки. Это
обеспечивает достижение клинического эффекта у 87% [8] — 93%
[9] больных при хорошей переносимости Найза в отношении
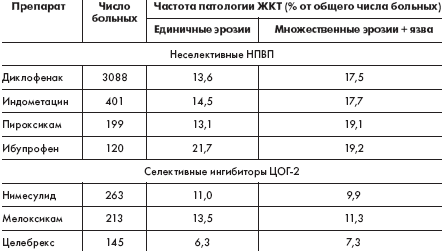
желудочно-кишечного тракта, как по отечественным данным (табл. 1), так
и по данным зарубежных контролируемых исследований,
постмаркетингового изучения переносимости нимесулида в 17 странах
у 118 831 385 больных [10–13].
В нашем исследовании участвовало 40 больных с ОА
(32 больных) и с РА (8 больных), в возрасте от 49
до 79 лет (58,8 ± 18,3 года), страдающих
артериальной гипертензией более чем 5 лет, получающих стабильную
дозу антигипертензивных препаратов в течение не менее
6 месяцев, без явных проявлений сердечной недостаточности.
Большинство больных получали ингибиторы АПФ (эналаприл
10–30 мг/сутки) — 28 больных, β-адреноблокаторы
(пропранолол 20–40 мг/сутки) — 12 больных. Всем больным
после 3-дневного периода перерыва в приеме НПВП (ибупрофен,
мелоксикам, кетопрофен, диклофенак) назначался рандомизировано либо
диклофенак в дозе 100–150 мг/сутки, либо Найз в дозе
200–400 мг/сутки на 20 дней. АД регистрировалось 6 раз
в сутки: после пробуждения, перед первым приемом
антигипертензивных или нитратных препаратов, через 2 часа после их
приема и далее еще 3 раза с равными промежутками
в течение всего периода «отмывки», первую и последнюю неделю
приема НПВП, в остальное время исследования АД регистрировалось
4 раза в сутки каждые 3 часа с момента пробуждения.
Пациенты в течение периода исследования вели дневник
с указанием АД, приема антигипертензивных препаратов
и нежелательных реакций. Статистическая обработка проводилась
методом сопряженных пар.
Практически у всех больных обеих групп к концу периода
«отмывки» отмечалось увеличение среднесуточного АД (табл. 2). Тем
не менее, в течение 1-й недели лечения (табл. 2), различия
в среднем систолическом давлении были достоверно больше при приеме
диклофенака, а на фоне Найза практически не отличались от
исходного (p < 0,001). В меньшей степени на фоне
диклофенака в течение 1-й недели лечения увеличилось
среднесуточное диастолическое АД (ДАД) — на 3,31 ± 5,42;
увеличение этого параметра к концу 1-й недели лечения Найзом не
зарегистрировано. У 16 из 20 больных, получавших диклофенак,
отмечено негативное влияние препарата на течение артериальной
гипертензии — повышение систолического и/или диастолического
давления, сопровождавшееся неприятными субъективными ощущениями —
головная боль, кардиалгии (16), развитие гипертонического криза
(2 больных — отмена диклофенака через 6–14 дней приема),
увеличение потребности в приеме антигипертензивных препаратов
(6 больных). Среди больных, получавших Найз, не отмечено случаев
увеличения потребности в антигипертензивной терапии
и значимого изменения уровня АД, так что все 20 больных
закончили 3-недельный период лечения. Диклофенак был отменен
8 больным в связи с изменением течения артериальной
гипертензии: развитие гипертонического криза (2 пациента)
и нарастание уровня АД как систолического, так
и диастолического (2 больных), что потребовало увеличения
дозы эналаприла у обеих больных; у 2 больных
в связи с гастралгиями, у 1 больного из-за диареи;
у 1 больной из-за головной боли. Увеличение среднесуточного
систолического давления у больных, закончивших лечение
диклофенаком, было статистически достоверным и составило
15,74 ± 11,0; к концу лечения Найзом —
1,71 ± 5,22 (р > 0,05). Известно, что изменение
систолического АД (САД) является более важным фактором риска
кардиоваскулярной патологии, чем изменение ДАД [19]. Уменьшение уровня
САД на 12 мм рт. ст. снижает риск развития инфаркта миокарда на
27%, усугубления застойной сердечной недостаточности на 55%
и инсульта на 56% [19, 20].

Аналогичные результаты продемонстрированы в исследовании
В. И. Мазурова и соавт. [21], сравнивших гемодинамические
показатели у больных ОА (n = 40), имеющих
(23 пациента) или не имеющих (17 пациентов) сопутствующую
артериальную гипертензию (АГ), при назначении Найза или диклофенака на
1 месяц. Пациенты всех подгрупп были сопоставимы по локализации
ОА, рентгенологической стадии. Пациенты, имевшие ОА в сочетании
с АГ, были примерно на 10 лет старше больных
с нормальным уровнем АД. Доза Найза составляла 200 мг/сутки
и диклофенака — 100 мг/сутки. Для лечения АГ всем
больным второй подгруппы был назначен Ренитек (эналаприл) по
5–10 мг 2 раза в сутки. Всем больным до назначения НПВП
и через 1 месяц помимо клинического осмотра и оценки
боли (по шкале ВАШ) проводились ЭКГ, суточное мониторирование АД,
импедансометрическая кардиография (ИМК), определение уровня
десквамированных эндотелиоцитов в периферической крови по методике
Hladovec J. и соавт. (1978), определение состояния
эндотелий-зависимой и эндотелий-независимой (проба
с нитроглицерином) вазодилятации (ЭЗВД, ЭНВД соответственно)
плечевой артерии с помощью ультразвука высокого разрешения.
Через один месяц лечения статистически значимых различий
в уменьшении боли по ВАШ на фоне приема Найза или диклофенака не
отмечено (p > 0,05). Данные средних параметров суточного
мониторирования АД представлены в табл. 3 и 4.
При назначении Найза больным ОА без АГ (группа 1А) среднее суточное САД
и среднее дневное САД и ДАД повышались в пределах
нормальных значений без субъективных ощущений. В группе 1Б,
получавшей диклофенак, отмечено более значимое увеличение
систолического и ДАД, как среднесуточного, так
и среднедневного (p < 0,05), что сопровождалось
ухудшением самочувствия больных, а в одном случае
потребовалось назначение гипотензивной терапии.
В группе больных с ОА и АГ, получавших Найз (2А),
статистически значимого увеличения уровня АД не было зарегистрировано,
а при лечении диклофенаком (группа 2Б) достоверно увеличились
уровень среднесуточного САД (p < 0,01), среднедневного САД
(p < 0,05), при этом индекс площади САД за сутки
увеличился более чем в 2 раза (p < 0,05),
а ДАД — почти в 3 раза (p < 0,05), что
свидетельствует о стабильности повышения АД в течение суток.
Эти изменения АД сопровождались ухудшением самочувствия больных,
появлением одышки, отеков нижних конечностей, потребовалась коррекция
гипотензивной терапии (увеличение дозы Ренитека или применение
комбинированной терапии).
При изучении параметров системной гемодинамики в подгруппах
больных, получавших Найз, их существенных изменений выявлено не было.
В подгруппе пациентов с исходно нормальным уровнем АД,
получавших диклофенак, отмечалось достоверное (p < 0,05)
увеличение общего периферического сопротивления (ОПСС), снижение
параметров, отражающих общую производительность сердца: сердечный
индекс (СИ) и ударный индекс (УИ), а также существенное
увеличение объемов внеклеточной жидкости. Еще более значимая
отрицательная динамика показателей системной гемодинамики выявлена
у больных с АГ, получавших диклофенак. При сравнительном
исследовании влияния Найза и диклофенака на функцию эндотелия
у больных ОА с АГ было установлено, что прием Найза не влиял
на показатели ЭЗВД и ЭНВД, тогда как при лечении диклофенаком были
получены статистически значимые (p < 0,05) изменения ЭЗВД,
ЭНВД и количества десквамированных эндотелиоцитов. Эти данные
свидетельствуют, что неселективный ингибитор ЦОГ диклофенак достоверно
ухудшал функцию эндотелия, хотя механизмы такого влияния остаются
неясными и требуют дальнейшего изучения.
Эти данные еще раз подтверждают, что применение селективных ингибиторов
ЦОГ-2, к которым относится препарат «Найз», положительно влияют на
состояние эндотелия сосудов. У больных с риском развития
тромбозов эти препараты должны назначаться совместно с низкими
дозами Аспирина. Такое сочетание может привести к увеличению
частоты осложнений со стороны ЖКТ, поэтому эти больные должны тщательно
наблюдаться с эндоскопическим исследованием состояния ЖКТ
и мониторингом параметров гемодинамики, проведением
профилактических мероприятий (табл. 5).

Препарат «Найз» является эффективным противовоспалительным препаратом.
Как и для всех НПВП, его эффективность является дозозависимой. При
лечении больных ОА, как правило, бывает достаточным назначение его
в дозе 200 мг/сутки, что обеспечивает и анальгетический,
и противовоспалительный эффект. Как уже упоминалось выше, ЦОГ-2
ингибиторы в отличие от классических НПВП не оказывают
отрицательного влияния на суставной хрящ. Кроме того, нимесулид
в спектре своего механизма действия имеет ингибицию IL-1b [22],
ингибицию апоптоза хондроцитов [23], подавление активности
металлопротеаз [24], что подтверждает отсутствие у него
отрицательного влияния на суставной хрящ. При хронических
воспалительных заболеваниях суставов, таких как РА или псориатический
артрит (ПсА), выраженность синовита может во много раз превышать
таковую при ОА, что требует индивидуального подбора суточной дозы Найза
от 200 до 400 мг/сутки. Увеличение его эффективности при
увеличении суточной дозы при РА была показана отечественными авторами,
а при ПсА зарубежными авторами [25].
Таким образом, препарат «Найз» зарекомендовал себя активным НПВП, при
индивидуальном подборе его дозы количество больных «ответчиков»
достигает 93% в сочетании с хорошей переносимостью.
По вопросам литературы обращайтесь в редакцию.
Н. В. Чичасова, доктор медицинских наук, профессор
Г. Р. Имаметдинова
Е. Л. Насонов, доктор медицинских наук, профессор, академик РАМН
ММА им. И. М. Сеченова, Москва
Источник
