Причина судорог при ревматоидном артрите
Болезненность суставом является признаком ревматоидного артрита (РА), но что насчет мышечных судорог в руках? Могут ли они быть симптомом артрита или, возможно, осложнения заболевания вызывают болезненные мышечные спазмы? Читайте дальше, чтобы узнать больше.
Многие испытывали неудобное чувство, когда мышцы рук напрягаются или начинают неуправляемо сокращаться и, чтобы вы не делали, не получается их расслабить. Это случается неожиданно — когда вы что-то записываете, печатаете письмо, набираете текст или во время работы в саду, готовки или выполнения какой-либо другой задачи.
Частые причины судорог рук
Появляясь в руке, ноге или другой части тела, судороги часто связаны с мышечной усталостью, и бывают вызваны множеством триггеров. Судороги часто происходят в связи с обезвоживанием, нарушением электролитного баланса, чрезмерным использованием мышц, либо недостаточной активностью.
Если у вас ревматоидный артрит, вы можете задуматься, могут ли судороги рук иметь какое-либо отношение к болезни. Ответ заключаются в том, что это очень вполне возможно.
Судороги в руках и РА
Мышечные судороги в руках — очень частый симптом, описываемый пациентами с ревматоидным артритом. Воспаление суставов и сухожилий в смежных мышцах может влиять на работу мышц, делая пациентов с РА более склонными к мышечным судорогам. А жесткость в суставах, с которой сталкиваются люди с ревматоидным артритом, может имитировать мышечную судорогу, поэтому иногда бывает трудно различить эти два состояния.
Хотя мышечные спазмы могут причинять неудобство, они редко вызывают серьезные осложнения. Вы можете заметить, что спазмы ухудшаются при определенных условиях, например, при более холодной температуре, в периоды повышенного воспаления суставов, когда вы не используете руки продолжительное время (в результате чего мышцы ослабляются), или после повторяющихся действий, как ввод текста или текстовых сообщений в телефоне, напрягающих мышцы рук.
Как облегчить судороги рук
Что можно сделать, когда наступает мышечная судорога? Попробуйте следующие методы:
- Аккуратное растяжение Чтобы помочь судороге пройти, попробуйте простую растяжку для руки. Используя противоположную руку, мягко отодвигайте назад все пальцы на руке затронутой судорогой, и медленно массируйте напряженную мышцу.
- Тепло Тепловая пленка может также помочь расслабить жесткие мышцы, но не волнуйтесь, если у вас ее нет — просто поднесите руки под теплую воду. Или импровизируйте, сами сделав теплый компресс: Заполните носок сырым рисом, завяжите наверху узел и нагрейте его в микроволновой печи в течение минуты.
Также возможно, что некоторые лекарства могут косвенно помочь облегчить спазмы мышц путем лечения воспаления.
Остановить судороги, прежде чем они начнутся
Однако лучше всего предотвратить мышечные судороги еще до их начала. Поддержание силы мышц рук поможет предотвратить мышечную усталость, поэтому упражнения могут уменьшить частоту возникновения судорог в долгосрочной перспективе. Попробуйте повторное постукивание пальцев (постукивайте большим пальцем по каждому пальцу руки) или сжимайте эспандер или резиновый шар.
Если мышечные спазмы или боли в руках сохраняются, часто возникают или мешают повседневной деятельности, проконсультируйтесь с врачом. Он может обнаружить признаки основных заболеваний и состояний, таких как плохое кровообращение, обезвоживание, плохое питание, заболевания почек или дисбаланс электролитов, связанный с приемом лекарств. В некоторых случаях мышечная атрофия может быть связана с травмой, аномалиями мышц или неврологическим заболеванием.
Источник
Ревматоидный артрит (РА) – хроническое системное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу эрозивно-деструктивного полиартрита, с возможным развитием полиорганного поражения и тяжелых осложнений, таких как вторичный амилоидоз. РА представляет собой наиболее распространенное аутоиммунное заболевание, регистрируется во всех странах мира и во всех климатогеографических зонах, во всех возрастных, расовых и этнических группах, поражая 0,5–2% взрослого населения в наиболее работоспособном возрасте – 35–55 лет [1–3]; женщины болеют чаще чем мужчины (соотношение женщин и мужчин 3:1). По данным 2012 г., заболеваемость РА в РФ составляет 241,3 на 100 тыс. населения [4].
Основными клиническими проявлениями РА являются суставные поражения в виде эрозивного артрита с болью и припухлостью пораженных суставов, утренняя скованность, образование ревматических узелков. В развернутых стадиях заболевания возникают деформации пораженных суставов, повреждения связочного аппарата и синовиальной сумки. Помимо поражения суставов для пациентов с РА характерно развитие системных внесуставных проявлений, таких как ревматоидный васкулит, плеврит, перикардит, синдром Фелти, периферическая полиневропатия, поражение глаз, гломерулонефрит [5].
Наиболее характерным проявлением заболевания, наряду с прогрессирующим поражением суставов, потерей подвижности, утомляемостью, внесуставными проявлениями, является хронический болевой синдром, локализованный обычно в области суставов. Именно хронический болевой синдром служит ведущей жалобой пациентов и оказывает решающее влияние на снижение качества жизни. Боль рассматривают как показатель активности болезни, и в то же время активность заболевания не всегда является предиктором интенсивности боли и нарушения функции суставов.
Неврологические нарушения при РА
В настоящее время существует ряд клинико-экспериментальных исследований, демонстрирующих роль неврогенных механизмов в патогенезе болевого синдрома при РА [6–8]. Наряду с клиническими признаками воспаления у пациентов с РА наблюдаются специфические сенсорные феномены, характерные для невропатической боли [9–11].
Среди неврологических нарушений при РА наиболее часто выявляется поражение периферической нервной системы (ПНС) [12]. Американскими ревматологами было проведено клиническое, электрофизиологическое и патоморфологическое исследование ПНС у 108 больных РА. У 62 обследованных (57,4%) выявлены электрофизиологические доказательства наличия невропатии. Среди них 53 (85,5%) имели чисто сенсорную или сенсомоторную аксональную невропатию, а 9 (14,5%) – демиелинизирующую полиневропатию. Синдром запястного канала выявлен у 11 из 108 больных. Поражения ПНС имели разнообразную клиническую картину: боль, парестезии, моторные и сенсорные нарушения. Авторы обращали внимание на то, что эти симптомы могут имитировать суставную боль или сопровождать ее. Однако не было получено данных о взаимосвязи неврологических проявлений с длительностью заболевания, наличием эрозий, деформаций суставов и приемом противовоспалительных препаратов [13].
В целом, по данным литературы, частота неврологических осложнений у больных РА имеет большой разброс (от 0,5 до 85%) и представлена преимущественно полиневропатией (сенсорной, моторной или сенсомоторной), а также множественными мононевропатиями, шейной миелопатией или туннельным синдромом [14–18].
Полиневропатия, при которой поражаются как двигательные (моторные), так и чувствительные (сенсорные) волокна, выявляется более чем в 50% случаев. На сегодняшний день трудными для диагностики остаются моторные нарушения, поскольку имеющиеся деформации суставов с ограничением активных и пассивных движений, сопутствующей мышечной атрофией зачастую препятствуют определению причины пареза: патология суставов или патология периферических нервов. Полиневропатия характерна больше при длительном течении болезни [11, 13, 18].
Основной причиной поражения ПНС являются васкулит и ишемия сосудов, питающих периферические нервы. Диагностика поражения ПНС основывается на чувствительных нарушениях в дистальных отделах конечностей, снижении поверхностной и глубокой чувствительности, данных стимуляционной электронейромиографии (ЭНМГ) (снижение скорости распространения возбуждения по моторным и сенсорным волокнам и М-ответа в дистальных отделах конечностей).
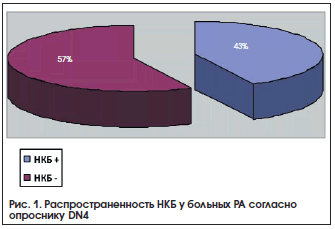
В 2012 г. нами проведено исследование с целью выявить нейропатический компонент боли (НКБ) у больных с РА. Обследовано 183 пациента с достоверным РА, (средний возраст 46,5±11,7 года) с длительностью заболевания от 3-х месяцев до 30 лет (в среднем 9,1±7,6 года) [19]. По данным опросника DN4 для диагностики вида боли, 73 пациента (43%) набрали 4 и более баллов, что свидетельствует о нейропатическом характере боли (рис. 1).
Статистический анализ 2-х групп пациентов – с НКБ (НКБ+) и без НКБ (НКБ–) – показал, что с увеличением возраста больного, длительности заболевания, клинической стадии и снижением функциональных возможностей возрастает вероятность наличия НКБ у больного. Причем индекс DAS28, позволяющий определить активность болезни и эффективность терапии при РА, и СОЭ не являются предикторами боли.
Анализ болевого синдрома с помощью наиболее популярного в России опросника DN4 [20] выявил различные качественные характеристики хронического болевого синдрома у пациентов с РА. Наиболее частыми дескрипторами невропатической боли были прострелы, похожие на удар током (51%), ползание мурашек (40%), покалывание (54%) и онемение (57%).
Исследование неврологического статуса выявило у пациентов с НКБ в 96% случаев поражение ПНС, которое было представлено дистальной сенсомоторной полиневропатией (55%), туннельным синдромом (14%), мононевропатией (19%), шейной миелопатией (4%), сочетанием полиневропатии с туннельным синдромом (4%). Лишь у 4% поражение ПНС отсутствовало [21]. Полиневропатия чаще выявлялась у пациентов более старшего возраста, длительно болеющих РА, что подтвердило данные зарубежных коллег (рис. 2).
Для подтверждения полиневропатии пациентам проведена стимуляционная ЭНМГ, которая выявила преимущественное снижение скорости распространения возбуждения и амплитуды М-ответа в дистальных отделах конечностей, что позволило говорить о наличии у них смешанного типа поражения ПНС – аксонального и демиелинизирующего.
Основные принципы терапии невропатической боли при РА
Проведенное нами исследование показало, что хронический суставной болевой синдром при РА носит смешанный характер. Наряду с ноцицептивным компонентом, обусловленным воспалением, у 43% пациентов преобладает НКБ, что требует комплексной терапии. Наряду с НПВП, базисной противовоспалительной, глюкокортикостероидной и генно-инженерной биологической терапией, направленной на основное заболевание и ноцицептивный компонент, необходимо рассмотреть терапию нейропатического компонента. Согласно международным рекомендациям, наряду с вышеуказанными препаратами, для лечения НКБ необходимо использовать препараты центрального действия (анктиконвульсанты и антидепрессанты) и витамины группы В.
В течение многих лет ученые занимаются клиническими исследованиями применения при различных неврологических заболеваниях витаминов группы В, прежде всего витаминов В1 (тиамин), В6 (пиридоксин) и В12 (цианокобаламин), обладающих определенным механизмом действия.
• Тиамин (В1) оказывает репаративное действие на пораженные нейроны, а также замедляет прогрессирование поражения сосудистого русла.
• Пиридоксин (В6) оказывает нейротропное действие (активируя синтез миелиновой оболочки нервного волокна и транспортных белков в аксонах, ускоряет процесс регенерации периферических нервов) и противоболевое действие.
• Цианокобаламин (В12) активно влияет на энергообеспечение клеток, синтез белка, регенерацию нервной ткани [22–24].
На сегодняшний день уже не ставится под сомнение анальгетический эффект этих витаминов [22, 25, 26] и целесообразность их использования в лечении болевых синдромов с сенсорными нарушениями, а также в комплексной терапии невропатической боли с применением Габапентина [27, 28]. В 2016 г. A. Mimenza и S. Aguilar провели исследование с применением антиконвульсантов и витаминов В1 и В12 у больных с диабетической полиневропатией. В течение 12 нед. пациентам с болевой формой диабетической полиневропатии проводили терапию по 2-м схемам: 1) Габапентин 300–3600 мг + В12 (20 мг) и В1 (100 мг); 2) Прегабалин 75–600 мг. Достоверное снижение выраженности болевого синдрома получено в обеих группах, однако комбинация Габапентина с витаминами В1 и В12 позволила использовать меньшие дозы антиконвульсанта, что является немаловажным аспектом.
Спектр заболеваний нервной системы, при которых патогенетически обосновано применение витаминов группы В, разнообразен. Полиневропатия как основной этиологический фактор периферической нейропатической боли у больных с РА – один из основных показаний к применению витаминов группы В.
Оригинальным препаратом, содержащим комплекс витаминов В1, В6, В12, является Нейробион (МЕРК), он оказывает тройное действие на нейроны: нормализует обмен углеводов (за счет витамина В1); увеличивает синтез нейромедиаторов (за счет витамина В6); стимулирует синтез защитной миелиновой оболочки (за счет витамина В12). Препарат выпускается в 2-х формах: инъекционной и таблетированной, при этом отсутствие в препарате лидокаина снижает риск развития аллергии.
Показания к применению препарата Нейробион (МЕРК):
• нейропатическая боль при полинейропатии;
• болевой синдром при заболеваниях позвоночника (люмбоишиалгия, плексопатия, корешковый синдром, вызванный дегенеративными изменениями позвоночника);
• невриты и невралгии (невралгия тройничного нерва, неврит лицевого нерва, межреберная невралгия).
Схемы применения препарата Нейробион (МЕРК) различаются в зависимости от интенсивности болевого синдрома. При выраженном болевом синдроме лечение целесообразно начинать с внутримышечного введения 3 мл/сут (1 ампула) до снятия острых симптомов. После уменьшения выраженности симптомов или при умеренной их тяжести назначают по 3 мл (1 ампула) 3 р./нед. в течение 2–3-х недель. В целях профилактики рецидива рекомендуется поддерживающая схема: внутрь по 1 таблетке 1–3 р./сут в течение 1–1,5 мес. или по назначению врача.
Следует обратить внимание, что при длительном курсе терапии (18 нед.) диабетической полиневропатии витаминами группы В не наблюдалось побочных эффектов, которые могли бы свидетельствовать о передозировке препарата [29].
Синергическое взаимодействие препаратов с различными механизмами действия обусловливает больший болеутоляющий эффект при меньших неблагоприятных явлениях.
Источник
При обнаружении у больного РА митрального стеноза всегда необходимо исключать его ревматическую этиологию, так как сочетание РА с предшествующим ревматическим пороком признается многими авторами. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и в эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца
Ревматоидный артрит (РА) — хроническое системное воспалительное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу симметричного эрозивно-деструктивного полиартрита с частыми внесуставными проявлениями, среди которых поражение сердца, по данным вскрытия, отмечается в 50-60% случаев [1, 4, 7]. Изменения в сердце при РА в недавнем прошлом выделяли в суставно-сердечную форму заболевания. При поражении суставов, когда заметно снижается физическая активность, сердечная патология часто маскируется, что требует от врача более внимательного и тщательного обследования больного. При этом клинические изменения со стороны сердца, как правило, минимальные и редко выходят на первый план в общей картине основной болезни. Системные проявления РА, в том числе и поражение сердца, определяют прогноз в целом, поэтому важно их раннее распознавание и целенаправленное лечение.
Морфологическая картина
 |
| Рисунок 1. Интерстициальный миокардит, умеренный васкулит. Окр. гематоксилином и эозином. Х 150 |
Частота поражения миокарда при РА в форме миокардита не выяснена. Это обусловлено, с одной стороны, трудностью диагностики миокардита у лиц с ограниченной двигательной активностью, с другой — отставанием клинических проявлений от морфологических изменений сердца [6, 7]. Патология миокарда носит полиморфный характер в связи с наличием различной давности сосудистых поражений [7]. В одних сосудах имеется васкулит, в других — гиалиноз, в третьих — склероз. Характер васкулита может быть пролиферативным и редко пролиферативно-деструктивным. В воспалительном инфильтрате преобладают лимфогистиоцитарные элементы как в периваскулярном пространстве (рис. 1), так и в стенке сосудов. Следует отметить, что при активации основного процесса наблюдается сочетание старых и свежих сосудистых изменений. Наряду с этим встречается очаговый, или диффузный, интерстициальный миокардит, заканчивающийся развитием мелкоочагового кардиосклероза. У больных ревматоидным артритом нередко развивается бурая атрофия миокарда с накоплением липофусцина в кардиомиоцитах (рис. 2). Эти изменения могут являться причиной стенокардии. Патогмоничным признаком ревматоидного артрита являются ревматоидные узелки в миокарде, перикарде и эндокарде в основании митрального и аортального клапанов, в области фиброзного кольца. В исходе узелка развивается склероз, вызывающий формирование недостаточности клапанов. Миокардит проявляется и диагностируется, как правило, на высоте активности основного ревматоидного процесса, то есть при очередном выраженном обострении суставного синдрома.
Клиника
 |
| Рисунок 2. Интерстициальный миокардит. Отложения липофусцина в перинуклеарных пространствах. Окр. гематоксилином и эозином. Х 400 |
Ведущей жалобой при миокардите в дебюте поражения сердца являются неприятные ощущения в области сердца (кардиалгии), невыраженные, длительные, разлитые и без четкой локализации, как правило, без иррадиации и не купирующиеся нитратами. К основным жалобам относятся сердцебиение, перебои и реже одышка при физической нагрузке. Быструю утомляемость, повышенную потливость и субфебрилитет врачи обычно связывают с очередным обострением РА, а не с кардиальной патологией [3].
При аускультации физикальные данные выявляют тахикардию и ослабление I тона с систолическим шумом, нередко удается выслушать III тон. Как правило, миокардит при РА не склонен к прогрессированию, признаки сердечной недостаточности отсутствуют [4].
Данные ЭКГ
При обычном ЭКГ-исследовании могут отмечаться снижение зубцов Т, опущение интервалов ST, небольшие нарушения внутрижелудочковой проводимости. Эти изменения неспецифичны и могут сопровождать различные заболевания. Более характерное для миокардитов замедление атриовентрикулярной проводимости бывает редко.
В литературе описано значительное число наблюдений, когда нарушение ритма сердца служит единственным патологическим симптомом поражения коронарных артерий. Нарушение ритма и проводимости при активном РА существенно чаще определяется при суточном мониторировании ЭКГ и чреспищеводном электрофизиологическом исследовании, чем при обычной ЭКГ. Так,
И. Б. Виноградова [2] при исследовании больных РА с использованием вышеуказанной методики выявила нарушение ритма и проводимости у 60% больных, в том числе предсердную (18%) и желудочковую (10%) экстрасистолию, пароксизмальную тахикардию (4%), мерцательную аритмию (6%), проходящую блокаду правой ножки пучка Гиса (20%) и атриовентрикулярную блокаду II степени (2%). Также было высказано предположение, что депрессия ST, выявляемая при чреспищеводном электрофизиологическом исследовании, является косвенным признаком изменения коронарной микроциркуляции вследствие ревматоидного васкулита. Поэтому у данных больных отмечены высокие уровни циркулирующих иммунных комплексов, ревматоидного фактора, антител к кардиолипину Ig M. Важно отметить, что в этой же группе больных имелись другие признаки васкулита: дигитальный артериит, сетчатое ливедо, синдром Рейно и ревматоидные узелки. Следовательно, если рутинные клинические методы исследования не выявляют достаточно убедительных признаков ревматоидного миокардита, то современные электрофизиологические исследования обнаруживают факты нарушений функции сердца, что указывает на связь этих изменений с активностью ревматоидного процесса. Подтверждением этому может служить положительная динамика изменений под влиянием адекватного лечения основного заболевания, обычно отмечаемая при регрессе суставного синдрома.
Дифференциальная диагностика
Дифференциальная диагностика миокардита и миокардиодистрофии, нередко проводящаяся у больных РА, длительно получающих массивную лекарственную терапию, затруднена, т. к. клинические проявления в том и другом случае близки [5, 6]. Наличие миокардита подтвердит положительная динамика его проявлений под влиянием правильно подобранного и назначаемого в адекватных дозах противоревматического лечения.
 |
| Рисунок 3. Утолщение перикарда. Склероз. Окр. гематоксилином и эозином. Х 150 |
Перикардит является наиболее характерным поражением сердца при РА [1]. Патологоанатомически он выявляется в подавляющем большинстве случаев в виде фиброзного, реже геморрагического перикардита; нередко обнаружение характерных ревматических гранулем. Отличительной особенностью перикардита при ревматоидном артрите является участие в воспалении крупных базофильных гистиоцитов под зоной фибринозных наложений. Глубже формируется грануляционная ткань, содержащая лимфоциты и плазматические клетки, с утолщением перикарда и формированием грубого склероза (рис. 3).
Больной может предъявлять жалобы на боли в области сердца разной интенсивности и длительности. Частота клинической диагностики перикардита различна (20-40%) и зависит в основном от тщательности клинического изучения больного и уровня компетентности клинициста. В большинстве случаев анатомически определяются спайки в полости перикарда и утолщение последнего за счет склеротического процессса, нередко рецидивирующего. Выпот обычно небольшой, без признаков тампонады. Подтверждается, как правило, данными рентгенологического исследования, указывающими на нечеткость и неровность контуров сердца. Шумы трения перикарда непостоянны, выслушиваются далеко не у всех больных, хотя в некоторых случаях остаются длительно в виде перикардиальных щелчков в различные фазы сердечного цикла, что фиксируется качественным ФКГ-исследованием. ЭКГ-изменения у большинства больных неспецифичны для перикардита. Но в случае появления даже умеренного экссудата можно наблюдать снижение вольтажа QRS с положительной динамикой при уменьшении выпота. Перикардиты при РА склонны к рецидивированию. В части случаев перикардиты сопровождаются появлением конкордантных отрицательных зубцов Т на многих ЭКГ-отведениях, что может приводить к постановке ошибочного диагноза инфаркта миокарда. Большое значение в обнаружении РА-перикардитов имеет эхокардиография, позволяющая выявлять изменения перикарда (его уплотнение, утолщение, наличие жидкости) и динамику этих изменений при повторных исследованиях. Во многих случаях ЭХО-изменения перикардита являются неожиданной находкой как для больного, так и для лечащего врача [8].
Эндокардит при РА отмечается значительно реже, чем перикардит. Патологоанатомические данные свидетельствуют о нередком вовлечении в процесс эндокарда, в том числе клапанного, в виде неспецифических воспалительных изменений в створках и клапанном кольце, а также специфических гранулем. У большинства больных вальвулит протекает благоприятно, не приводит к значительной деформации створок и не имеет ярких клинических проявлений. Однако у некоторых больных течение вальвулита может осложняться деформацией створок и сопровождаться выраженной недостаточностью пораженного клапана, чаще митрального, что диктует необходимость хирургической коррекции порока. Обычно эндокардит сочетается с миокардитом и перикардитом. В литературе обсуждается возможность образования стенозов митрального и аортального клапанов, но единого мнения по этому вопросу нет [6]. При обнаружении у больного РА митрального стеноза всегда необходимо исключать ревматическую этиологию его, т. к. сочетание РА с предшествующим ревматическим пороком признается многими авторами [4].
С целью изучения характера клапанной патологии сердца при РА проанализированы результаты лечения 297 больных с достоверным РА по критериям АРА. Анализ показал, что чаще всего — в 61,6% случаев — имеет место митральная регургитация. При этом у 17,2% больных она была умеренной или выраженной. У 152 (51,2%) больных полипроекционное ЭХО-КГ-исследование структурных изменений створок клапанов не выявило. Более детальный анализ позволил выделить в отдельную группу 14 больных, которые имели в анамнезе ревматизм и ревматический порок сердца. РА эти больные заболели за 1–24 года до исследования (в среднем через 8,9 года). 7 человек из них имели характерные признаки ревматического митрального стеноза (у 3 — выраженного) в сочетании с митральной регургитацией разной выраженности и признаки аортального порока, который у 1 больной был диагностирован как сочетанный. У 2 больных митральный порок был в виде умеренной митральной недостаточности и комбинировался с недостаточностью аортального клапана. У 3 больных выявлены признаки ревматической недостаточности митрального клапана. У 2 больных отмечался выраженный сочетанный аортальный порок в комбинации с относительной недостаточностью митрального клапана.
Таким образом, наши данные подтверждают возможность заболевания РА лиц, ранее болевших ревматизмом и имеющих ревматические пороки сердца.
В отдельную группу были выделены 38 больных (средний возраст 58,7 года, давность РА 12,8 года) с наличием структурных изменений клапанного аппарата сердца в виде тотального краевого утолщения створок или отдельных очагов утолщения, нередко достигающих больших величин (13х6 мм), признаков кальциноза и ограничения подвижности створок. Створки митрального кольца оказались измененными у 19, аортального — у 33, трикуспидального — у 1 больной, причем у 16 пациентов были сочетанные изменения митрального и аортального клапанов, у 1 — митрального и трикуспидального. У 17 из 19 больных структурные изменения митральных створок сопровождались митральной регургитацией.
У 17 из 33 больных с изменениями аортальных створок диагностировалась аортальная регургитация, при этом у 12 она была умеренной или выраженной. У 16 больных, в том числе у 2 с признаками кальциноза, имел место склероз аортальных створок без нарушения функции клапана, что нашло свое подтверждение и неизмененным трансаортальным кровотоком. У 1 больной со значительным утолщением створок и умеренной аортальной регургитацией имелось ограничение открытия их (1-2 см) и повышение трансаортального градиента давления, т. е. признаки аортального стеноза. И еще у 1 больной 33-летнего возраста был диагностирован врожденный двухстворчатый аортальный клапан с признаками умеренной аортальной регургитации. Выраженная трикуспидальная регургитация была диагностирована у 3 больных с очаговым утолщением трикуспидальных створок, причем у 1 из них было диагностировано легочное сердце как осложнение ревматоидного поражения легких.
Возникает вопрос: все ли обнаруженные изменения у этой группы, состоящей из 33 больных, являются следствием РА? Анализ наших данных показал, что большинство больных этой группы были в возрасте 51–74 лет. У 19 из них диагностировалась артериальная гипертензия, имелись признаки ишемической болезни сердца, 4 больных перенесли инфаркт миокарда, 1 — острое нарушение мозгового кровообращения. Результаты исследования показали, что у лиц с высокими цифрами артериального давления изменения клапанного аппарата были более выраженными, и только у них диагностировался кальциноз митрального клапана и/или аортального клапана, признаки аортальной регургитации, гипертрофия стенки левого желудочка и межжелудочковой перегородки, а также утолщение стенок аорты с признаками дилятации и диастолическая дисфункция левого желудочка. Выявленные ЭХО-КГ-изменения в этой группе больных не отличаются от таковых при атеросклеротическом кардиосклерозе, атеросклерозе аорты и являются классическими. Поэтому в этой группе больных не представляется возможным исключить атеросклеротический генез пороков сердца. Вместе с тем вполне вероятно, что собственно ревматоидное поражение клапанов может служить тем благоприятным фоном, на котором в дальнейшем развиваются выраженные структурные изменения створок, патология которых доминирует как в клинической, так и в ЭХО-КГ-картине атеросклеротического поражения клапанов сердца. В каждом случае вопрос о генезе порока при РА требует учета всех имеющихся клинических данных.
Литература
1. Балабанова Р. М. Ревматоидный артрит. В кн.: Ревматические болезни (руководство по внутренним болезням)/ Под ред. В. А. Насоновой и Н. В. Бунчука. — М.: Медицина, 1997. С. 257-295.
2. Виноградова И. Б. Нарушение сердечного ритма и проводимости у больных ревматоидным артритом// Автореф. дис. … канд. мед. наук. М., 1998. С. 21.
3. Елисеев О. М. Амилоидоз сердца// Тер. арх. 1980. № 12. С. 116-121.
4. Котельникова Г. П. Поражение сердца при ревматоидном артрите// В сб.: Ревматоидный артрит. — М.: Медицина, 1983. С. 89-90.
5. Котельникова Г. П., Лукина Г. В., Муравьев Ю. В. Кардиальная патология при вторичном амилоидозе у больных ревматическими заболеваниями// Клин. ревматол. 1993. № 2. С. 5-8.
6. Немчинов Е. Н., Каневская М. З., Чичасова Н. В. и др. Пороки сердца у больных ревматоидным артритом (результаты многолетнего проспективного клинико-эхокардиографического исследования)// Тер. арх. 1994. № 5. С. 33-37.
7. Раденска-Лоповок С. Г. Морфологические методы исследования и диагностики в ревматологии В кн.: Ревматические болезни (руководство по внутренним болезням) под ред. В. А. Насоновой и Н. В. Бунчука. М.: Медицина, 1997. С. 80-94.
8. Цурко В.В. Асептический некроз головок бедренных костей при ревматоидном артрите и системной красной волчанке. Клинико-инструментальная диагностика и исходы: Автореф. дис. … д-ра мед. наук. М., 1997. С. 50
Источник
