Применение альфакальцидола при остеопорозе
Статья посвящена вопросам применения альфакальцидола в лечении больных остеопорозом
В настоящее время для лечения остеопороза (ОП) используются лекарственные препараты, доказавшие свою эффективность в отношении снижения риска переломов в ходе многоцентровых плацебо-контролируемых исследований. Это в первую очередь бисфосфонаты и деносумаб (антирезорбтивные средства), терипаратид (костный анаболик) и стронция ранелат (препарат с двойным механизмом действия). Для первичной профилактики заболевания и в составе комбинированной терапии ОП применяются кальций и витамин D. Среди препаратов витамина D особое место занимают его активные метаболиты, одним из которых является альфакальцидол – 1α(ОН)D3. При попадании в организм он гидроксилируется в печени под действием 25–гидроксилазы и превращается в D-гормон, или кальцитриол (1α,25(ОН)2D3). Механизм действия препарата состоит в связывании 1α,25(ОН)2D3 с рецепторами витамина D в органах-мишенях. В кишечнике это приводит к повышению абсорбции кальция и фосфора, а в почках – к увеличению реабсорбции в них кальция. Препарат нормализует кальций-фосфорный обмен: он подавляет костную резорбцию и стимулирует костеобразование, что ведет к увеличению минеральной плотности кости (МПК) и тем самым повышает механическую прочность кости. Преимуществом использования альфакальцидола по сравнению с другим активным метаболитом – кальцитриолом является то, что при его использовании возникает меньший риск развития гиперкальциемии. Это связано с тем, что он представляет собой «пролекарство», которое, попадая в кишечник и всасываясь в кровь в неактивной форме, не приводит к резкому повышению концентрации кальция в крови, в отличие от кальцитриола [1].
Альфакальцидол используется в лечении заболеваний костной ткани, в частности первичного и вторичного ОП, а также у больных с хроническими заболеваниями почек, у которых нарушено 1-альфа-гидроксилирование витамина D3.
Исследования, проведенные с использованием альфакальцидола и кальцитриола при первичном и глюкокортикоидном ОП, показали снижение риска переломов любой локализации по сравнению с контрольной группой, независимо от того, получали ли в ней пациенты дополнительно добавки кальция или нет, почти в 2 раза; оно не зависело от показателей МПК до начала лечения [2]. Кроме того, были показаны преимущества приема активных метаболитов по сравнению с холекальциферолом – нативным витамином D в отношении прироста МПК и снижения риска переломов позвонков и периферических костей при первичном ОП. Так, в исследовании R. Nuti еt al. продемонстрировано, что лечение 1 мкг альфакальцидола в сочетании с кальцием у женщин с постменопаузальным ОП и нормальным уровнем витамина D приводило через 12 мес. терапии к большему приросту МПК в позвоночнике по сравнению с группой, получавшей 880 МЕ нативного витамина D и кальций (2,33% против 0,70%, р=0,018), а к 18-му мес. увеличение МПК в группе альфакальцидола составило в среднем 2,87%, тогда как в группе, применявшей нативный витамин D, дальнейшего увеличения плотности кости не наблюдалось (р=0,005). Исследование также показало снижение риска новых переломов у пациенток основной группы по сравнению с контролем (7,1% против 11,9%), а по побочным эффектам группы между собой не различались [3].
Альфакальцидол показал свою эффективность в качестве монотерапии при глюкокортикоидном ОП. Так, в 3–летнем рандомизированном клиническом исследовании прием 1 мкг альфакальцидола и 500 мг кальция в сутки был более эффективным, чем прием 1000 МЕ витамина D3 и 500 мг кальция пациентами, длительно принимавшими системные глюкокортикоиды (СГК). В группе больных, принимавших альфакальцидол, отмечалось достоверно большее увеличение МПК поясничного отдела позвоночника (+2,4%) и шейки бедра (+1,2%) по сравнению с контролем (-0,8% и +0,8% соответственно); выявлено снижение риска переломов позвонков на 39%, периферических переломов – на 59%, переломов любой локализации – на 48%; кроме того, отмечено значимое уменьшение интенсивности болей в спине по сравнению с группой, получавшей нативный витамин D. Только у 3 пациентов в группе альфакальцидола и 2 пациентов в группе витамина D было выявлено увеличение уровня кальция в крови [4, 5]. В метаанализе, включавшем 54 работы по оценке влияния активных метаболитов витамина D у больных, получавших длительно СГК, на МПК позвоночника и на риск переломов, был показан их положительный эффект по сравнению с плацебо, нативным витамином D и/или кальцием: ES 0,35 (95% ДИ 0,18; 0,52) [2]. Аналогичные данные получены при изучении влияния активных метаболитов витамина D на риск переломов позвонков: показано снижение их риска в 1,8 раза при приеме альфакальцидола по сравнению с приемом плацебо, нативного витамина D и/или кальция (ОР 0,56; 95% ДИ 0,34; 0,92) [6].
Одной из причин возникновения переломов при ОП являются падения. В настоящее время имеется целый ряд работ, посвященных оценке влияния препаратов витамина D на снижение их риска, при этом было показано преимущество использования активных метаболитов по сравнению с нативным витамином D. Так, в метаанализе F. Richy еt al. было продемонстрировано снижение риска падений на 21% (ОР 0,79; 95% ДИ 0,64; 0,96) против 6% (ОР 0,94; 95% ДИ 0,87; 1,01) при приеме нативного витамина D [7]. Среди пожилых больных, имевших возрастное снижение функции почек (клиренс креатинина <65 мл/мин), на фоне приема альфакальцидола уменьшалось число пациентов, подверженных падениям, на 74% (р=0,019) [8]. Кроме того, имеются данные о большем положительном влиянии альфакальцидола на увеличение мышечной массы и мышечной силы по сравнению с нативной формой витамина D [9, 10].
Альфакальцидол может применяться для лечения первичного ОП не только у женщин, но и у мужчин, что было продемонстрировано в исследовании J.D. Ringe еt al. [11]. Мужчины, принимавшие альфакальцидол 1 мкг/сут в качестве монотерапии, имели больший прирост МПК в области позвоночника и бедра, меньшее количество произошедших позвоночных и периферических переломов (при этом значимое снижение риска периферических переломов было у больных с клиренсом креатинина <60 мл/мин), а также достоверно меньшее число падений, чем у пациентов, принимавших нативный витамин D.
Интерес ученых был привлечен и к возможности использования комбинации альфакальцидола с другими антиостеопоротическими препаратами. Например, эффективность альфакальцидола была доказана у мужчин и женщин в постменопаузе с ОП при совместном его назначении с алендронатом по сравнению с монотерапией каждым из препаратов в сочетании с кальцием, а для алендроната – еще и в комбинации с нативным витамином D. Во всех группах отмечался прирост МПК в позвоночнике и бедре, однако в группе, принимавшей алендронат и альфакальцидол, результат оказался значимо лучше уже через 12 мес. лечения, чем в группе комбинированного приема алендроната и нативного витамина D. Кроме того, отмечалось снижение частоты падений, которая была наименьшей в группе, получавшей альфакальцидол и алендронат [12].
Еще одно исследование по изучению аддитивного влияния 1 мкг альфакальцидола на МПК и прочность кости при лечении алендронатом продемонстрировало достоверно большее увеличение МПК в позвоночнике, а также рост объемной минеральной плотности в кортикальной кости предплечья за 3 года лечения, которые были выявлены с помощью периферической КТ, по сравнению с лицами, получавшими только алендронат и кальций [13].
Еще один аспект назначения альфакальцидола – это его прием после 3–5-летней непрерывной терапии бисфосфонатами во время так называемых «лекарственных каникул», которые возможны у пациентов с МПК в области шейки бедра >-2SD и при отсутствии переломов позвонков. Исследование J.D. Ringe и E. Schacht показало, что альфакальцидол не только стабилизировал МПК после завершения приема бисфосфонатов, но и способствовал ее увеличению, а также приводил к уменьшению количества падений по сравнению с этими показателями при приеме нативного витамина D, при одинаковой частоте побочных эффектов [14].
Таким образом, альфакальцидол может применяться у больных, страдающих как первичным, так и вторичным ОП; как монотерапия, так и в комбинации с бисфосфонатами, а также как препарат выбора после длительного приема бисфосфонатов. Альфакальцидол зарегистрирован в России в 1990-х гг. и включен в список препаратов для лечения ОП в современных клинических рекомендациях по ОП [15].
Целью нашего исследования было установить место альфакальцидола в лечении больных ОП в реальной клинической практике.
Материал и методы
Первая часть работы состояла из анкетирования врачей с использованием специально разработанного вопросника, включавшего в себя разделы по частоте и числу консультируемых больных ОП, регистрации заболевания в талонах статистической отчетности, используемым методам диагностики и лечению. Заполненные вопросники были получены от 307 врачей 6 основных специальностей, занимающихся проблемой ОП.
Вторая часть работы включала анкетирование пациентов с установленным диагнозом ОП и получавших не менее 1 года терапию по поводу этого заболевания. В опросе приняли участие 1799 больных в возрасте от 25 до 92 лет (средний возраст – 63,3±8,4 года), проживающих в 5 регионах России. Среди анкетированных было 265 (15%) мужчин (средний возраст – 63,0±8,4 года) и 1534 (85%) женщин (средний возраст – 63,5±8,4 года). Приверженность проводимой антиостеопоротической терапии оценивалась за последние 12 мес. перед анкетированием по следующим параметрам: длительность, отсутствие пропуска приемов, выполнение рекомендаций по приему препарата.
Третья часть работы включала проспективное 3-летнее наблюдение за 196 женщинами в постменопаузе (средний возраст 65,8±9,1 года), перенесших ОП-переломы проксимального отдела бедра, дистального отдела предплечья, шейки плечевой кости, позвоночника и лодыжки. На всех женщин заполнялась унифицированная анкета через 4, 12, 24 и 36 мес. после произошедшего перелома, в которую были включены вопросы о проведении антиостеопоротического лечения и приверженности ему.
Статистическая обработка проводилась с использованием параметрических (тест Стьюдента для несвязанных выборок) и непараметрических (тесты Вилкоксона, Манна – Уитни, точный критерий Фишера) критериев. При нормальном распределении данные представлены через среднее (М) и стандартное отклонение (СО). Данные, не имеющие нормального распределения, выражены через медиану (Ме), 25 и 75 процентили. Различия считались статистически значимыми при величине p<0,05.
Результаты и обсуждение
Анкетирование врачей показало, что они в месяц в среднем консультируют 12 [1; 40] больных по поводу ОП, при этом терапевты принимали 6 [3; 20], неврологи – 6 [3; 30], гинекологи – 6 [1; 8], травматологи – 12 [6; 18], эндокринологи – 16 [8; 20] и ревматологи – 20 [12; 40] пациентов ежемесячно. Ревматологи и эндокринологи наблюдали больных ОП чаще, чем врачи других специальностей (p<0,001 и p<0,05 соответственно). В качестве основной терапии ОП врачи в 24% случаев рекомендовали препараты кальция и витамина D, при этом треть этих назначений приходилась на долю активных метаболитов витамина D в качестве монотерапии (рис. 1). Кроме того, врачи в 19% случаев назначали альфакальцидол в сочетании как с антирезорбтивными препаратами, так и со стронция ранелатом.
Опрос пациентов показал, что в 43% случаев диагноз ОП был поставлен ревматологом, в 17% – терапевтом, в 15% – травматологом, в 13% – эндокринологом, в 9% – неврологом и в 3% – гинекологом.
Было установлено, что 452 (25%) человека принимали альфакальцидол в качестве монотерапии и в комбинации с другими антиостеопоротическими препаратами (рис. 2), мужчины и женщины с одинаковой частотой (23% и 26% соответственно, p>0,05). Рекомендации по приему альфакальцидола пациенты получили в 29% случаев от ревматологов, реже от травматологов (24%), неврологов (23%), эндокринологов (21%) и терапевтов (20%), при этом ревматологи достоверно чаще назначали его больным, чем терапевты и эндокринологи (χ2= 18,02, p=0,006).
Пациенты, принимавшие альфакальцидол, были старше (средний возраст – 64,4±8,6 года) больных, получавших лечение препаратами, содержащими кальций и/или нативный витамин D (средний возраст – 63,1±8,4 года) (p<0,01), у них чаще выявлялись предшествующие ОП-переломы (42% и 35% соответственно, p=0,0083). Кроме этого, лица, получавшие альфакальцидол, имели более длительную продолжительность болезни (p<0,0001), принимали большее общее количество таблеток в день по поводу всех других заболеваний (p=0,007) и были менее привержены лечению ОП (38% по сравнению с 44%, p=0,026).
В качестве монотерапии ОП альфакальцидол принимали 52 (12%) пациента, среди них 5 (10%) человек в возрасте моложе 50 лет. Опрос больных ОП показал, что достоверно реже они получали рекомендацию по монотерапии альфакальцидолом от ревматологов (в 6% случаев), чем от терапевтов и травматологов (23% и 21% соответственно, р<0,05).
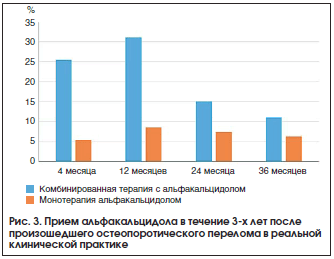
Анкетирование 196 пациенток, перенесших ОП-перелом, продемонстрировало, что в течение первых 4-х мес. после него какую-либо противоостеопоротическую терапию получали 114 (58%) опрошенных, при этом достоверно чаще – женщины с переломами позвонков (p=0,0055). Альфакальцидол принимали 35 (30,7%) человек: 6 (5,3%) – как монотерапию, 29 (25,4%) – в сочетании с бисфосфонатами. Наиболее часто альфакальцидол назначался больным, перенесшим перелом проксимального отдела бедра и позвоночника, по сравнению с лицами, у которых перелом случился в остальных 4-х областях скелета. К 12-му мес. лечение ОП проводилось у 106 больных, при этом 42 (40%) человека получали альфакальцидол, из них 9 женщин – монотерапию. Через 24 и 36 мес. антиостеопоротическое лечение получали 94 и 63 человека соответственно, а альфакальцидол принимали 22 (23,4%) и 11 (17,5%) пациентов соответственно, при этом монотерапию – 7 и 4 человека соответственно (рис. 3). Достоверно чаще альфакальцидол получали лица в возрасте 65 лет и старше. Общая приверженность лечению среди пациенток, начавших терапию в течение первых 4-х мес. после перелома, составила 20% к 36-му мес., при этом для монотерапии альфакальцидолом этот показатель составил 50%, а для комбинированной – 21%. 
Таким образом, наше исследование показало, что альфакальцидол не потерял своей актуальности в лечении больных ОП в реальной клинической практике: его назначали в 8% случаев в качестве монотерапии, а в 19% – в сочетании с другими антиостеопоротическими лекарственными средствами. Наиболее часто по сравнению с другими врачами альфакальцидол рекомендовали ревматологи, при этом предпочтение отдавалось комбинированному лечению. Независимый опрос больных ОП выявил, что 25% анкетированных лиц принимали его в качестве как основной терапии ОП (12%), так и в комбинации с другими антиостеопоротическими препаратами, при этом он использовался практически с одинаковой частотой у мужчин и женщин. Следует отметить, что лица, принимавшие альфакальцидол, были старше по возрасту и, как следствие, имели более длительный срок болезни. Это оправданно, т. к. у пожилых людей с возрастом отмечается уменьшение скорости клубочковой фильтрации, которое способствует снижению гидроксилирования витамина D в почках, ведет к недостаточности образования D-гормона и сопровождается развитием толерантности к нативному витамину D. Таким образом, на фоне эндокринно-иммунной дисфункции происходит снижение общей мышечной массы и появляется синдром мышечной слабости, что сопровождается повышением риска падений и обусловленных этим травм и переломов. В ряде исследований было показано значительное снижение частоты падений пациентов пожилого возраста при применении альфакальцидола [8].
Еще один положительный аспект назначения альфакальцидола – достаточная безопасность при длительном приеме. Так, применение альфакальцидола ≥6 лет в дозе 0,5–1,0 мкг/сут показало, что суммарная частота развития побочных эффектов составила 1,1%, а гиперкальциемии – лишь 0,22%, случаев формирования мочекаменной болезни не было отмечено [16]. В другом обзоре было продемонстрировано, что относительный риск гиперкальциемии у пациентов, принимавших витамин D или его аналоги (в сочетании с кальцием или без него), составил всего 2,35% [17].
Заключение
Опрос врачей и пациентов с ОП и ОП-переломами продемонстрировал, что в реальной клинической практике альфакальцидол, имея оптимальный профиль безопасности, продолжает широко применяться как для моно-, так и для комбинированной терапии ОП. Горизонты его использования расширились в связи с возможностью перевода больных с лечения бисфосфонатами на альтернативную терапию альфакальцидолм во время «лекарственных каникул».
Источник
С возрастом не только ухудшается состояние костной ткани, но и увеличивается риск падений. Для профилактики и лечения остеопороза необходимо применять синтетические аналоги витамина D₃ – кальцитриол и альфакальцидол. Использование данных препаратов позволяет миновать ключевой этап активации витамина D₃ – 1-альфа-гидроксилирование в почках. Это особенно важно при лечении больных старше 45 лет и тех, у кого имеются хронические заболевания почек. Эффективность и безопасность указанных препаратов в моно- и комбинированной терапии подтверждены результатами многочисленных исследований.
Остеопороз – распространенное хроническое заболевание, характеризующееся снижением массы кости и ухудшением ее качества, что приводит к повышенной хрупкости костей и переломам при небольших травмах. По данным эпидемиологических исследований, проведенных в России, остеопороз и ассоциированные с ним переломы представляют серьезную проблему для здравоохранения страны. Так, самый тяжелый остеопоротический перелом – перелом проксимального отдела бедренной кости в течение года развивается у двух россиян из 1000 в возрасте 50 лет и старше. Согласно прогнозу, к 2035 г. его частота может возрасти на 136% у мужчин и на 143% у женщин [1].
Поскольку с возрастом ухудшается состояние костной ткани и соответственно увеличивается риск падений [2], подход к лечению остеопороза должен быть комплексным и включать помимо медикаментозного лечения, направленного на повышение минеральной плотности (МПК) и качества кости, разнообразные способы предупреждения падений. Имеющиеся в арсенале клинициста современные средства лечения остеопороза, такие как антирезорбенты и анаболики, не влияют на риск падений. Именно поэтому неотъемлемой частью профилактики и лечения остеопороза должно стать применение витамина D₃, который будет сопровождать любой препарат патогенетического действия [3].
Витамин D₃ (колекальциферол) синтезируется в коже под действием UVB-лучей либо поступает с пищей. Время его циркуляции в крови ограниченно: он достаточно быстро поступает в жировую ткань или печень, где может продолжительное время находиться в неактивной форме. Для превращения в активную субстанцию колекальциферол должен пройти два этапа гидроксилирования – 25-гидроксилирование в печени, 1-альфа-гидроксилирование ферментом CYP27B1 в почках. Конечным продуктом метаболизма является активная форма витамина D – 1-альфа,25-дигидроксивитамин D₃ (1,25(ОН)₂D₃) – стероидный гормон, играющий ключевую роль в кальциевом гомеостазе. Он стимулирует абсорбцию кальция стенками кишечника и костную резорбцию, после чего кальций выходит в кровеносное русло в ответ на гипокальциемию.
Активные метаболиты
Повышенный интерес к метаболизму витамина D₃ и понимание его роли в состоянии костной ткани и других систем способствовали появлению за последние десятилетия значительного количества пролекарств, являющихся синтетическими аналогами витамина D₃ и требующих одного этапа гидроксилирования, чтобы стать биологически активными. Обычно в клинической практике применяются кальцитриол и альфакальцидол. Использование этих препаратов позволяет миновать второй этап активации витамина D₃ – 1-альфа-гидроксилирование в почках, что особенно важно при лечении больных старше 45 лет и тех, кто страдает хроническими заболеваниями почек, у кого до внедрения в практику этих препаратов развивалась почечная остеодистрофия, вызванная нарушением метаболизма витамина D₃. Оба препарата повышают абсорбцию кальция и фосфора в кишечнике и реабсорбцию кальция в почках, улучшая тем самым МПК. Это предопределило использование активных метаболитов для лечения заболеваний костной ткани, не связанных с нарушением функции почек, в частности первичного и вторичного остеопороза.
Сравнительный анализ кальцитриола и альфакальцидола
Суммарная оценка эффективности активных метаболитов витамина D представлена в систематических обзорах Кохрановской библиотеки и в нескольких метаанализах. Если в первых исследованиях сравнивали действие активных метаболитов с действием плацебо или кальция, то в последнее время эффективность активных метаболитов и нативного витамина D. Прием активных метаболитов витамина D снижал риск позвоночных переломов в два раза, а применение в течение трех лет снижало риск периферических переломов, кроме перелома проксимального отдела бедра [4]. В связи с этим часто при проведении метаанализов исследования обоих метаболитов объединяют.
Кальцитриол – синтетический препарат, по сути идентичный самому активному метаболиту витамина D – 1,25-дигидрохолекальциферолу. В 2010 г. опубликован систематический обзор 23 исследований использования кальцитриола для лечения остеопороза и предупреждения переломов [5]. Как показали результаты исследований, препарат эффективно снижает уровень паратгормона (ПТГ), маркеров костной резорбции (NTX) и повышает концентрацию маркеров костеобразования (остеокальцина). Для достижения этих эффектов достаточно четырех недель приема кальцитриола. Авторы обзора отмечают недостаточное количество исследований, посвященных влиянию приема препарата на увеличение костной массы и снижение риска переломов. Большинство работ проведено с участием незначительного числа пациентов и продолжалось от одного года до трех лет. Тем не менее в 11 исследованиях из 19 было продемонстрировано повышение МПК на 1–3% в год, а в пяти публикациях из десяти удалось показать влияние кальцитриола на снижение риска переломов. Интересно, что комбинированный прием алендроната и кальцитриола и заместительная гормональная терапия с кальцитриолом были эффективнее монотерапии любым из этих препаратов.
Широкому применению кальцитриола в клинической практике мешает высокий риск развития гиперкальциемии (до 40%). Препарат связывается с рецепторами 1,25(ОН)₂D₃ в кишечнике сразу после приема, происходит быстрая абсорбция кальция, а следовательно, повышается риск острой гиперкальциемии. Последняя обычно наблюдается, если кальцитриол принимается два раза в сутки. В то же время при интермиттирующем режиме (три дня подряд в неделю или один раз в неделю) гиперкальциемия отмечается реже [5].
Альфакальцидол – синтетический аналог кальцитриола, отличающийся от последнего только отсутствием гидроксильной группы в положении 25. Фармакологическое действие альфакальцидола обусловлено его трансформацией в кальцитриол. В отличие от кальцитриола альфакальцидол в кишечнике находится в неактивной форме и становится активным только после биотрансформации в печени или непосредственно в костях. Это приводит к более низким концентрациям 1,25(OH)₂D₃, чем при приеме кальцидола. Поскольку альфакальцидол дольше задерживается в костях, он ассоциируется с меньшим риском гиперкальциемии, следовательно, препарат безопаснее кальцитриола. Этим и определяется более широкое его использование в клинической практике. Альфакальцидол дозозависимо подавляет костную резорбцию (независимо от подавления секреции ПТГ), стимулирует костеобразование, повышает МПК, механическую прочность кости с особенно выраженным эффектом на кортикальную кость.
Наиболее широко в терапии используется лекарственный препарат Альфа Д₃-Тева®, международный и российский опыт применения которого позволяет рекомендовать его для профилактики и лечения различных форм остеопороза, а также для профилактики падений и переломов [7–12, 14, 15, 21]. Для лечения остеопороза препарат назначается по 0,5–1 мкг/сут, продолжительность приема определяется индивидуально, но не менее трех месяцев [7–12, 14, 15, 20, 21].
Монотерапия альфакальцидолом
В настоящее время опубликованы результаты исследований монотерапии альфакальцидолом и его комбинации с другими препаратами, свидетельствующие об эффективности препарата при различных клинических сценариях.
Были продемонстрированы преимущества альфакальцидола по сравнению с нативным витамином D в отношении повышения МПК у женщин с постменопаузальным остеопорозом. В исследовании участвовали 148 женщин в постменопаузе продолжительностью не менее пяти лет с переломом хотя бы одного позвонка или Т-критерием
J.D. Ringe и соавт. (2013) в течение двух лет проводили проспективное наблюдательное исследование монотерапии альфакальцидолом в лечении остеопороза у мужчин [7]. К сожалению, это не было рандомизированным исследованием. Более того, исследуемые группы больных существенно отличались клинически. Группу альфакальцидола (1 мкг/сут + 500 мг кальция) составили пациенты, перенесшие переломы позвонков, а группу нативного витамина D (1000 МЕ вместе с 1000 мг кальция) – пациенты без переломов позвонков. Всего в исследовании приняли участие 214 пациентов. Лучшая динамика МПК в области позвоночника и бедра выявлена у тех, кто принимал альфакальцидол. В этой же группе за период наблюдения отмечалось меньше позвоночных и периферических переломов и существенно меньше падений (18 против 38, р = 0,041). Преимущество альфакальцидола было связано с бóльшим снижением риска внепозвоночных переломов у больных с клиренсом креатинина
Применение альфакальцидола в комбинированной терапии
В клинической практике активные метаболиты витамина D назначаются при заболеваниях, в комплексной терапии которых используются глюкокортикостероиды (ГКС) (диффузных заболеваниях соединительной ткани, бронхиальной астме, воспалительных заболеваниях кишечника), а также в случае трансплантации органов. Проблемам комбинированной терапии посвящено достаточно много клинических испытаний. В метаанализе 54 клинических исследований (в 21 изучалось влияние активных метаболитов витамина D на МПК позвоночника, в 12 – на уменьшение риска переломов) показано положительное влияние активных метаболитов витамина D на увеличение МПК позвоночника при длительном приеме ГКС по сравнению с плацебо, нативным витамином D и/или кальцием [8]. В то же время по эффективности активные метаболиты витамина D уступали бисфосфонатам, в частности алендронату (ES -1,71; -0,36) [9]. Аналогичные данные получены при изучении влияния активных метаболитов витамина D на риск позвоночных переломов при ГКС-остеопорозе: показано снижение их риска в 1,8 раза по сравнению с приемом плацебо, нативного витамина D и/или кальция, однако по отношению к бисфосфонатам эффективность активных метаболитов витамина D была ниже [9].
У пациентов, которые в течение трех лет принимали ГКС в дозе 8 мг/сут и более и в последующие три года альфакальцидол, по сравнению с пациентами, принимавшими нативный витамин D (обе группы дополнительно принимали 500 мг кальция), значительно повышалась МПК в позвоночнике и шейке бедра. За три года приема альфакальцидола снизилось количество переломов, в том числе позвоночных. По частоте возникновения побочных эффектов, включая гиперкальциемию, группы не различались [10].
Поскольку активные метаболиты витамина D продемонстрировали клиническую эффективность, не превышавшую таковую бисфосфонатов, особый интерес представляет анализ применения комбинированной терапии альфакальцидола и алендроната. В ходе исследования ААС (Alfacalcidol Alendronate combined – комбинированая терапия алендронатом и альфакальцидолом) [11] оценивали эффективность и безопасность комбинированной терапии у больных с постменопаузальным и мужским остеопорозом. Участники были разделены на три группы по 30 пациентов. Первая группа получала 70 мг алендроната один раз в неделю и 1 мкг альфакальцидола + 500 мг кальция ежедневно, вторая – 70 мг алендроната + 1000 МЕ нативного витамина D один раз в неделю и 1000 мг кальция один раз в день, третья – только 1 мкг альфакальцидола + 500 мг кальция один раз в день. Во всех группах отмечался прирост МПК в позвоночнике и бедре. В группе, принимавшей алендронат и альфакальцидол, результат оказался существенно лучше, чем в группе комбинированного приема алендроната и нативного витамина D. Статистически значимые различия были зарегистрированы уже через 12 месяцев. Аналогичный результат имел место и по частоте падений и переломов (позвоночных и внепозвоночных), но статистически значимых различий не было, что можно объяснить немногочисленными группами.
В 2011 г. группа немецких исследователей во главе с D. Felsenberg [12] опубликовала результаты изучения аддитивного влияния альфакальцидола на МПК и прочность кости при лечении алендронатом пациенток с постменопаузальным остеопорозом. Авторы использовали количественную компьютерную томографию, чтобы оценить состояние и прочность кортикальной и трабекулярной кости. В рандомизированном исследовании участвовали 279 женщин с постменопаузальным остеопорозом или остеопенией в возрасте ≥ 65 лет (средний возраст 73,6 ± 4,7 года) с нарушениями в тестах на равновесие. Дополнительным критерием включения в исследование стало минимум одно падение за последние пять лет. Все больные получали 70 мг алендроната еженедельно и 500 мг кальция ежедневно. Кроме того, основная группа дополнительно принимала ежедневно 1 мкг альфакальцидола, контрольная – плацебо. Динамику оценивали каждые три месяца на протяжении трех лет с использованием DXA (Dual-energy X-ray Absorbtiometry – двухэнергетическая рентгеновская абсорбциометрия) и аппарата pQCT (XCT2000 Stratec). Кроме того, изучали биохимические показатели костного обмена и обмена витамина D.
DXA показала в обеих группах увеличение МПК в позвоночнике, но в группе комбинированной терапии алендроната и альфакальцидола МПК с 12-го месяца лечения была выше. Существенной динамики МПК в области бедра по результатам DXA не отмечено ни в одной группе. Периферическая компьютерная томография продемонстрировала рост объемной МПК в предплечье за три года лечения. Однако изменения произошли только в кортикальной, но не в трабекулярной кости. Напротив, в большеберцовой кости зарегистрирован прирост МПК и трабекулярной, и кортикальной.
В группе комбинированной терапии наблюдалась положительная динамика показателей кальциевого гомеостаза: за 12 месяцев снизился уровень ПТГ, после чего данные стабилизировались и оставались неизменными. Также за 24 месяца повысился уровень кальция в плазме крови (показатель при этом оставался в пределах нормы). В группе плацебо к 36-му месяцу отмечались рост ПТГ и снижение кальция. Уровень кальция у незначительного числа пациентов в период наблюдения приближался к верхней границе нормы. К концу третьего года лечения у одной пациентки из основной группы развилась гиперкальциемия (2,77 нмоль/л), у шести уровень кальция был ниже нормы. Авторы сделали вывод, что гиперкальциемия при лечении альфакальцидолом не представляет клинической проблемы, если препарат добавляется к бисфосфонатам.
Другой не менее интересный аспект использования активных метаболитов витамина D – их роль в терапии остеопороза после завершения длительного приема бисфосфонатов – во время так называемых лекарственных каникул. В последние годы появились рекомендации о возможности прекращения приема бисфосфонатов у части пациентов после трех – пяти лет применения [13].
J.D. Ringe и E. Schacht [14] сравнили эффективность нативного витамина D и альфакальцидола в терапии после длительного лечения бисфосфонатами. Первая группа (пациентки с постменопаузальным остеопорозом) ежедневно получала 800 МЕ нативного витамина D и 1200 мг кальция, вторая – 1 мкг альфакальцидола и 500 мг кальция. Авторы констатировали существенный прирост МПК позвоночника при лечении альфакальцидолом. Данный эффект отсутствовал при приеме нативного витамина D (р
Ряд исследований и метаанализов был посвящен оценке влияния активных метаболитов витамина D на снижение риска падений. Метаанализ 2008 г., посвященный сравнению эффективности активных метаболитов и нативного витамина D в отношении снижения риска падений, показал достоверное преимущество использования активных метаболитов (альфакальцидола и кальцитриола) [15]. Этот факт объясняется геномными и негеномными механизмами, в частности их влиянием на регуляцию метаболизма кальция в мышцах, дифференцировку поперечно-полосатых мышц, индукцию синтеза фактора роста нервных клеток. При этом прослеживалась четкая связь с уровнем креатинина у пациентов: при клиренсе креатинина менее 65 мл/мин уменьшалось число пациентов, подверженных падениям (снижение относительного риска составило 74%, р = 0,019), и падений (снижение относительного риска 71%, р = 0,028). У больных с клиренсом креатинина более 65 мл/мин такой зависимости не наблюдалось [16].
В недавней публикации S. Ito и соавт. (2014) [21], основанной на ретроспективном анализе пациентов с остеопорозом, было продемонстрировано положительное влияние альфакальцидола на увеличение мышечной массы у пациентов со сниженной мышечной массой. В группе, не получавшей подобного лечения, такой эффект отсутствовал.
Как следует из приведенных результатов рандомизированных исследований, безопасность длительного приема альфакальцидола в различных группах пациентов была сопоставима с таковой нативного витамина D, включая частоту гиперкальциемии.
Безопасность длительного применения альфакальцидола
Одно из многочисленных аналитических исследований безопасности длительного применения альфакальцидола было проведено в Японии. В нем участвовало 13 550 больных остеопорозом, принимавших альфакальцидол в дозе 0,5–1,0 мкг/сут в течение шести лет и более. Суммарная частота развития побочных эффектов составила 1,1%, гиперкальциемии – 0,22%. Повышение общего азота крови наблюдалось у 0,15% больных. Случаев формирования мочекаменной болезни не отмечено [17]. Кохрановский обзор [18], включавший 45 рандомизированных исследований, показал, что относительный риск гиперкальциемии у пациентов, принимавших витамин D или его аналоги (в сочетании с кальцием или без него), – 2,35%. При приеме кальцитриола риск гиперкальциемии был самым высоким (4,41%).
Заключение
Активные метаболиты витамина D продемонстрировали клиническую эффективность у пациентов с первичным и вторичным остеопорозом (в первую очередь глюкокортикоидным) в отношении прироста МПК и снижения риска переломов и падений. Это связано с разнонаправленным действием препаратов данной группы на костную и мышечную ткань. Эти препараты обладают также аддитивным эффектом при лечении бисфосфонатами. На фоне хорошего профиля безопасности альфакальцидол по сравнению с кальцитриолом
