Применение альфакальцидола в лечении остеопороза

Статья посвящена вопросам применения альфакальцидола в лечении больных остеопорозом
В настоящее время для лечения остеопороза (ОП) используются лекарственные препараты, доказавшие свою эффективность в отношении снижения риска переломов в ходе многоцентровых плацебо-контролируемых исследований. Это в первую очередь бисфосфонаты и деносумаб (антирезорбтивные средства), терипаратид (костный анаболик) и стронция ранелат (препарат с двойным механизмом действия). Для первичной профилактики заболевания и в составе комбинированной терапии ОП применяются кальций и витамин D. Среди препаратов витамина D особое место занимают его активные метаболиты, одним из которых является альфакальцидол – 1α(ОН)D3. При попадании в организм он гидроксилируется в печени под действием 25–гидроксилазы и превращается в D-гормон, или кальцитриол (1α,25(ОН)2D3). Механизм действия препарата состоит в связывании 1α,25(ОН)2D3 с рецепторами витамина D в органах-мишенях. В кишечнике это приводит к повышению абсорбции кальция и фосфора, а в почках – к увеличению реабсорбции в них кальция. Препарат нормализует кальций-фосфорный обмен: он подавляет костную резорбцию и стимулирует костеобразование, что ведет к увеличению минеральной плотности кости (МПК) и тем самым повышает механическую прочность кости. Преимуществом использования альфакальцидола по сравнению с другим активным метаболитом – кальцитриолом является то, что при его использовании возникает меньший риск развития гиперкальциемии. Это связано с тем, что он представляет собой «пролекарство», которое, попадая в кишечник и всасываясь в кровь в неактивной форме, не приводит к резкому повышению концентрации кальция в крови, в отличие от кальцитриола [1].
Альфакальцидол используется в лечении заболеваний костной ткани, в частности первичного и вторичного ОП, а также у больных с хроническими заболеваниями почек, у которых нарушено 1-альфа-гидроксилирование витамина D3.
Исследования, проведенные с использованием альфакальцидола и кальцитриола при первичном и глюкокортикоидном ОП, показали снижение риска переломов любой локализации по сравнению с контрольной группой, независимо от того, получали ли в ней пациенты дополнительно добавки кальция или нет, почти в 2 раза; оно не зависело от показателей МПК до начала лечения [2]. Кроме того, были показаны преимущества приема активных метаболитов по сравнению с холекальциферолом – нативным витамином D в отношении прироста МПК и снижения риска переломов позвонков и периферических костей при первичном ОП. Так, в исследовании R. Nuti еt al. продемонстрировано, что лечение 1 мкг альфакальцидола в сочетании с кальцием у женщин с постменопаузальным ОП и нормальным уровнем витамина D приводило через 12 мес. терапии к большему приросту МПК в позвоночнике по сравнению с группой, получавшей 880 МЕ нативного витамина D и кальций (2,33% против 0,70%, р=0,018), а к 18-му мес. увеличение МПК в группе альфакальцидола составило в среднем 2,87%, тогда как в группе, применявшей нативный витамин D, дальнейшего увеличения плотности кости не наблюдалось (р=0,005). Исследование также показало снижение риска новых переломов у пациенток основной группы по сравнению с контролем (7,1% против 11,9%), а по побочным эффектам группы между собой не различались [3].
Альфакальцидол показал свою эффективность в качестве монотерапии при глюкокортикоидном ОП. Так, в 3–летнем рандомизированном клиническом исследовании прием 1 мкг альфакальцидола и 500 мг кальция в сутки был более эффективным, чем прием 1000 МЕ витамина D3 и 500 мг кальция пациентами, длительно принимавшими системные глюкокортикоиды (СГК). В группе больных, принимавших альфакальцидол, отмечалось достоверно большее увеличение МПК поясничного отдела позвоночника (+2,4%) и шейки бедра (+1,2%) по сравнению с контролем (-0,8% и +0,8% соответственно); выявлено снижение риска переломов позвонков на 39%, периферических переломов – на 59%, переломов любой локализации – на 48%; кроме того, отмечено значимое уменьшение интенсивности болей в спине по сравнению с группой, получавшей нативный витамин D. Только у 3 пациентов в группе альфакальцидола и 2 пациентов в группе витамина D было выявлено увеличение уровня кальция в крови [4, 5]. В метаанализе, включавшем 54 работы по оценке влияния активных метаболитов витамина D у больных, получавших длительно СГК, на МПК позвоночника и на риск переломов, был показан их положительный эффект по сравнению с плацебо, нативным витамином D и/или кальцием: ES 0,35 (95% ДИ 0,18; 0,52) [2]. Аналогичные данные получены при изучении влияния активных метаболитов витамина D на риск переломов позвонков: показано снижение их риска в 1,8 раза при приеме альфакальцидола по сравнению с приемом плацебо, нативного витамина D и/или кальция (ОР 0,56; 95% ДИ 0,34; 0,92) [6].
Одной из причин возникновения переломов при ОП являются падения. В настоящее время имеется целый ряд работ, посвященных оценке влияния препаратов витамина D на снижение их риска, при этом было показано преимущество использования активных метаболитов по сравнению с нативным витамином D. Так, в метаанализе F. Richy еt al. было продемонстрировано снижение риска падений на 21% (ОР 0,79; 95% ДИ 0,64; 0,96) против 6% (ОР 0,94; 95% ДИ 0,87; 1,01) при приеме нативного витамина D [7]. Среди пожилых больных, имевших возрастное снижение функции почек (клиренс креатинина <65 мл/мин), на фоне приема альфакальцидола уменьшалось число пациентов, подверженных падениям, на 74% (р=0,019) [8]. Кроме того, имеются данные о большем положительном влиянии альфакальцидола на увеличение мышечной массы и мышечной силы по сравнению с нативной формой витамина D [9, 10].
Альфакальцидол может применяться для лечения первичного ОП не только у женщин, но и у мужчин, что было продемонстрировано в исследовании J.D. Ringe еt al. [11]. Мужчины, принимавшие альфакальцидол 1 мкг/сут в качестве монотерапии, имели больший прирост МПК в области позвоночника и бедра, меньшее количество произошедших позвоночных и периферических переломов (при этом значимое снижение риска периферических переломов было у больных с клиренсом креатинина <60 мл/мин), а также достоверно меньшее число падений, чем у пациентов, принимавших нативный витамин D.
Интерес ученых был привлечен и к возможности использования комбинации альфакальцидола с другими антиостеопоротическими препаратами. Например, эффективность альфакальцидола была доказана у мужчин и женщин в постменопаузе с ОП при совместном его назначении с алендронатом по сравнению с монотерапией каждым из препаратов в сочетании с кальцием, а для алендроната – еще и в комбинации с нативным витамином D. Во всех группах отмечался прирост МПК в позвоночнике и бедре, однако в группе, принимавшей алендронат и альфакальцидол, результат оказался значимо лучше уже через 12 мес. лечения, чем в группе комбинированного приема алендроната и нативного витамина D. Кроме того, отмечалось снижение частоты падений, которая была наименьшей в группе, получавшей альфакальцидол и алендронат [12].
Еще одно исследование по изучению аддитивного влияния 1 мкг альфакальцидола на МПК и прочность кости при лечении алендронатом продемонстрировало достоверно большее увеличение МПК в позвоночнике, а также рост объемной минеральной плотности в кортикальной кости предплечья за 3 года лечения, которые были выявлены с помощью периферической КТ, по сравнению с лицами, получавшими только алендронат и кальций [13].
Еще один аспект назначения альфакальцидола – это его прием после 3–5-летней непрерывной терапии бисфосфонатами во время так называемых «лекарственных каникул», которые возможны у пациентов с МПК в области шейки бедра >-2SD и при отсутствии переломов позвонков. Исследование J.D. Ringe и E. Schacht показало, что альфакальцидол не только стабилизировал МПК после завершения приема бисфосфонатов, но и способствовал ее увеличению, а также приводил к уменьшению количества падений по сравнению с этими показателями при приеме нативного витамина D, при одинаковой частоте побочных эффектов [14].
Таким образом, альфакальцидол может применяться у больных, страдающих как первичным, так и вторичным ОП; как монотерапия, так и в комбинации с бисфосфонатами, а также как препарат выбора после длительного приема бисфосфонатов. Альфакальцидол зарегистрирован в России в 1990-х гг. и включен в список препаратов для лечения ОП в современных клинических рекомендациях по ОП [15].
Целью нашего исследования было установить место альфакальцидола в лечении больных ОП в реальной клинической практике.
Материал и методы
Первая часть работы состояла из анкетирования врачей с использованием специально разработанного вопросника, включавшего в себя разделы по частоте и числу консультируемых больных ОП, регистрации заболевания в талонах статистической отчетности, используемым методам диагностики и лечению. Заполненные вопросники были получены от 307 врачей 6 основных специальностей, занимающихся проблемой ОП.
Вторая часть работы включала анкетирование пациентов с установленным диагнозом ОП и получавших не менее 1 года терапию по поводу этого заболевания. В опросе приняли участие 1799 больных в возрасте от 25 до 92 лет (средний возраст – 63,3±8,4 года), проживающих в 5 регионах России. Среди анкетированных было 265 (15%) мужчин (средний возраст – 63,0±8,4 года) и 1534 (85%) женщин (средний возраст – 63,5±8,4 года). Приверженность проводимой антиостеопоротической терапии оценивалась за последние 12 мес. перед анкетированием по следующим параметрам: длительность, отсутствие пропуска приемов, выполнение рекомендаций по приему препарата.
Третья часть работы включала проспективное 3-летнее наблюдение за 196 женщинами в постменопаузе (средний возраст 65,8±9,1 года), перенесших ОП-переломы проксимального отдела бедра, дистального отдела предплечья, шейки плечевой кости, позвоночника и лодыжки. На всех женщин заполнялась унифицированная анкета через 4, 12, 24 и 36 мес. после произошедшего перелома, в которую были включены вопросы о проведении антиостеопоротического лечения и приверженности ему.
Статистическая обработка проводилась с использованием параметрических (тест Стьюдента для несвязанных выборок) и непараметрических (тесты Вилкоксона, Манна – Уитни, точный критерий Фишера) критериев. При нормальном распределении данные представлены через среднее (М) и стандартное отклонение (СО). Данные, не имеющие нормального распределения, выражены через медиану (Ме), 25 и 75 процентили. Различия считались статистически значимыми при величине p<0,05.
Результаты и обсуждение
Анкетирование врачей показало, что они в месяц в среднем консультируют 12 [1; 40] больных по поводу ОП, при этом терапевты принимали 6 [3; 20], неврологи – 6 [3; 30], гинекологи – 6 [1; 8], травматологи – 12 [6; 18], эндокринологи – 16 [8; 20] и ревматологи – 20 [12; 40] пациентов ежемесячно. Ревматологи и эндокринологи наблюдали больных ОП чаще, чем врачи других специальностей (p<0,001 и p<0,05 соответственно). В качестве основной терапии ОП врачи в 24% случаев рекомендовали препараты кальция и витамина D, при этом треть этих назначений приходилась на долю активных метаболитов витамина D в качестве монотерапии (рис. 1). Кроме того, врачи в 19% случаев назначали альфакальцидол в сочетании как с антирезорбтивными препаратами, так и со стронция ранелатом.
Опрос пациентов показал, что в 43% случаев диагноз ОП был поставлен ревматологом, в 17% – терапевтом, в 15% – травматологом, в 13% – эндокринологом, в 9% – неврологом и в 3% – гинекологом.
Было установлено, что 452 (25%) человека принимали альфакальцидол в качестве монотерапии и в комбинации с другими антиостеопоротическими препаратами (рис. 2), мужчины и женщины с одинаковой частотой (23% и 26% соответственно, p>0,05). Рекомендации по приему альфакальцидола пациенты получили в 29% случаев от ревматологов, реже от травматологов (24%), неврологов (23%), эндокринологов (21%) и терапевтов (20%), при этом ревматологи достоверно чаще назначали его больным, чем терапевты и эндокринологи (χ2= 18,02, p=0,006).
Пациенты, принимавшие альфакальцидол, были старше (средний возраст – 64,4±8,6 года) больных, получавших лечение препаратами, содержащими кальций и/или нативный витамин D (средний возраст – 63,1±8,4 года) (p<0,01), у них чаще выявлялись предшествующие ОП-переломы (42% и 35% соответственно, p=0,0083). Кроме этого, лица, получавшие альфакальцидол, имели более длительную продолжительность болезни (p<0,0001), принимали большее общее количество таблеток в день по поводу всех других заболеваний (p=0,007) и были менее привержены лечению ОП (38% по сравнению с 44%, p=0,026).
В качестве монотерапии ОП альфакальцидол принимали 52 (12%) пациента, среди них 5 (10%) человек в возрасте моложе 50 лет. Опрос больных ОП показал, что достоверно реже они получали рекомендацию по монотерапии альфакальцидолом от ревматологов (в 6% случаев), чем от терапевтов и травматологов (23% и 21% соответственно, р<0,05).
Анкетирование 196 пациенток, перенесших ОП-перелом, продемонстрировало, что в течение первых 4-х мес. после него какую-либо противоостеопоротическую терапию получали 114 (58%) опрошенных, при этом достоверно чаще – женщины с переломами позвонков (p=0,0055). Альфакальцидол принимали 35 (30,7%) человек: 6 (5,3%) – как монотерапию, 29 (25,4%) – в сочетании с бисфосфонатами. Наиболее часто альфакальцидол назначался больным, перенесшим перелом проксимального отдела бедра и позвоночника, по сравнению с лицами, у которых перелом случился в остальных 4-х областях скелета. К 12-му мес. лечение ОП проводилось у 106 больных, при этом 42 (40%) человека получали альфакальцидол, из них 9 женщин – монотерапию. Через 24 и 36 мес. антиостеопоротическое лечение получали 94 и 63 человека соответственно, а альфакальцидол принимали 22 (23,4%) и 11 (17,5%) пациентов соответственно, при этом монотерапию – 7 и 4 человека соответственно (рис. 3). Достоверно чаще альфакальцидол получали лица в возрасте 65 лет и старше. Общая приверженность лечению среди пациенток, начавших терапию в течение первых 4-х мес. после перелома, составила 20% к 36-му мес., при этом для монотерапии альфакальцидолом этот показатель составил 50%, а для комбинированной – 21%. 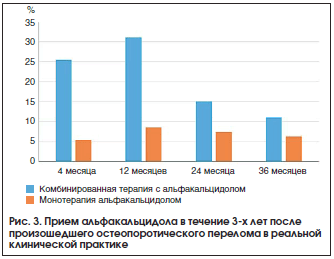
Таким образом, наше исследование показало, что альфакальцидол не потерял своей актуальности в лечении больных ОП в реальной клинической практике: его назначали в 8% случаев в качестве монотерапии, а в 19% – в сочетании с другими антиостеопоротическими лекарственными средствами. Наиболее часто по сравнению с другими врачами альфакальцидол рекомендовали ревматологи, при этом предпочтение отдавалось комбинированному лечению. Независимый опрос больных ОП выявил, что 25% анкетированных лиц принимали его в качестве как основной терапии ОП (12%), так и в комбинации с другими антиостеопоротическими препаратами, при этом он использовался практически с одинаковой частотой у мужчин и женщин. Следует отметить, что лица, принимавшие альфакальцидол, были старше по возрасту и, как следствие, имели более длительный срок болезни. Это оправданно, т. к. у пожилых людей с возрастом отмечается уменьшение скорости клубочковой фильтрации, которое способствует снижению гидроксилирования витамина D в почках, ведет к недостаточности образования D-гормона и сопровождается развитием толерантности к нативному витамину D. Таким образом, на фоне эндокринно-иммунной дисфункции происходит снижение общей мышечной массы и появляется синдром мышечной слабости, что сопровождается повышением риска падений и обусловленных этим травм и переломов. В ряде исследований было показано значительное снижение частоты падений пациентов пожилого возраста при применении альфакальцидола [8].
Еще один положительный аспект назначения альфакальцидола – достаточная безопасность при длительном приеме. Так, применение альфакальцидола ≥6 лет в дозе 0,5–1,0 мкг/сут показало, что суммарная частота развития побочных эффектов составила 1,1%, а гиперкальциемии – лишь 0,22%, случаев формирования мочекаменной болезни не было отмечено [16]. В другом обзоре было продемонстрировано, что относительный риск гиперкальциемии у пациентов, принимавших витамин D или его аналоги (в сочетании с кальцием или без него), составил всего 2,35% [17].
Заключение
Опрос врачей и пациентов с ОП и ОП-переломами продемонстрировал, что в реальной клинической практике альфакальцидол, имея оптимальный профиль безопасности, продолжает широко применяться как для моно-, так и для комбинированной терапии ОП. Горизонты его использования расширились в связи с возможностью перевода больных с лечения бисфосфонатами на альтернативную терапию альфакальцидолм во время «лекарственных каникул».
Источник
Важнейшей особенностью остеопороза (ОП) является уменьшение массы кости в единице объема и прогредиентное нарушение микроархитектоники костной ткани, которое довольно длительное время протекает с отсутствием клинических проявлений. Нередко основанием для обращения к врачу, установления диагноза и начала терапии становятся низкотравматические переломы костей, которые развиваются на фоне существенных костных потерь.
Низкоэнергетические переломы, развивающиеся вследствие ОП, сопряжены с острой и хронической болью, дестабилизацией кардиоваскулярной патологии, инвалидизацией, ограничением двигательной функции вплоть до полной иммобилизации, утратой самостоятельности в повседневной жизни, а в некоторых случаях — полной социальной изоляцией. Известно, что общий риск переломов дистального отдела предплечья, позвонков и проксимального отдела бедренной кости в течение жизни сопоставим с риском коронарной болезни сердца [1, 2]. Согласно эпидемиологическим данным, продолжительность госпитализации женщин возрастной группы старше 45 лет по поводу низкотравматичного перелома проксимального отдела бедренной кости вследствие остеопороза значительно больше, чем по причине других заболеваний (сахарный диабет, хроническая обструктивная болезнь легких, инфаркт миокарда, рак молочной железы) [3, 39]. Низкотравматичные переломы отнимают больше ожидаемой продолжительности здоровой жизни (повышают показатель DALY (Disability Adjusted Life Year — годы жизни с поправкой на инвалидность)), чем любые онкологические заболевания, за исключением рака легких. В сравнении с хроническими ревматическими скелетно-мышечными заболеваниями потеря эффективных лет жизни, связанных с низкоэнергетическими переломами, в несколько раз меньше, чем для остеоартроза, но выше, чем для ревматоидного артрита [4].
Наряду с потерей костной массы и соответствующим снижением прочности кости особую роль в повышении риска переломов играют падения. Нужно учитывать, что у пациентов пожилого возраста, особенно с остеопорозом, на фоне эндокринно–иммунной дисфункции возникают снижение общей мышечной массы (саркопения) и слабость произвольных мышц (синдром слабости). Также среди причин возникновения падений можно отметить снижение остроты зрения и сужение полей зрения, нарушения функционирования вестибулярного аппарата. Известно, что более чем у 50% пациентов с остеопорозом имеется саркопения, примерно 25% из них страдают постуральной гипотензией, а у подавляющего большинства ослаблено зрение и частично нарушена способность к передвижению [5].
Вклад саркопении в структуру причин падений лиц пожилого возраста заслуживает отдельного внимания. Дегенеративная потеря мускулатуры, ухудшение качества мышечных волокон, снижение силы сокращения мышц, наряду с ОП, являются причиной немощности пожилых людей, утраты способности к ежедневному самообслуживанию и потери ими независимости [6]. Примечательно, что при саркопении ранее всего происходит ухудшение функционирования быстрых мышечных волокон, ответственных за сохранение равновесия при изменении положения центра тяжести, что, в свою очередь, лежит в основе самопроизвольных падений. Известно, что у пожилых людей через каждые 10 лет частота падений увеличивается на 10% [7]. При этом 5,3% всех госпитализаций и 90% переломов проксимального отдела бедра обусловлены именно падениями с высоты собственного роста [8, 9]. Важно, что среди факторов риска внепозвоночных переломов падения более значимы, чем снижение минеральной плотности костной ткани само по себе [10–12]. Известно, что выраженность нервно-мышечной недостаточности находится в прямой зависимости от степени минерализации костной ткани [13]. Важно подчеркнуть — несмотря на то, что ОП является фактором риска переломов любых костей, он, не провоцирует возникновение спонтанных переломов. Исключением в данном случае являются только переломы тел позвонков, которые могут развиться при выполнении привычных действий и нагрузок. Увеличение же с возрастом частоты переломов шейки бедра у пациентов на фоне ОП все-таки объясняется большей склонностью пожилых людей к падениям, риск которых повышается вследствие снижения мышечной массы.
Одним из ведущих факторов, существенно увеличивающих риск развития переломов у лиц пожилого возраста, является дефицит витамина D [14–16]. У пожилых людей с дефицитом витамина D снижена мышечная сила и способность сохранять баланс при передвижении, что может проявляться неустойчивостью походки. Разумеется, такие пожилые люди чаще теряют равновесие и падают [17]. Примечательно, что дефицит D-гормона может наблюдаться даже при нормальном поступлении витамина D. Так в отдельных когортах (больные с нарушением функции почек, тяжелыми заболеваниями гепатобилиарной системы, ожирением или достаточно преклонного возраста) создается целый ряд предпосылок к формированию дефицита витамина D. Нарушение, например, превращения нативного витамина D в D-гормон при тяжелых заболеваниях почек и печени. Депонирование нативного витамина D (как жирорастворимого витамина) в жировой ткани с формированием относительного дефицита циркулирующего D-гормона у лиц с ожирением [18] Снижение экспрессии рецептора к D-гормону наблюдается у людей пожилого возраста [19]. Помимо этого, последствиями дефицита витамина D являются снижение абсорбции и уровня Са2+, а также повышение уровня ПТГ в сыворотке крови, нарушение процессов костного ремоделирования и минерализации костной ткани [20, 21]. Повышение активности остеокластов, опосредованное ПТГ, способствует формированию локальных зон резорбции кости и, в последующем, приводит к системной потере костной ткани с развитием остеопении и ОП. В итоге происходит нарушение минерализации скелета [22]. Соответственно, назначение нативного витамина D оказывает положительное влияние на снижение риска падений и, как следствие, переломов [23].
Между тем чрезвычайно важно понимать разницу между стратегией профилактического назначения нативного витамина D пожилым пациентам с дефицитом витамина D и стратегией лекарственной терапии препаратами D-гормона или его аналогами (альфакальцидол), независимо от уровня 25(ОН)D в сыворотке крови.
В последние годы особая роль в терапии вышеописанных состояний отводится D–гормону (кальцитриолу), конечному метаболиту витамина D, который обладает не только выраженным влиянием на обмен кальция, но и рядом других важных биологических функций. D-гормон, вместе с ПТГ и кальцитонином, относится к группе кальций–регулирующих гормонов, важной функцией которых является поддержание в плазме крови физиологического уровня кальция. За счет взаимодействия с рецепторами витамина D (VDR-рецепторы) в клетках-мишенях, D-гормон вызывает синтез кальций–связывающих белков, которые осуществляют абсорбцию кальция в ЖКТ, его реабсорбцию в почках и последующую фиксацию в скелете. Помимо этого, D-гормон оказывает влияние и на функции скелетных мышц, в которых также имеются специфические VDR-рецепторы.
На сегодняшний день пациент может получить D-гормон посредством приема разных препаратов — например, нативного витамина D, а также альфакальцидола. Оба средства реализуют свое действие через общий биологически активный метаболит — кальцитриол (D-гормон). Причем в организме альфакальцидол (Альфа Д3-Тева®), метаболизируется до D-гормона только в печени, минуя почки, что может быть важно для пациентов со сниженной почечной функцией [24].
Действие альфакальцидола в поддержании кальциевого и костного гомеостаза осуществляется через взаимодействие с ядерным рецептором витамина D (VDR) в органах-мишенях, прежде всего кишечнике, костях, почках и паращитовидных железах [25, 26]. В условиях дефицита D-гормона, основными эффектами физиологических и фармакологических концентраций кальцитриола являются:
- повышение уровня кальция (Са2+) в плазме крови за счет стимуляции его абсорбции в кишечнике и реабсорбции в дистальных отделах почечных канальцев;
- снижение содержания ПТГ в плазме крови, которое осуществляется двумя путями: во-первых, вследствие прямого ингибирования генной транскрипции ПТГ за счет связывания с VDR паращитовидных желез, во-вторых, в результате непрямого ингибирования секреции ПТГ за счет повышения концентрации Са2+ в плазме крови [25, 26];
- уменьшение резорбции и увеличение образования костной ткани за счет снижения содержания ПТГ и влияния на Са2+ и фосфатный гомеостаз [27–29].
Особенностью препаратов витамина D является их хорошая переносимость. Прием добавок нативного витамина D пациентами с недостаточностью витамина D и сопутствующими низкими уровнями субстрата 25(OH)D3, в большинстве случаев может оказаться достаточным. Так, у пациентов с дефицитом витамина D и низким потреблением Са2+ добавки нативного витамина D уменьшают выраженность ОП и частоту невертебральных переломов [30, 31]. Между тем применение нативного витамина D у лиц пожилого возраста может оказаться неэффективным вследствие нарушения метаболизации до D-гормона в почках и снижения чувствительности рецепторов кишечника к D-гормону. В таких случаях коррекция нарушений синтеза, рецепции и активности кальцитриола требует назначения нативного витамина D в дозах, существенно превышающих не только физиологические, но и фармакологические, что может привести к интоксикации витамином D вследствие его депонирования в мягких тканях и длительного периода полувыведения [32–34].
В исследованиях с применением альфакальцидола по сравнению с нативным витамином D, выявлено статистически значимое увеличение минеральной плотности кости (МПК) и уменьшение (более чем в 2 раза) частоты возникновения переломов позвонков [24, 27, 35].
Костные эффекты и безопасность применения 1 мкг/сут альфакальцидола и комбинации витамина D 880 МЕ/сут с Са2+ 1000 мг/сут в терапии пациенток белой расы с постменопаузальным ОП и отсутствием дефицита витамина D оценены в многоцентровом рандомизированном сравнительном исследовании. Через 12 месяцев от начала лечения в группе пациенток, принимавших 1 мкг/сут альфакальцидола, произошло увеличение МПК поясничного отдела позвоночника на 2,33% (от исходного уровня), а через 18 месяцев — на 2,87% (р < 0,001); в группе, принимавшей витамин D и кальций, — только на 0,7%. Причем межгрупповые различия были статистические значимы (р = 0,018; 0,005).
Одним из основных механизмов действия альфакальцидола при ОП является нормализация сниженного синтеза кальцитриола и, соответственно, коррекция мальабсорбции Са2+ путем стимуляции экспрессии рецепторов эстрогенов в костных клетках, опосредованной кальцитриолом. Хотя синтезируемый из альфакальцидола кальцитриол не участвует в регуляции минерализации непосредственно, а скорее увеличивает уровни Са2+, это не исключает воздействия его на органический матрикс кости или на факторы роста кости. Напротив, к эффектам альфакальцидола можно отнести также повышение секреции кальцитонина и нормализацию разобщенных процессов ремоделирования костной ткани посредством увеличения ТФР-β и остеопротегерина (OPG), что, в свою очередь, определяет ингибирование постменопаузальной продукции цитокинов, резорбирующих костную ткань, особенно ФНО-α, и увеличение выделения ТФР-β, что обеспечивает восстановление ослабленного апоптоза остеокластов и замедление процессов резорбции [13].
Наряду с этим, к настоящему времени накоплены данные, которые могут быть использованы в качестве обоснования преимуществ альфакальцидола перед нативным витамином D в контексте лечения остеопороза. Привлекает внимание и способность альфакальцидола преодолевать резистентность рецепторов к D-гормону и увеличивать их экспрессию [35].
Сравнительный метаанализ эффективности двух режимов терапии — альфакальцидолом и нативным витамином D (14 исследований с общим количеством пациентов 21 268) показал статистически значимое снижение абсолютного риска падений в 3,5 раза при терапии активными метаболитами по сравнению с препаратами нативного витамина D 0,79 (95% ДИ 0,64–0,96) против 0,94 (95% ДИ 0,87–1,01) (р = 0,049) [36]. Режим терапии альфакальцидолом в суточной дозе 1 мкг в сутки на протяжении 12–24 недель сопровождался относительным увеличением числа мышечных волокон типа А и их поперечного сечения на фоне незначительного уменьшением доли волокон типа B. При этом время, затраченное пациентами на то, чтобы одеться, статистически значимо уменьшалось [37]. Наряду с этим 24 недели терапии альфакальцидолом пациенток пожилого возраста с дефицитом витамина D способствовали статистически значимому улучшению мышечной силы (изометрической силы разгибания колена) и функциональных возможностей (расстояние, которое они могли пройти за две минуты) [38]. Очевидно, что некоторые патогенетические факторы возрастной саркопении у пациентов с ОП могут быть уравновешены терапией альфакальцидолом — получены клинические данные об эффективности альфакальцидола в аспекте увеличения утраченной мышечной силы [27].
Таким образом, альфакальцидол (Альфа Д3-Тева®) не только эффективно повышает минеральную плотность кости, улучшает качество костной ткани, но и улучшают нервно-мышечную проводимость и сократимость двигательных мышц, а также координацию движений, что в итоге снижает риск развития падений и переломов. Альфакальцидол продемонстрировал преимущество перед нативным витамином D, что обосновывает целесообразность его использования в комплексной терапии ОП и профилактике его осложнений.
Литература
- Kanis J. A. Diagnosis of osteoporosis and assessment of fracture risk // Lancet. 2002.; Vol. 359 (9321): 1929–1936.
- Pludowski P., Holick M. F., Pilz S., Wagner C. L., Hollis B. W., Grant W. B., Shoenfeld Y., Lerchbaum E., Llewellyn D. J., Kienreich K., Soni M. Vitamin D effects on musculoskeletal health, immunity, autoimmunity, cardiovascular disease, cancer, fertility, pregnancy, dementia and mortality-a review of recent evidence // Autoimmun Rev. 2013; 12 (10): 976–989.
- Kanis J. A., Delmas P. D., Burckhardt P. et al. Guidelines for diagnosis and management of osteoporosis. The European Foundation for Osteoporosis and Bone Disease // Osteoporos. Int. 1997; 7 (4): 390–406.
- Johnell O., Kanis J. A., Oden A. et al. Mortality after osteoporotic fractures // Osteoporos. Int. 2004; 15 (1): 38–42.
- Шварц Г. Я. Остеопороз, падения и переломы в пожилом возрасте: роль D-эндокринной системы // Русский медицинский журнал. 2008. Т. 16. № 10. С. 1–10.
- Dam T. T., Peters K. W., Fragala M. et al. An evidence-based comparison of operational criteria for the presence of sarcopenia // J. Gerontol. A Biol. Sci. Med. Sci. 2014; 69 (5): 584–590.
- Tinetti M. E., Speechley M., Ginter S. F. Risk factors for falls among elderly persons living in the community // N. Engl. J. Med. 1988; 319 (26): 1701–1707.
- De Rekeneire N., Visser M., Peila R. et al. Is a fall just a fall: correlates of falling in healthy older persons. The Health, Aging and Body Composition Study // J. Am. Geriatr. Soc. 2003; 51 (6): 841–846.
- Nevitt M. C., Cummings S. R., Kidd S., Black D. Risk factors for recurrent nonsyncopal falls. A prospective study // JAMA. 1989; 261 (18): 263–266.
- Järvinen T. L., Sievänen H., Khan K. M. et al. Shifting the focus in fracture prevention from osteoporosis to falls // BMJ. 2008; 336 (7636): 124–126.
- Kannus P., Niemi S., Parkkari J. et al. Why is the age-standardized incidence of low-trauma fractures rising in many elderly populations? // J. Bone Miner. Res. 2002; 17 (8): 1363–1367.
- Kannus P., Sievänen H., Palvanen M. et al. Prevention of falls and consequent injuries in elderly people // Lancet. 2005; 366 (9500): 1885–1893.
- Шупина М. И., Нечаева Г. И. Применение альфакальцидола в лечении остеопороза // Лечащий Врач. 2014. № 12. С. 37–40.
- Mithal A., Wahl D. A., Bonjour J. P. et al. Global vitamin D status and determinants of hypovitaminosis D // Osteoporos. Int. 2009; 20 (11): 1807–1820.
- Wahl D. A., Cooper C., Ebeling P. R. et al. A global representation of vitamin D status in healthy populations // Arch. Osteoporos. 2012; 7 (1–2): 155–172.
- Bruyere O., Malaise O., Neuprez A. et al. Prevalence of vitamin D inadequacy in European postmenopausal women // Curr. Med. Res. Opin. 2007; 23 (8): 1939–1944.
- Ferrari H. A., Willett W. C., Wong J. B. et al. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials // JAMA. 2005; 293 (18): 2257–2264.
- Compston J. E., Vedi S., Ledger J. E., Webb A., Gazet J. C., Pilkington T. R. Vitamin D status and bone histomorphometry in gross obesity // Amer J Clinical Nutr. 1981; 34: 2359–2363.
- Ivaska K. K., Gerdhem P., Vaananen H. K. et al. Bone Turnover markers and prediction of fracture: a prospective follow-up study of 1040 elderly women for a mean of 9 years // JBMR. 2010; 25: 393–403.
- Lips P., Hosking D., Lippuner K. et al. The prevalence of vitamin D inadequacy amongst women with osteoporosis: an international epidemiological investigation // J. Intern. Med. 2006; 260 (3): 245–254.
- Aaron J. E., Gallagher J. C., Anderson J. et al. Frequency of osteomalacia and osteoporosis in fractures of the proximal femur // Lancet. 1974; 1 (7851): 229–233.
- Shiraishi A., Higashi S., Ohkawa H., Kubodera N., Hirasawa T., Ezawa I., Ikeda K., Ogata E. The advantage of alfacalcidol over vitamin D in the treatment of osteoporosis // Calcif. Tissue Int. 1999; 65 (4): 311–316.
- Holick M. F., Siris E. S., Binkley N. et al. Prevalence of vitamin D inadequacy among postmenopausal North American women receiving osteoporosis therapy // J. Clin. Endocrinol. Metab. 2005; 90: 3215–3224.
- Richy F., Dukas L., Schacht E. Differential effects of D-Hormone analogs and native vitamin D on the risk of falls: a comparative meta–analysis // Calcific. Tissue International. 2008; epub ahead of print.
- Takeda S., Yoshizawa T., Nagai Y., Yamato H., Fukumoto S., Sekine K. et al. Stimulation of osteoclast formation by 1,25-dihydroxyvitamin D requires its binding to vitamin D receptor (VDR) in osteoblastic cells: studies using VDR knockout mice // Endocrinology. 1999; 140: 1005–1008.
- Richy F., Ethgen O., Bruyere O. et al. Efficacy of alphacalcidol and calcitrilol in primary and corticosteroid-induced osteoporosis: a meta–analisis of their effects on bone mineral density and fracture rate // Osteoporos. Int. 2004; 15 (4): 301–310.
- Chambers T. J., Owens J. M., Hattersley G., Jat P. S., Noble M. D. Generation of osteoclast-inductive and osteoclastogenic cell lines from the H-2 KbtsA58 transgenic mouse // Proc. Natl. Acad. Sci. USA 1993; 90: 5578–5582.
- O’Donnell S., Moher D., Thomas K., Hanley D. A., Cranney A. Systematic review of the benefits and harms of calcitriol and alfacalcidol for fractures and falls // J. Bone Miner. Metab. 2008; 26 (6): 531–542.
- Larsen E. R., Mosekilde L., Foldspang A. Vitamin D and calcium supplementation prevents osteoporotic fractures in elderly community dwelling residents: A pragmatic population-based 3-year intervention study // J. Bone Miner. Res. 2004; 19: 270–278.
- Ringe J. D., Schacht E. Potential of alfacalcidol for reducing increased risk of falls and fractures // Rheumatol. Int. 2009; 29 (10): 1177–1185.
- Bischoff-Ferrari H. A., Dawson-Hughes B., Willett W. C. et al. Effect of vitamin D on falls: A meta-analysis // JAMA. 2004; 291: 1999–2006.
- Watts N. B., Bilezikian J. P., Camacho P. M. et al. American Association of clinical endocrinologists medical guidelines for clinical practice for the diagnosis and treatment of postmenopausal osteoporosis // Endocr. Pract. 2010; 16 (Suppl. 3. P): 1–37.
- Kanis J. A., McCloskey E. V., Johansson H. et al. European guidance for the diagnosis and management of osteoporosis in postmenopausal women // Osteoporos. Int. 2013; 24 (1): 23–57.
- Jackson C., Gaugris S., Sen S. S., Hosking D. The effect of cholecalciferol (vitamin D3) on the risk of fall and fracture: a meta-analysis // Q. J. Med. 2007; 100: 185–192.
- Schacht E., Richy F., Reginster J. Y. The therapeutic effects of alfacalcidol on bone strength, muscle metabolism and prevention of falls and fractures // J. Musculoskelet. Neuronal. Interact. 2005; 5 (3): 273–284..
- Richy F., Dukas L., Schacht E. Differential effects of D-hormone analogs and native vitamin D on the risk of falls: a comparative meta-analysis // Calcif. Tissue Int. 2008; 82 (82): 102–107.
- Sørensen O. H., Lund B., Saltin B. et al. Myopathy in bone loss of ageing: improvement by treatment with 1 alpha-hydroxycholecalciferol and calcium // Clin. Sci. 1979; 56 (2): 157–161.
- Verhaar H. J., Samson M. M., Jansen P. A. et al. Muscle strength, functional mobility and vitamin D in older women // Aging (Milano). 2000; 12 (6): 455–460.
- Ito S., Harada A., Kasai T. et al. Use of alfacalcidol in osteoporotic patients with low muscle mass might increase muscle mass: an investigation using a patient database // Geriatr. Gerontol. Int. 2014; 14 (Suppl. 1): 122–128.
- Рожинская Л. Я., Белая Ж. Е. Витамин D в терапии остеопороза: его роль в комбинации с препаратами для лечения остеопороза, внескелетные эффекты// Эффективная фармакотерапия: Эндокринология. Спецвыпуск 2 (38). 2013.
М. И. Шупина1, кандидат медицинских наук
Г. И. Нечаева,
