Ревматоидный артрит и нейропатия

По данным Саковец Т.Г., Богданова Э.И. (ФГБОУ ВО Казанский государственный медицинский университет, Казань, Россия, 2017):
« … Ревматоидный артрит (РА) — это хроническое системное заболевание соединительной ткани с прогрес-сирующим поражением преимущественно периферичсских (синовиальных) суставов по типу эррозивно-деструктивного полиартрита. Это заболевание регистрируется в мире с частотой от 0,6% до 1,3%. Разнообразие форм и клинических вариантов течения РА, непрерывное прогрессирование патологического процесса, малая эффективность терапии и тяжелые необратимые последствия заболевания создают трудности в диагностике и лечении этого заболевания.
Симптомы поражения периферической нервной системы (ПНС) часто и отчетливо проявляются в клинической картине РА и представлены полинейропатиями, туннельными нейропатиями, множественными мононейропатиями, поражением спинного мозга в условиях вторичного стеноза позвоночного канала.
Компрессионные нейропатии (туннельные синдромы) характеризуется симптомами, возникающими в результате сдавления нервных стволов. Туннельные нейропатии преимущественно представлены поражением срединного, локтевого и мало-берцового нервов (синдром запястного, кубитального каналов, нетравматическое ущемление заднего межкостного нерва вследствие синовита локтевого сустава, синдром ущемления малоберцового нерва в области подколенной ямки). Компремирование нервов верхних конечностей синовиальными кистами после нейровизуализации (магнитно-резонансная томография) и электрофизиологического исследования в ряде случаев требует хирургической декомпрессии нервных стволов.
На фоне васкулита у больных с РА также часто развиваются множественные мононейропатии с асимметричным поражением ишемического характера различных периферических нервов, болевым синдром по ходу нервов.
читайте также статью: Нейропатии при васкулитах (на laesus-de-liro.livejournal.com) [читать]
Как правило, неврологические осложнения, связанные с поражением позвоночника, отмечаются преимущественно в поздних стадиях заболевания и включают в себя атлантоаксиальный подвывих, шейную миелопатию, синдром конского хвоста, стеноз позвоночного канала, переломы тел позвонков.
По различным литературным данным, встречаемость нейропатической боли у пациентов с РА составляет 10 — 43%. Пациенты с нейропатической болью старше, более длительно болеют РА, имеют более высокую клиническую, рентгенологическую стадии, функциональный класс, однако связи между выраженностью активности воспалительного процесса и алгическими феноменами не наблюдается.
Маркерами риска возникновения периферической нейропатии при РА могут являться антитела против клеток нейробластомы, а также повышение уровня антител к клеткам сосудистого эндотелия и молекул адгезии, наличие васкулита.
Клинически выраженный внесуставной ревматоидный васкулит развивается менее чем у 1% заболевших, к его развитию предрасполагают: мужской пол, высокие титры ревматоидного фактора, тяжелое течение болезни, у больных часто наблюдается ассоциированное интерстициальное поражение легких и периферических нервных волокон. Некротизирующий васкулит способствует возникновению множественных мононейропатий, дистальной симметричной сенсорной, сенсо-моторной нейропатий. Васкулитное поражение кожи, нейропатические нарушения в более чем трех конечностях являются предикторами высокой смертности у больных с ревматоидной нейропатией.
Таким образом, необходимо тщательное клиническое обследование больного, сбор анамнеза, проведение электро-физиологических исследований для выявления ревматоидных нейропатий и подбора адекватной тактики их лечения.»
источник: Российский журнал боли, №1, 2017, стр. 48 — 49
из автореферата диссертации на соискание ученой степени кандидата медицинских наук «Клинический анализ и патогенетические аспекты неврологических расстройств при ревматоидном артрите» Скугарь Юлия Михайловна (14. 00. 13 — нервные болезни), Саратов, 2006:
Выводы
1. Неврологические нарушения при ревматоидном артрите характеризуются поражением как центральной, так и периферической нервной системы, они встречаются соответственно в 9,8 % и 15,7% случаев. У большинства больных имеет место сочетание патологии центральной и периферической нервной системы (72,6%).
2. Патология центральной нервной системы при ревматоидном артрите проявляется в виде синдромов: начальных проявлений недостаточности функций мозга (10,7%), рассеянной церебральной микросимптоматики (33,3%) и очагового поражения головного мозга (39,2%).
3. Клинически патология периферической нервной системы при ревматоидном артрите проявляется в виде сенсорной (37,3%), моторной (16,6%) и смешанной (34,3%) форм полинейропатии, которая, по данным электронейромиографии, носила демиелинизирующий характер, причем наиболее часто встречается сенсорная полинейропатия.
4. В развитии поражения нервной системы первостепенное значение принадлежит первичному поражению сосудов как церебральных, так и периферических, питающих нервы (по типу васкулита), о чем свидетельствует повышенный уровень антител к миелопероксидазе, что приводит к вторичному повреждению собственно нервной ткани.
5. Наряду с сосудистым фактором, приводящим к развитию церебральной патологии и полинейропатии, значение в патогенезе имеет и аутоиммунный процесс, который увеличивается с давностью заболевания. Это подтверждается повышенными показателями антител к нативной и денатурированной ДНК.
6. Длительное время существующий аутоиммунный процесс и развитие васкулита мелких сосудов сопровождаются вторичной демиелинизацией, что значительно усугубляет неврологический дефицит и подтверждается повышением содержания антител к основному белку миелина.
7. С учетом клинических проявлений сосудистого поражения центральной нервной системы можно выделить формы церебрального васкулита при ревматоидном артрите: с начальными проявлениями недостаточности кровоснабжения головного мозга, с рассеянной церебральной микросимптоматикой и очаговым поражением головного мозга.
Практические рекомендации
1. В комплексное обследование больных ревматоидным артритом необходимо включать осмотр врача-невролога с целью выявления патологии нервной системы.
2. Повышенные показатели антител к нативной и денатурированной ДНК, основному белку миелина (ОБМ), в сыворотке крови больных могут служить дополнительным критерием в диагностике поражения нервной системы при ревматоидном артрите.
3. Определение антител к миелопероксидазе в сыворотке крови можно использовать для диагностики системного васкулита при ревматоидном артрите.
4. Наличие повышенных органоспецифических и органонеспецифических показателей при ревматоидном артрите дает основание для назначения препаратов, воздействующих на аутоиммунный процесс.
5. С целью улучшения кровоснабжения периферических нервов при ревматоидном артрите рекомендуется использование препаратов, улучшающих микроциркуляцию и снижающих иммунное воспаление [источник].
читайте также:
статью «Поражение нервной системы при ревматоидном артрите: клиннико-иммунологические ассоциации» Маслакова Л.А., Баранов Е.В., Емельянова О.И., Парамонова О.В., Гонтарь И.П. [читать];
статью «Иммунологический подход к диагностике поражения нервной системы у больных ревматоидным артритом» Е.В. Баранов, О.В. Парамонова, И.П. Гонтарь, Л.А. Маслакова, И.А. Зборовская; ФГБУ РАМН «Научно-исследовательский институт клинической и экспериментальной ревматологии», г. Волгоград; ГБОУ ВПО «Волгоградский государственный медицинский университет» (журнал «Медицинский альманах» №1, 2013) [читать];
статью «Характер поражения периферической нервной системы при ревматоидном артрите» Егудина Е.Д., к.м.н., доцент Днепропетровской медицинской академии МОЗ Украины, г. Днипро, Украина (журнал «Знание» № 2 — 1, 2017) [читать];
статья «Внесуставные проявления ревматоидного артрита» Муравьев Ю.В., ФГБУ «Научноисследовательский институт ревма-тологии им. В.А. Насоновой», Москва (журнал «Научно-практическая ревматология» №3, 2018) [читать];
статью «Полиневропатия при ревматоидном артрите: значение в патогенезе болевого синдрома» Филатова Е.С. (ФГБНУ «НИИР им. В.А. Насоновой» РАН, Москва), Эрдес Ш.Ф. ( ФГБНУ «НИИР им. В.А. Насоновой» РАН, Москва); РМЖ. 2017. №7. С. 470 — 473 [читать]
Источник
Ревматоидный артрит (РА) – хроническое системное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу эрозивно-деструктивного полиартрита, с возможным развитием полиорганного поражения и тяжелых осложнений, таких как вторичный амилоидоз. РА представляет собой наиболее распространенное аутоиммунное заболевание, регистрируется во всех странах мира и во всех климатогеографических зонах, во всех возрастных, расовых и этнических группах, поражая 0,5–2% взрослого населения в наиболее работоспособном возрасте – 35–55 лет [1–3]; женщины болеют чаще чем мужчины (соотношение женщин и мужчин 3:1). По данным 2012 г., заболеваемость РА в РФ составляет 241,3 на 100 тыс. населения [4].
Основными клиническими проявлениями РА являются суставные поражения в виде эрозивного артрита с болью и припухлостью пораженных суставов, утренняя скованность, образование ревматических узелков. В развернутых стадиях заболевания возникают деформации пораженных суставов, повреждения связочного аппарата и синовиальной сумки. Помимо поражения суставов для пациентов с РА характерно развитие системных внесуставных проявлений, таких как ревматоидный васкулит, плеврит, перикардит, синдром Фелти, периферическая полиневропатия, поражение глаз, гломерулонефрит [5].
Наиболее характерным проявлением заболевания, наряду с прогрессирующим поражением суставов, потерей подвижности, утомляемостью, внесуставными проявлениями, является хронический болевой синдром, локализованный обычно в области суставов. Именно хронический болевой синдром служит ведущей жалобой пациентов и оказывает решающее влияние на снижение качества жизни. Боль рассматривают как показатель активности болезни, и в то же время активность заболевания не всегда является предиктором интенсивности боли и нарушения функции суставов.
Неврологические нарушения при РА
В настоящее время существует ряд клинико-экспериментальных исследований, демонстрирующих роль неврогенных механизмов в патогенезе болевого синдрома при РА [6–8]. Наряду с клиническими признаками воспаления у пациентов с РА наблюдаются специфические сенсорные феномены, характерные для невропатической боли [9–11].
Среди неврологических нарушений при РА наиболее часто выявляется поражение периферической нервной системы (ПНС) [12]. Американскими ревматологами было проведено клиническое, электрофизиологическое и патоморфологическое исследование ПНС у 108 больных РА. У 62 обследованных (57,4%) выявлены электрофизиологические доказательства наличия невропатии. Среди них 53 (85,5%) имели чисто сенсорную или сенсомоторную аксональную невропатию, а 9 (14,5%) – демиелинизирующую полиневропатию. Синдром запястного канала выявлен у 11 из 108 больных. Поражения ПНС имели разнообразную клиническую картину: боль, парестезии, моторные и сенсорные нарушения. Авторы обращали внимание на то, что эти симптомы могут имитировать суставную боль или сопровождать ее. Однако не было получено данных о взаимосвязи неврологических проявлений с длительностью заболевания, наличием эрозий, деформаций суставов и приемом противовоспалительных препаратов [13].
В целом, по данным литературы, частота неврологических осложнений у больных РА имеет большой разброс (от 0,5 до 85%) и представлена преимущественно полиневропатией (сенсорной, моторной или сенсомоторной), а также множественными мононевропатиями, шейной миелопатией или туннельным синдромом [14–18].
Полиневропатия, при которой поражаются как двигательные (моторные), так и чувствительные (сенсорные) волокна, выявляется более чем в 50% случаев. На сегодняшний день трудными для диагностики остаются моторные нарушения, поскольку имеющиеся деформации суставов с ограничением активных и пассивных движений, сопутствующей мышечной атрофией зачастую препятствуют определению причины пареза: патология суставов или патология периферических нервов. Полиневропатия характерна больше при длительном течении болезни [11, 13, 18].
Основной причиной поражения ПНС являются васкулит и ишемия сосудов, питающих периферические нервы. Диагностика поражения ПНС основывается на чувствительных нарушениях в дистальных отделах конечностей, снижении поверхностной и глубокой чувствительности, данных стимуляционной электронейромиографии (ЭНМГ) (снижение скорости распространения возбуждения по моторным и сенсорным волокнам и М-ответа в дистальных отделах конечностей).
В 2012 г. нами проведено исследование с целью выявить нейропатический компонент боли (НКБ) у больных с РА. Обследовано 183 пациента с достоверным РА, (средний возраст 46,5±11,7 года) с длительностью заболевания от 3-х месяцев до 30 лет (в среднем 9,1±7,6 года) [19]. По данным опросника DN4 для диагностики вида боли, 73 пациента (43%) набрали 4 и более баллов, что свидетельствует о нейропатическом характере боли (рис. 1).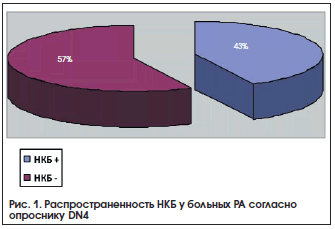
Статистический анализ 2-х групп пациентов – с НКБ (НКБ+) и без НКБ (НКБ–) – показал, что с увеличением возраста больного, длительности заболевания, клинической стадии и снижением функциональных возможностей возрастает вероятность наличия НКБ у больного. Причем индекс DAS28, позволяющий определить активность болезни и эффективность терапии при РА, и СОЭ не являются предикторами боли.
Анализ болевого синдрома с помощью наиболее популярного в России опросника DN4 [20] выявил различные качественные характеристики хронического болевого синдрома у пациентов с РА. Наиболее частыми дескрипторами невропатической боли были прострелы, похожие на удар током (51%), ползание мурашек (40%), покалывание (54%) и онемение (57%).
Исследование неврологического статуса выявило у пациентов с НКБ в 96% случаев поражение ПНС, которое было представлено дистальной сенсомоторной полиневропатией (55%), туннельным синдромом (14%), мононевропатией (19%), шейной миелопатией (4%), сочетанием полиневропатии с туннельным синдромом (4%). Лишь у 4% поражение ПНС отсутствовало [21]. Полиневропатия чаще выявлялась у пациентов более старшего возраста, длительно болеющих РА, что подтвердило данные зарубежных коллег (рис. 2).
Для подтверждения полиневропатии пациентам проведена стимуляционная ЭНМГ, которая выявила преимущественное снижение скорости распространения возбуждения и амплитуды М-ответа в дистальных отделах конечностей, что позволило говорить о наличии у них смешанного типа поражения ПНС – аксонального и демиелинизирующего.
Основные принципы терапии невропатической боли при РА
Проведенное нами исследование показало, что хронический суставной болевой синдром при РА носит смешанный характер. Наряду с ноцицептивным компонентом, обусловленным воспалением, у 43% пациентов преобладает НКБ, что требует комплексной терапии. Наряду с НПВП, базисной противовоспалительной, глюкокортикостероидной и генно-инженерной биологической терапией, направленной на основное заболевание и ноцицептивный компонент, необходимо рассмотреть терапию нейропатического компонента. Согласно международным рекомендациям, наряду с вышеуказанными препаратами, для лечения НКБ необходимо использовать препараты центрального действия (анктиконвульсанты и антидепрессанты) и витамины группы В.
В течение многих лет ученые занимаются клиническими исследованиями применения при различных неврологических заболеваниях витаминов группы В, прежде всего витаминов В1 (тиамин), В6 (пиридоксин) и В12 (цианокобаламин), обладающих определенным механизмом действия.
• Тиамин (В1) оказывает репаративное действие на пораженные нейроны, а также замедляет прогрессирование поражения сосудистого русла.
• Пиридоксин (В6) оказывает нейротропное действие (активируя синтез миелиновой оболочки нервного волокна и транспортных белков в аксонах, ускоряет процесс регенерации периферических нервов) и противоболевое действие.
• Цианокобаламин (В12) активно влияет на энергообеспечение клеток, синтез белка, регенерацию нервной ткани [22–24].
На сегодняшний день уже не ставится под сомнение анальгетический эффект этих витаминов [22, 25, 26] и целесообразность их использования в лечении болевых синдромов с сенсорными нарушениями, а также в комплексной терапии невропатической боли с применением Габапентина [27, 28]. В 2016 г. A. Mimenza и S. Aguilar провели исследование с применением антиконвульсантов и витаминов В1 и В12 у больных с диабетической полиневропатией. В течение 12 нед. пациентам с болевой формой диабетической полиневропатии проводили терапию по 2-м схемам: 1) Габапентин 300–3600 мг + В12 (20 мг) и В1 (100 мг); 2) Прегабалин 75–600 мг. Достоверное снижение выраженности болевого синдрома получено в обеих группах, однако комбинация Габапентина с витаминами В1 и В12 позволила использовать меньшие дозы антиконвульсанта, что является немаловажным аспектом.
Спектр заболеваний нервной системы, при которых патогенетически обосновано применение витаминов группы В, разнообразен. Полиневропатия как основной этиологический фактор периферической нейропатической боли у больных с РА – один из основных показаний к применению витаминов группы В.
Оригинальным препаратом, содержащим комплекс витаминов В1, В6, В12, является Нейробион (МЕРК), он оказывает тройное действие на нейроны: нормализует обмен углеводов (за счет витамина В1); увеличивает синтез нейромедиаторов (за счет витамина В6); стимулирует синтез защитной миелиновой оболочки (за счет витамина В12). Препарат выпускается в 2-х формах: инъекционной и таблетированной, при этом отсутствие в препарате лидокаина снижает риск развития аллергии.
Показания к применению препарата Нейробион (МЕРК):
• нейропатическая боль при полинейропатии;
• болевой синдром при заболеваниях позвоночника (люмбоишиалгия, плексопатия, корешковый синдром, вызванный дегенеративными изменениями позвоночника);
• невриты и невралгии (невралгия тройничного нерва, неврит лицевого нерва, межреберная невралгия).
Схемы применения препарата Нейробион (МЕРК) различаются в зависимости от интенсивности болевого синдрома. При выраженном болевом синдроме лечение целесообразно начинать с внутримышечного введения 3 мл/сут (1 ампула) до снятия острых симптомов. После уменьшения выраженности симптомов или при умеренной их тяжести назначают по 3 мл (1 ампула) 3 р./нед. в течение 2–3-х недель. В целях профилактики рецидива рекомендуется поддерживающая схема: внутрь по 1 таблетке 1–3 р./сут в течение 1–1,5 мес. или по назначению врача.
Следует обратить внимание, что при длительном курсе терапии (18 нед.) диабетической полиневропатии витаминами группы В не наблюдалось побочных эффектов, которые могли бы свидетельствовать о передозировке препарата [29].
Синергическое взаимодействие препаратов с различными механизмами действия обусловливает больший болеутоляющий эффект при меньших неблагоприятных явлениях.
Источник
