Ревматоидный артрит лечение 2016 год
Лекарства последнего поколения, разработанные по современным технологиям фармацевтики, облегчают страдания человека, снижают риск дальнейших осложнений. Что же такое ревматоидный артрит, каковы причины, симптомы, какие методы лечения возможны?
Что собой представляет болезнь?
Важно знать! Врачи в шоке: «Эффективное и доступное средство от боли в суставах существует…» Читать далее…
Это системная неврологическая патология, связанная с воспалением хрящевой ткани в суставном сочленении. Причинно-следственные связи клинического состояния различны. Однако все они обусловлены проблемами в работе защитной иммунной организации человека. Наиболее вероятный провоцирующий фактор – инфекционное поражение.

Реакция на воспалительный процесс инфицирования – это медленное разрушение соединительных тканей, связанное с их дегенеративно-дистрофической реорганизацией.
Если вовремя не провести адекватное лечение, то следующим этапом дегенерации станет деформация суставной поверхности. Это влечет значительное ограничение подвижности костно-суставных сегментов ОДА нижней конечности.
Возможные причины возникновения неврологической патологии:
- генетическая зависимость;
- воздействие хронических заболеваний на суставные сегменты;
- действие пусковых факторов: переохлаждение, интоксикация, реакция костно-суставной системы на мутагенные лекарственные средства.
При ревматоидном артрите симптомы заболевания без медикаментозной терапии могут сохраняться длительное время и выражаться в следующих проявлениях:
- боли в суставах различной степени интенсивности, даже при незначительных нагрузках;
- присутствие отечности, покраснения в месте поражения;
- нарушение температурного режима, как результат воспалительной реакции в соединительной ткани.
Такие симптоматические признаки возможны при любых воспалительных реакциях. Поэтому перед тем как проводить лечение ревматоидного артрита, необходимо идентифицировать диагностические признаки заболевания.

Запущенное состояние колена.
Человеку необходимо обратиться к врачу, который на основе собранного анамнеза, диагностического лабораторного исследования (УЗИ, рентген, МРТ, КТ), других уточняющих процедур диагностики определит степень выраженности неврологической патологии. Он установит причинно-следственную связь воспалительной реакции, назначит медикаментозное лечение.
При лечении обязательна двигательная активность суставных сегментов. С этой целью консультирующий специалист назначает физиотерапевтические процедуры, лечебный массаж, гимнастические упражнения, мануальные методы воздействия на суставную патологию.
Подробное видео о природе заболевания:
Системная медикаментозная терапия
Лечебная терапевтическая реакция предусматривает применение пяти групп фармакологических лекарственных средств.
| № п/п | Фармакологические комбинации | Назначение лекарственных средств |
| 1 | Нестероидные противовоспалительные (НПВП) | Устранение симптомов |
| 2 | Базисные противоревматические группы | Уменьшение воспалительной активности, смягчение костно-суставной деструкции |
| 3 | Глюкокортикостероиды | Нормализация обменных функций, восстановление активного кровообращения |
| 4 | Биологические средства лечения | Устранение ферментативного разрушения близлежащих тканевых соединений суставной поверхности |
| 5 | Миорелаксанты | Для расслабления скелетной мускулатуры при значительном снижении двигательной активности |
Нестероидные противовоспалительные
При обезболивании и устранении воспалительной реакции врачи назначают наиболее известные препараты нестероидной противовоспалительной активности – Диклофенак®, Ибупрофен® или Парацетамол®.

Однако существуют более действенные средства лечения из нестероидной противовоспалительной группы с наименьшим эффектом побочного воздействия, связанным с органами мочеполовой, желудочно-кишечной систем.
Среди нестероидных противовоспалительных комбинаций выделяется Дексалгин® 25 немецкого производителя – компании BERLIN-CHEMIE/MENARINI PHARMA GmbH. Выпускается в виде таблеток с активным действующим веществом декскетопрофеном, отпускаемый в аптечной сети только по рецептурному назначению врача. Благодаря активному компоненту и вспомогательным веществам (кукурузный крахмал, микрокристаллическая целлюлоза и т. д.) нестероидная лекарственная форма оказывает анальгезирующее, противовоспалительное и жаропонижающее действие.
После приема фармацевтического средства основные симптомы ревматоидного артрита — боль, отечность, покраснение – исчезают через 30-40 минут. Однако длительность обезболивания составляет 4-5 часов – и наступает новый виток болевых приступов. Дозировка и курс лечения определяется лечащим специалистом с учетом возрастных, половых, индивидуальных особенностей пациента.
Препарат не назначается беременным женщинам, детям до 12 лет, больным людям с хроническими дыхательными патологиями, почечной и печеночной недостаточностью. Лекарство не предназначено для длительного применения. Курс лечения не должен превышать 5-7 дней.
«Врачи скрывают правду!»
Даже «запущенные» проблемы с суставами можно вылечить дома! Просто не забывайте раз в день мазать этим…
>
Следующий нестероидный противовоспалительный препарат нового (последнего) поколения – это Вольтарен® акти российского производителя АО «ГлаксоСмитКляйн Хелскер». Лекарство выпускается в виде таблеток белого цвета. Основное действующее вещество – диклофенак натрия.
Вольтарен® акти обладает всеми свойствами фармакологических средств нестероидной противовоспалительной активности – жаропонижающим, болеутоляющим. Лечебный эффект наступает после 15-20 минут, что делает эффективным применение препарата для скорейшего купирования болевого приступа и урегулирования температурного режима. Курс лечения лекарственным средством не должен превышать 5 дней. Противопоказания: язвенная болезнь желудка, дети до 14 лет, почечная, печеночная или сердечная недостаточность. Принимать его не рекомендуют людям с хронической патологией органов дыхания.
Среди новинок фармацевтической промышленности для наружного применения – противовоспалительный анальгезирующий крем Аэртал® испанской фирмы «ALMIRALL S.A.».
Благодаря активному действующему веществу – ацеклофенаку — применение лекарственной формы целесообразно при воспалении в суставе, других костно-мышечных, суставных сегментах опорно-двигательного аппарата.
Исключения – заболевания кожного покрова в месте предполагаемого проведения терапевтических действий, индивидуальная непереносимость фармакологического продукта.
Базисные противоревматические препараты
Среди интересных модифицирующих антиревматических продуктов фармацевтического рынка:
- Азатиоприн® – рецептурный препарат российского производителя ОАО «МОСХИМФАРМПРЕПАРАТЫ им. Н.А.Семашко», выпускаемый в таблетированной форме. Иммунодепрессант блокирует клеточное деление, пролиферацию (разрастание) поврежденных тканей в полости сустава. Лекарственная форма практически не имеет побочных действий и противопоказаний. Единственное ограничение – это индивидуальная непереносимость пациентом действующего вещества и беременность;
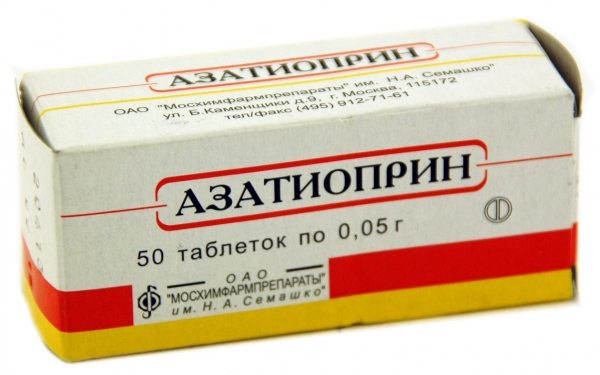
- Сульфасалазин® – лекарственный препарат компании «KRKA d. d.» (Словения), обладает свойствами базисной противоревматической терапии. Это основное средство лечения ревматоидного, ювенильного артритов. Среди ограничений – функциональное нарушение печени и/или почек, болезни крови, повышенная чувствительность к сульфаниламиду и производным салициловой кислоты, детский возраст до 7 лет;
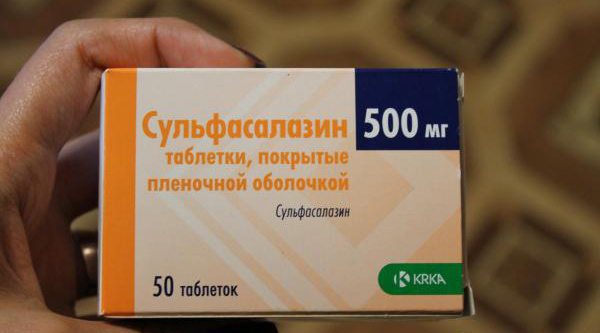
- Доксициклин® – полусинтетический антибиотик от ЗАО «БИНЕРГИЯ» (Россия), обладающий антибактериальным действием. Проникая в организм при помощи внутримышечного введения, лекарство действует разрушающе на синтез протеинов в микробной клетке. Противопоказания: аллергическая реакция на тетрациклиновую группу, дети до 10 лет, беременные, кормящие женщины.
Как и чем лечить болезнь, решает лечащий врач. Данная группа лекарственных препаратов обладает очень медленным терапевтическим эффектом. Рекомендуется применять базисные средства лечения совместно с прочими фармакологическими группами – нестероидными противовоспалительными препаратами, глюкокортикостероидами.
Глюкокортикостероиды
Этот вид фармакологических препаратов представляет собой стероидный гормон, синтезируемый корой надпочечников, обладающий разносторонним физиологическим действием:
- противовоспалительным;
- антиаллергическим;
- иммунорегулирующим;
- антишоковым;
- противострессовым.
Среди назначаемых фармакологических средств последнего поколения наиболее эффективны:
Являясь мощнейшим контринсулярным гормоном, глюкокортикостероиды практически не назначаются пациентам с сахарным диабетом.
Биологические средства лечения
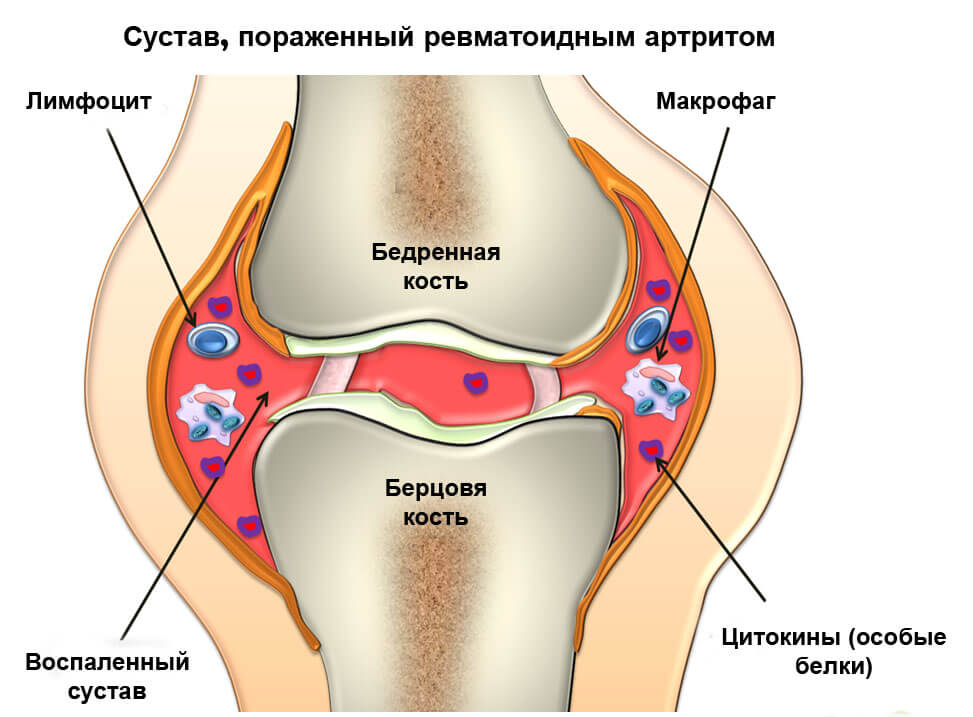
При ревматоидном артрите происходит ферментация синовиальной оболочки в суставной полости, которая приводит к разрушению дисульфидных связок в близлежащих костно-суставных тканях и хрящах. Это влечет каскадную реакцию, усугубляет клиническую симптоматику неврологического заболевания. Организм отвечает воспалительной реакцией, сопровождающейся выработкой цитокинов, наиболее опасен ФНО – фактор некроза опухоли. Такое состояние может обеспечить пациенту значительное снижение подвижной активности суставов и физическую нетрудоспособность.
Поэтому в комплексное лечение вводятся специальные блокаторы (ингибиторы ФНО) или антицитоновые препараты:
- Ремикейд® российского производителя ООО «МСД ФАРМАСЬЮТИКАЛС» – противоопухолевый ингибитор ФНО, обеспечивающий широкий спектр биологической активности против воспалительной реакции, участвующий в модуляции иммунной системы. Терапия инфликсимабом – основным действующим компонентом лекарственного средства – обеспечивает снижение клеточной инфильтрации в воспаленных участках сустава. Он назначается при активной форме ревматоидного артрита. Частота и длительность лечения устанавливаются по индивидуальной схеме терапевтического лечения. Противопоказания: индивидуальная непереносимость, беременность и кормление грудью у женщин, дети до 18 лет, тяжелые инфекционные поражения;
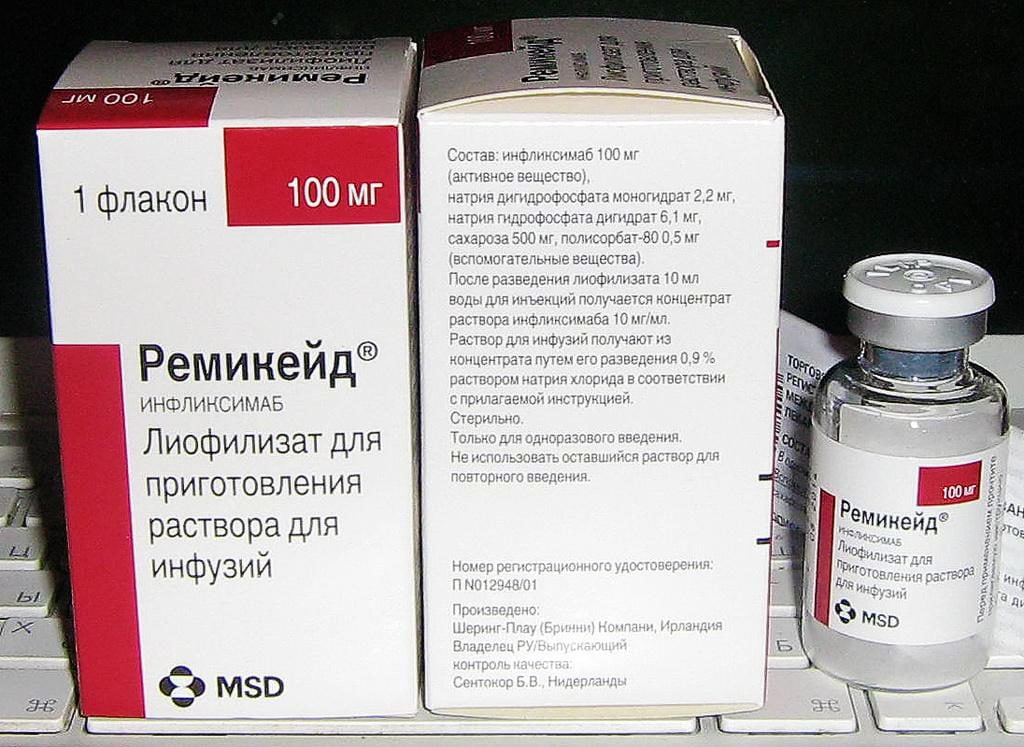
- Энбрел® – раствор для инъекций компании «WYETH WHITEHALL EXPORT GmbH» (Австрия). Лекарственное средство назначается при умеренной или тяжелой форме ревматоидного артрита, идиопатическом полиартрите у детей, прогрессирующем псориатическом артрите у взрослых, прочих повреждениях суставной массы неврологического характера. Противопоказания: тяжелые инфекции активной формы, беременность и грудное вскармливание, повышенная чувствительность к действующему компоненту – этанерцепту;

- Симзия® – рецептурная лекарственная форма бельгийского производителя компании «UCB Pharma S.A.». Основной действующий компонент раствора для подкожного введения – цертолизумаб пэгол (Certolizumab pegol). Средство является основным ингибитором фактора некроза опухоли (ФНО), широко применяется при ревматоидном артрите суставов нижних или верхних конечностей, псориатическом артрите, аксинальном спондилоартрите. Противопоказания: пожилые пациенты от 65 лет и старше, беременные женщины, дети до 16 лет.
Миорелаксанты
Медицинский термин происходит от латинского myorelaxantia, где myo – это мускул, relaxantis – расслабляющий. Цель их назначения – это снижение мышечного тонуса в зоне неврологического повреждения. Классифицируется лекарственная форма следующим образом (смотреть таблицу).
| Деполяризующие миорелаксанты | Не деполяризующие миорелаксанты | ||
| Ультракороткого действия | Короткого действия | Среднего действия | Длительного действия |
| Дитилин® – деполяризующий миорелаксант короткого действия | Мивакрон® – для кратковременного угнетения нервно-мышечной передачи | Тракриум® – лекарственная форма периферического действия конкурентного типа. Основной компонент – атрикурия безилат снижает чувствительность холинорецепторов, обеспечивая невозможность возбуждения и сокращения мышечного волокна | Павулон® – недеполяризующий миорелаксант продолжительной активности, обеспечивающий релаксацию скелетной мускулатуры |
Доклад на тему медикаментозного лечения:
Прогноз
Обязательным условием для скорейшего выздоровления является не только применение медикаментозных фармацевтических комбинаций. В комплексную терапию необходимо включать физиотерапевтические процедуры, специальные упражнения, лечебный массаж, санаторно-курортное оздоровление.
В случае неэффективности перечисленных методов терапии или при прогрессировании болевой симптоматики в костно-суставном сегменте предусмотрено хирургическое вмешательство:
- артродез;
- синовэктомия;
- эндопротезирование.
Медицинские эксперты отмечают, что продолжительность жизни пациентов с ревматоидной патологией сокращает жизнь человека в среднем на 5-10 лет.
По лабораторным исследованиям американской Клиники Мэйо (США, Миннесота), проведенным в 2005 году, риск сердечно-сосудистых патологий в 2 раза выше у пациентов, страдающих ревматическими и артрологическими заболеваниями. Эта неутешительная статистика в наибольшей степени объясняется хронической стадией ревматоидного артрита опорно-двигательной системы.
Уменьшить риск хронических патологий и увеличить продолжительность жизни поможет назначение биофармацевтических средств лечения. Они активно воздействуют на жизненно важные биологические объекты – кровь, клеточную структуру и соединительные ткани.
Берегите себя и будьте здоровы!
Похожие статьи
Как забыть о болях в суставах?
- Боли в суставах ограничивают Ваши движения и полноценную жизнь…
- Вас беспокоит дискомфорт, хруст и систематические боли…
- Возможно, Вы перепробовали кучу лекарств, кремов и мазей…
- Но судя по тому, что Вы читаете эти строки — не сильно они Вам помогли…
Но ортопед Валентин Дикуль утверждает, что действительно эффективное средство от боли в суставах существует! Читать далее >>>
загрузка…
Источник

Введение
Ревматоидный артрит (РА) — хроническое аутоиммунное заболевание, характеризующееся преимущественным поражением синовиальных суставов и постепенной деструкцией структур сустава. В национальных рекомендациях с 2014 г., а в европейских — с 2016 г. постулируется, что ведение больных РА должно осуществляться ревматологами [1–3]. Однако надо учитывать, что максимальный эффект противовоспалительной терапии при РА развивается на ранних стадиях заболевания. Поэтому вопрос о раннем выявлении больных с РА или с подозрением на развитие РА во многом зависит от знания врачами первичного звена симптомов, характерных для ранней стадии заболевания.
Роль терапевта в ранней диагностике и проведении адекватного лечения ревматоидного артрита
Возможности ранней диагностики ревматоидного артрита
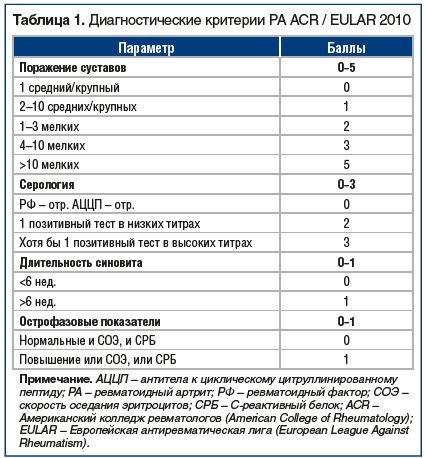
Первый шаг к возможности установить диагноз РА как можно раньше был сделан в 2010 г., когда были опубликованы новые классификационные критерии РА [4]. Они были ориентированы на выявление РА на ранних стадиях (табл. 1). Однако диагноз РА в соответствии с этими критериями устанавливается при наличии полиартрита в сочетании с результатами лабораторных исследований. Еще в 2002 г. были предложены упрощенные критерии раннего РА, которые вошли в национальные рекомендации по ведению больных РА [2, 5]: при наличии у больного как минимум 3 воспаленных суставов определенной локализации (мелкие суставы кистей и стоп), утренней скованности и положительного теста «поперечного сжатия» (рис. 1) больного следует сразу направлять к ревматологу. В статье, описывающей данные критерии раннего РА [5], имеется несколько рекомендаций, которые могут помочь практикующим врачам. Во-первых, применение нестероидных противовоспалительных препаратов (НПВП) способно маскировать симптомы на ранней стадии заболевания, таким образом, врач может не выявить при осмотре припухлости, поэтому в сомнительных случаях возможна отмена НПВП и повторный осмотр через 2–3 дня. Конечно, больного следует предупредить, что боли могут нарастать, но задержка с установкой диагноза нанесет больному больше вреда, поскольку ведет за собой задержку с назначением необходимого лечения. Кроме того, в статье [4] четко указывается, что назначение глюкокортикоидов (ГК) до установления нозологического диагноза недопустимо.
![Рис. 1. Алгоритм ранней диагностики ревматоидного артрита на этапах оказания медицинской помощи [2, 4, 5] Рис. 1. Алгоритм ранней диагностики ревматоидного артрита на этапах оказания медицинской помощи [2, 4, 5]](https://www.rmj.ru/upload/medialibrary/d94/51-3.png)
Наиболее частые варианты дебюта РА — развитие симметричного полиартрита мелких суставов кистей и/или стоп, что сопровождается наличием утренней скованности в суставах, ухудшением общего самочувствия, иногда появлением субфебрилитета. Но РА может дебютировать с развития артрита плечевого или коленного сустава. В национальных рекомендациях по ревматологии [2] четко указано, что каждому больному с ранним артритом (любой локализации) нужно назначить лабораторное обследование, которое включает клинический анализ крови, определение уровня С-реактивного белка, ревматоидного фактора (РФ), антител к циклическому цитруллинированному пептиду (АЦЦП) или к цитруллинированному виментину (анти-MCV) и антинуклеарного фактора, и провести рентгенографию суставов кистей и стоп (в прямой проекции).
Следует ясно представлять, что РА, как и другие хронические заболевания, проходит несколько стадий эволюции — доклиническую и клиническую (рис. 2). РА может дебютировать с развития артритов или с появления только болей в суставах (артралгий). Поэтому врач первичного звена и при отсутствии артритов должен уметь заподозрить дебют РА и без промедления направить больного к ревматологу. В 2017 г. было опубликовано определение артралгий, подозрительных на развитие РА, сформулированное экспертами Европейской антиревматической лиги (EULAR) [6]:
![Рис. 2. Классификация и длительность ревматоидного артрита [4] Рис. 2. Классификация и длительность ревматоидного артрита [4]](https://www.rmj.ru/upload/medialibrary/fa8/51-4.png)
5 параметров врач выясняет при сборе анамнеза:
недавнее начало симптомов (<1 года);
локализация симптомов в мелких суставах;
длительность утренней скованности ≥60 мин;
наибольшая выраженность симптомов в утренние часы;
наличие 1 (рентгенологической) стадии относительно РА.
2 параметра выявляются при осмотре больного (это занимает менее 1 мин):
больной испытывает затруднения при сжатии кулака;
положительный тест «поперечного сжатия» суставов кисти (стоп).
Чувствительность и специфичность этих критериев приведены в таблице 2. Как следует из ее данных, выявление у пациента 4 параметров говорит о том, что у больного дебют РА (в 93,6% случаев), а 5 и более параметров — о необходимости срочного направления больного к ревматологу для верификации диагноза РА. Необходимый объем лабораторного дообследования указан выше.
![Таблица 2. Чувствительность и специфичность оценивае- мых параметров при наличии артралгий как риска РА при экспертизе клинически подозрительных артралгий [6] Таблица 2. Чувствительность и специфичность оценивае- мых параметров при наличии артралгий как риска РА при экспертизе клинически подозрительных артралгий [6]](https://www.rmj.ru/upload/medialibrary/cd5/51-2.png)
Принципы лечения ревматоидного артрита
Основные принципы лечения РА хорошо известны клиницистам. В соответствии с разработанной в настоящее время стратегией лечения РА [7] основной целью является достижение ремиссии (или низкой активности заболевания) у всех больных. Для достижения этой цели необходимо раннее назначение базисных противовоспалительных препаратов (БПВП). При раннем начале лечения (первые 3–6 мес.) у большинства пациентов возможно добиться ремиссии или течения РА с низкой активностью, что и является критерием эффективного лечения РА. Задержка с назначением БПВП приводит к уменьшению эффекта лечения. Был проведен анализ данных 14 рандомизированных контролируемых исследований, в которых оценивалась частота развития эффекта у 1435 больных (886 получали различные БПВП и 549 — плацебо) при различной длительности РА. Учитывались демографические факторы (пол, возраст), функциональные возможности больных, клинико-лабораторные параметры активности болезни (боль, число болезненных и припухших суставов, СОЭ и др.) [8]. При любой длительности РА различие в частоте развития эффекта между активным лечением и плацебо было примерно одинаково — около 30%. Но по мере увеличения длительности РА эффективность БПВП снижалась с 52% (начало терапии при длительности РА <1 года) до 35% (при длительности РА >10 лет).
Первым БПВП, который назначается больным РА, является метотрексат (МТ), который также называют якорным препаратом. Он эффективен у большинства больных РА и обладает хорошей переносимостью доз, используемых в ревматологии [9, 10]. МТ имеет ограниченные противопоказания (острая инфекция, алкоголизм, беременность). Успех лечения зависит от ряда моментов: использование оптимальных терапевтических доз — 15–25 мг/нед.; контроль за эффективностью терапии с коррекцией дозы и формы МТ при недостаточном эффекте; клинический и лабораторный контроль переносимости МТ. Следует подчеркнуть, что с учетом антифолатного действия МТ показано его применение в комбинации с фолиевой кислотой в дозе 1–2 мг в те дни, когда МТ не принимается, что позволяет уменьшить частоту нежелательных реакций (НР) [11]. Перед назначением МТ следует оценить факторы риска НР: прием алкоголя, ожирение, нарушение функции печени, почек; исследовать лабораторные параметры (АСТ, АЛТ, альбумин, общий анализ крови, креатинин, глюкоза, липидный профиль), выполнить тест на беременность, оценить маркеры вирусных инфекций (ВИЧ, гепатит В/С), провести рентгенографию органов грудной клетки.
При отсутствии противопоказаний к назначению МТ после установки диагноза назначается 15 мг/нед. МТ + 5 мг/нед. фолиевой кислоты. Поскольку эффект МТ развивается обычно через 8–12 нед., на этот период к лечению добавляют НПВП с учетом факторов риска развития побочных эффектов (ПЭ) (табл. 3) [12]. При назначении НПВП следует учитывать несколько правил: назначать НПВП в наименьших, но достаточных дозах; предпочитать препараты с короткой продолжительностью жизни; при поражении ЖКТ избегать высокоселективных ингибиторов ЦОГ-1 (индометацин, пироксикам); при поражении сердечно-сосудистой системы избегать высокоселективных ингибиторов ЦОГ-2; назначать ацетилсалициловую кислоту не менее чем за 2 ч до приема НПВП.
![Таблица 3. Факторы риска побочных эффектов со стороны ЖКТ и ССС при использовании НПВП [12] Таблица 3. Факторы риска побочных эффектов со стороны ЖКТ и ССС при использовании НПВП [12]](https://www.rmj.ru/upload/medialibrary/cdb/51-5.png)
Необходимость в использовании ГК должна определяться только ревматологами; данная терапия не является рутинной в связи с большим количеством НЯ по мере нарастания кумулятивной дозы ГК. И в международных, и в национальных рекомендациях [2, 3] указывается, что используемые дозы должны быть невысокими (в дебюте лечения — обычно 7,5–10 мг/сут). В последнем систематическом обзоре с метаанализом, посвященным месту ГК и БПВП в терапии РА [13], указывается, что применение высоких доз ГК не имеет преимуществ перед низкими дозами. В настоящий момент пульс-терапия мегадозами ГК (1000 мг преднизолона в течение 3 дней внутривенно) для лечения РА практически не используется. Но и использование низких доз ГК с учетом необходимой многомесячной терапии неизбежно приводит к развитию вторичного остеопороза, профилактику которого начинают сразу после назначения ГК, к значительному увеличению частоты деструкции крупных суставов, чаще тазобедренных, что приводит к инвалидности и увеличивает частоту проведения тотального эндопротезирования, а также к развитию хорошо знакомых клиницистам осложнений стероидной терапии (сахарный диабет, катаракта, ожирение, кушингоид, нарастание частоты инфекционных заболеваний, увеличение риска развития кардиоваскулярных заболеваний и пр.) [14, 15]. ГК назначаются в начале применения БПВП и должны быть отменены так быстро, как позволяет клиническая ситуация, в идеале в течение 6 мес. Но изменение дозы ГК осуществляется только лечащим врачом, о чем необходимо предупредить больного.
Другими составляющими успешного лечения РА являются длительное контролируемое лечение, предупреждение ятрогении, обучение больных и активное вовлечение их в процесс лечения. Роль терапевта в ведении больных РА важна. Терапевт должен понимать и уметь объяснить пациенту, какова цель лечения РА, что представляют собой синтетические БПВП, цитостатики (отличие доз в ревматологии и онкологии), генно-инженерные биологические препараты (ГИБП), их достоинства и недостатки. Терапевт, как и ревматолог, контролирует переносимость терапии и течение коморбидных состояний.
Контроль эффективности терапии осуществляется каждые 3 мес., пока не будет достигнута цель лечения (ремиссия или низкая активность болезни), далее контрольное обследование проводится 1 раз в 6–12 мес. При недостаточной эффективности и переносимости (нетяжелые НР, такие как гастралгии, тошнота, диспепсия) перорального МТ целесообразно назначение парентеральной (подкожной) формы препарата [1, 2]. Биодоступность подкожной формы МТ выше, чем пероральной. Кроме того, концентрация МТ в сыворотке при приеме его per os нарастает только до недельной дозы в 15 мг, а дальнейшее увеличение дозы не приводит к значимому нарастанию концентрации препарата в сыворотке крови (рис. 3) [16].
![Рис. 3. Преимущества парентерального введения метотрексата [16] Рис. 3. Преимущества парентерального введения метотрексата [16]](https://www.rmj.ru/upload/medialibrary/d1f/51-6.png)
Неоднократно приходится сталкиваться с необоснованной отменой терапии МТ, в т. ч. врачами общей практики. Отсутствие значимого эффекта в первые 3–4 мес. не является основанием для отмены терапии — проводится коррекция дозы, перевод больного с оральной формы на парентеральную, возможна коррекция симптоматической терапии (нестероидной и стероидной). Вопрос о смене БПВП решается положительно только в том случае, когда, несмотря на применение МТ, активность заболевания нарастает, т. е. имеет место не недостаточный эффект, а отсутствие эффекта терапии МТ при приеме в максимальной терапевтической дозе (25 мг/нед.) в течение не менее 8–12 нед.
Наиболее часто необоснованная отмена МТ связана с неправильной трактовкой изменений в лабораторных показателях либо с развитием нетяжелых НР. Мониторинг переносимости МТ в начале лечения или при увеличении дозы МТ включает определение уровня АЛТ/АСТ, креатинина, проведение общего анализа крови, что необходимо повторять каждые 1–1,5 мес. до достижения стабильной дозы МТ, затем — каждые 3 мес.; клиническую оценку НР следует проводить во время каждого визита пациентов. Наиболее частые НР при терапии МТ и рекомендации по их купированию приведены в таблице 4.
![Таблица 4. Рекомендации по профилактике и лечению нежелательных реакций, связанных с приемом метотрексата [2] Таблица 4. Рекомендации по профилактике и лечению нежелательных реакций, связанных с приемом метотрексата [2]](https://www.rmj.ru/upload/medialibrary/dec/51-7.png)
Окончательная отмена МТ проводится при реакциях по типу идиосинкразии (кожные реакции, легочная инфильтрация с гипоксемией), выраженных гематологических НР или тяжелом поражении печени, что при использовании низких «ревматологических» доз МТ встречается крайне редко. Во всех остальных случаях доза МТ может корректироваться, осуществляется перерыв в лечении. Так, терапию МТ следует прервать при повышении концентрации АЛТ/АСТ >3 верхней границы нормы (ВГН) на время; возобновить лечение в более низкой дозе после нормализации лабораторных показателей. При стойком увеличении уровня АСТ/АЛТ >3 ВГН следует скорректировать дозу МТ; при сохранении увеличения уровня АСТ/АЛТ >3 ВГН после отмены МТ следует провести соответствующие диагностические процедуры. В нашей клинической практике встречались случаи необоснованной отмены МТ при выявлении каких-либо изменений в ткани печени при УЗИ, например жирового гепатоза. Врач, прерывающий лечение МТ без веских на то оснований, должен знать, что это ведет к обострению заболевания, а повторное назначение МТ может привести к ухудшению состояния больного.
Внедрение в практику клиницистов подкожной формы МТ позволило повысить эффективность терапии. По нашим данным, назначение подкожного МТ больным РА в первые 6 мес. позволяет у всех больных в течение 6–12 мес. достичь ремиссии (в ряде случаев без лекарственной ремиссии) или минимальной активности заболевания, предотвратить разрушение суставов, сохранить функциональные способности больного [17]. Также применение подкожной формы МТ позволяет в среднем на 50% уменьшить частоту развития НР со стороны ЖКТ. По данным метаанализа 7 исследований (n=1335 пациентов с РА, получавших метотрексат в дозе ≥15 мг/нед. перорально или подкожно), при подкожном введении данного препарата на 45% уменьшалась частота развития НР со стороны ЖКТ в целом (p=0,0005), а также частота тошноты и рвоты (на 47 и 57% соответственно, p=0,04 в обоих случаях) [18].
Актуальной проблемой как для пациентов, длительно получающих иммуносупрессивную терапию, так и для медицинского персонала, обеспечивающего инъекции МТ, являются удобство и безопасность инъекции. По результатам финансируемого ВОЗ исследования, проведенного в 2014 г., до 1,7 млн человек были инфицированы вирусом гепатита С, а 33 800 человек были инфицированы ВИЧ в результате небезопасных инъекций. От 10 до 51% больных РА и спондилоартропатиями являются носителями гепатита В [20]. С целью снижения риска внутрибольничных заражений, а также повышения удобства самостоятельной инъекции для пациентов с деформацией суставов кисти ВОЗ рекомендует к 2020 г. полностью перейти от приготовления растворов для инъекции к предварительно наполненным шприцам с системой автоматической защиты иглы. Наличие такой системы снижает риск заражения в результате укола по неосторожности: механизм сконструирован таким образом, что игла взаимодействует с тканями непосредственно во время инъекции, а после ее проведения мгновенно закрывается защитным колпачком [21]. Таким образом, наличие МТ в предварительно наполненных шприцах для подкожной инъекции позволяет не только улучшить эффективность, переносимость терапии и удобство для пациента, но и существенно снизить риски, ассоциированные с инъекцией.
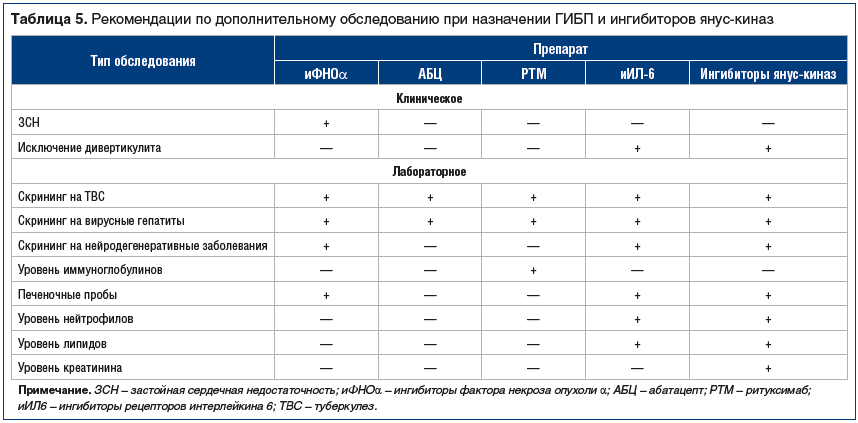
Вторым препаратом из группы БПВП является лефлуномид, который может использоваться у больных РА в случае неэффективности и/или непереносимости МТ, при условии отсутствия быстрого нарастания клинической и лабораторной активности РА, быстрого прогрессирования деструкции суставов, появления или увеличения выраженности внесуставных проявлений, высокого уровня иммунологических маркеров РА (РФ, АЦЦП). При наличии этих прогностически неблагоприятных факторов ревматологи переходят к лечению ГИБП или таргетными БПВП (ингибиторами янус-киназ). Это экономически затратные виды терапии, вызывающие различные НР, частично совпадающие с таковыми при приеме классических БПВП. В первую очередь это развитие инфекций, в т. ч. оппортунистических, хотя некоторые НР связаны с механизмом действия ГИБП или ингибиторов янус-киназ. Рекомендации по необходимому обследованию перед назначением этой терапии представлены в таблице 5. Пациенты с РА могут обращаться к терапевту со своими «неревматологическими» проблемами, например, в связи с появлением признаков застойной сердечной недостаточности или с банальной инфекцией и пр. Поэтому терапевт должен быть иметь в виду, что это может быть связано с проводимой по поводу РА терапией, и решать вопрос о ее коррекции совместно с ревматологом.
Заключение
Несмотря на то, что ведение больных РА должно осуществляться ревматологами, роль терапевта в улучшении непосредственных и отдаленных исходов этого тяжелого, потенциально инвалидизирующего заболевания очевидна. Больные с ранней клинической, а подчас и доклинической стадией РА в первую очередь обращаются к врачам общей практики. Поэтому терапевт должен быть информирован об основных симптомах ранней стадии РА для своевременного направления больного к ревматологу. Терапевт должен уметь заподозрить развитие системного воспалительного заболевания суставов, назначить адекватное обследование. Следует избегать назначения излишних лабораторных исследований, что происходит примерно в 20% случаев. Излишнее обследование не только увеличивает материальную нагрузку на систему здравоохранения и на пациента, но и может затянуть время до назначения адекватной терапии. Кроме того, возможно получение ложнопозитивных или ложнонегативных данных, что также увеличивает продолжительность диагностического поиска. Высокая частота ложноположительных результатов (гипердиагностика) обусловливает неоправданную психологическую нагрузку на пациента и назначение неадекватного лечения [19]. Терапевт должен как можно раньше ?
