Ревматоидный артрит насонова патогенез
Ревматоидный артрит (РА) – наиболее частое воспалительное заболевание суставов, распространенность которого в популяции около 1%, а экономические потери от РА для общества сопоставимы с ишемической болезнью сердца. Через 20 лет от начала болезни примерно 90% пациентов в большей или меньшей степени теряют трудоспособность, а треть становятся полными инвалидами. Жизненный прогноз у пациентов РА столь же неблагоприятен, как и при лимфогранулематозе, инсулин–зависимом сахарном диабете и трехсосудистом поражении коронарных артерий (рис. 1). Увеличение смертности во многом обусловлено нарастанием частоты сопутствующих заболеваний (инфекции, поражение сердечно–сосудистой системы и почек, остеопоретические переломы и др.), развитие которых патогенетически связано с плохо контролируемыми ревматоидным воспалением и дефектами иммунитета.
Рис. 1. Ревматоидный артрит: общие сведения
В последние годы в лечении РА достигнуты существенные успехи. С помощью современных базисных противоревматических препаратов (метоторексат, лефлюномид и др.) и особенно «биологических» агентов (например, моноклональных антител к фактору некроза опухоли–a – Ремикейд) у многих пациентов удается достигнуть существенного снижения активности заболевания (70% «ответа» по критериям Американской коллегии ревматологов – АКР) и в целом улучшить прогноз болезни. Тем не менее фармакотерапия этого заболевания остается одной из наиболее сложных проблем медицины, а возможность полного «излечения» пациентов представляется сомнительной. Это объясняется многими причинами (рис. 2).
Рис. 2. Трудности лечения ревматоидного артрита
РА – чрезвычайно гетерогенное заболевание, основу патогенеза которого составляет сложное, плохо изученное сочетание генетически детерминированных и приобретенных дефектов («дисбаланс») нормальных (иммуно)регуляторных механизмов, ограничивающих патологическую активацию иммунной системы в ответ на потенциально патогенные, а нередко и физиологические стимулы [1] (рис. 3). Это определяет чрезвычайное разнообразие клинических, патологических и иммунологических проявлений, сочетание которых делает РА более похожим на клинико–иммунологический синдром. Кроме того, несмотря на интенсивные исследования, РА по–прежнему остается заболеванием с неизвестной этиологией. Более того, есть веские основания предполагать, что даже если удастся доказать роль какого–либо инфекционного агента в развитии некоторых форм РА, его элиминация с помощью антибактериальных или противовирусных препаратов (и даже вакцинации) вряд ли позволит «излечить» заболевание. Это связано с тем, что потенциальный этиологический фактор вероятней всего принимает не прямое, а опосредованное участие в развитии болезни, например, путем активации иммунопатологического процесса, за счет «молекулярной» мимикрии или каких–либо других неизвестных механизмов. Предполагается, что самый ранний этап иммунопатогенеза РА определяется не специфическим иммунным распознаванием «артритогенного» (инфекционного?) агента, а связан с «неспецифической» воспалительной реакцией, индуцированной различными стимулами, которая в дальнейшем индуцирует аберантную реакцию синовиальных клеток у генетически предрасположенных индивидуумов. Затем в результате «рекрутирования» иммунных клеток (Т– и В–лимфоциты, дендритные клетки) в полости сустава происходит формирование как бы «эктопического» лимфоидного органа, клетки которого запускают синтез аутоантител к компонентам синовиальной оболочки. Аутоантитела, наряду с активированными Т–лимфоцитами, еще больше усиливают (амплифицицируют) воспалительную реакцию, вызывающую прогрессирующее повреждение суставных тканей. В недавних исследованиях было убедительно показано, что не только ревматоидный фактор, но и аутоантитела с другой специфичностью (например, к цитрулинированным пептидам, глюкозо–6–фосфат изомеразе) могут играть важную роль в иммунопатогенезе РА.
Рис. 3. Патогенез ревматоидного артрита
Почему необходима «ранняя» диагностика ревматоидного артрита?
Имеются данные о том, что «субклинически» текущий иммунопатологический процесс развивается задолго до появления клинически очевидных признаков артрита. Действительно, по данным биопсии синовиальной оболочки суставов признаки хронического синовита выявляются уже в самом начале болезни даже в клинически не пораженных суставах. У двух третей пациентов структурные изменения (эрозии) суставов обнаруживаются уже в течение первых двух лет с момента появления болезни (рис. 4). Уже в самом начале «вклад» структурных повреждений в показатель «потеря трудоспособности» весьма значителен (около 25%) и в дальнейшем неуклонно нарастает с развитием болезни (рис. 5). Доказано, что предотвращение структурных повреждений на ранних стадиях заболевания способствует сохранению функциональной активности пациентов в долговременной перспективе. Однако промежуток времени, в течение которого даже самая активная противовоспалительная терапия может эффективно затормозить прогрессирование поражения суставов, весьма короткий и иногда составляет всего несколько месяцев от начала болезни [2,3]. Все это вместе взятое свидетельствует о том, что РА является ярким примером заболеваний, при которых отдаленный прогноз во многом зависит от того, насколько рано удается поставить диагноз и начать активную фармакотерапию. В этом отношении РА в определенной степени напоминает другие хронические заболевания, такие как сахарный диабет и артериальная гипертензия [4] (рис. 6). Однако между этими заболеваниями и РА имеются и существенные различия. Если «ранняя» диагностика артериальной гипертензии и сахарного диабета в подавляющем большинстве случаев не представляет трудностей, поскольку основывается на оценке хорошо известных врачам клинических проявлений и использовании доступных лабораторных и инструментальных методов, то диагностика РА в дебюте болезни является значительно более трудной (иногда неразрешимой) задачей. Это связано с рядом объективных и субъективных обстоятельств. Во–первых, симптомы «раннего» РА часто не специфичны и могут наблюдаться при чрезвычайно широком круге как ревматических, так и неревматических заболеваний (рис. 7). При этом общепринятые классификационные критерии «достоверного» РА не подходят для ранней постановки диагноза. Во–вторых, для диагностики РА требуются специальные знания и навыки в отношении оценки клинических и рентгенологических признаков поражения суставов, а также интерпретации лабораторных (иммунологических) тестов, с которыми плохо знакомы врачи общей практики. По оценке зарубежных исследователей, «не ревматологи» значительно реже (и позже), чем ревматологи ставят диагноз РА и назначают эффективные «базисные» противоревматические препараты. Пациенты РА, наблюдающиеся у ревматологов, имеют лучший функциональный статус и более высокое «качество жизни» на протяжении всего периода болезни. Наконец, лечение новыми эффективными противоревматическими препаратами может осуществляться только ревматологами, поскольку требуют специальных знаний для обеспечения максимальной эффективности и безопасности терапии. Все это вместе взятое подчеркивает необходимость всемерного развития специализированной ревматологической помощи, созданной в нашей стране более 40 лет назад.
Имеются данные о том, что «субклинически» текущий иммунопатологический процесс развивается задолго до появления клинически очевидных признаков артрита. Действительно, по данным биопсии синовиальной оболочки суставов признаки хронического синовита выявляются уже в самом начале болезни даже в клинически не пораженных суставах. У двух третей пациентов структурные изменения (эрозии) суставов обнаруживаются уже в течение первых двух лет с момента появления болезни (рис. 4). Уже в самом начале «вклад» структурных повреждений в показатель «потеря трудоспособности» весьма значителен (около 25%) и в дальнейшем неуклонно нарастает с развитием болезни (рис. 5). Доказано, что предотвращение структурных повреждений на ранних стадиях заболевания способствует сохранению функциональной активности пациентов в долговременной перспективе. Однако промежуток времени, в течение которого даже самая активная противовоспалительная терапия может эффективно затормозить прогрессирование поражения суставов, весьма короткий и иногда составляет всего несколько месяцев от начала болезни [2,3]. Все это вместе взятое свидетельствует о том, что РА является ярким примером заболеваний, при которых отдаленный прогноз во многом зависит от того, насколько рано удается поставить диагноз и начать активную фармакотерапию. В этом отношении РА в определенной степени напоминает другие хронические заболевания, такие как сахарный диабет и артериальная гипертензия [4] (рис. 6). Однако между этими заболеваниями и РА имеются и существенные различия. Если «ранняя» диагностика артериальной гипертензии и сахарного диабета в подавляющем большинстве случаев не представляет трудностей, поскольку основывается на оценке хорошо известных врачам клинических проявлений и использовании доступных лабораторных и инструментальных методов, то диагностика РА в дебюте болезни является значительно более трудной (иногда неразрешимой) задачей. Это связано с рядом объективных и субъективных обстоятельств. Во–первых, симптомы «раннего» РА часто не специфичны и могут наблюдаться при чрезвычайно широком круге как ревматических, так и неревматических заболеваний (рис. 7). При этом общепринятые классификационные критерии «достоверного» РА не подходят для ранней постановки диагноза. Во–вторых, для диагностики РА требуются специальные знания и навыки в отношении оценки клинических и рентгенологических признаков поражения суставов, а также интерпретации лабораторных (иммунологических) тестов, с которыми плохо знакомы врачи общей практики. По оценке зарубежных исследователей, «не ревматологи» значительно реже (и позже), чем ревматологи ставят диагноз РА и назначают эффективные «базисные» противоревматические препараты. Пациенты РА, наблюдающиеся у ревматологов, имеют лучший функциональный статус и более высокое «качество жизни» на протяжении всего периода болезни. Наконец, лечение новыми эффективными противоревматическими препаратами может осуществляться только ревматологами, поскольку требуют специальных знаний для обеспечения максимальной эффективности и безопасности терапии. Все это вместе взятое подчеркивает необходимость всемерного развития специализированной ревматологической помощи, созданной в нашей стране более 40 лет назад.
Рис. 4. Признаки прогрессирования ревматоидного артрита
Рис. 5. Связь между рентгенологическим повреждением суставов и функциональной недостаточностью
Рис. 6. Ревматоидный артрит, сахарный диабет и артериальная гипертензия: сравнительный анализ
Рис. 7. Заболевания, с которыми необходимо дифференцировать «ранний» ревматоидный артрит
Таким образом, одна из причин неблагоприятного прогноза при РА – длительный период времени между началом болезни и поступлением пациента под наблюдение ревматолога, который может, уточнив диагноз, назначить адекватную терапию. Учитывая высокую частоту РА (как и других заболеваний опорно–двигательного аппарата) в популяции, очевидно, что одним из важных факторов, который может способствовать улучшению прогноза у пациентов РА – активное выявление этого заболевания на поликлиническом этапе врачами общей практики. Группа авторитетных европейских и американских ревматологов разработала алгоритм, цель которого создать условия для более активного выявления пациентов с «ранним» РА на поликлиническом этапе [5] (рис. 8). В качестве диагностического признака «раннего» РА (а также показателя «активности» болезни) предлагается учитывать длительность утренней скованности (более 30 мин). Напомним, что длительность «утренней скованности» более 60 минут (на протяжении 6 недель) является диагностическим критерием «достоверного» РА, а при невоспалительных заболеваниях суставов она не должна превышать 30 мин. При осмотре пациентов следует оценить тест «сжатия» пястно–фаланговых и плюсне–фаланговых суставов, положительные результаты которого отражают наличие воспаления суставов. Следует принимать во внимание, что быстрое прогрессирование поражения суставов более вероятно при наличии высоких титров ревматоидного фактора (РФ), увеличении СОЭ и С–реактивного белка. Однако поскольку эти показатели на очень ранней стадии болезни часто находятся в пределах нормы, отрицательные результаты лабораторных тестов не исключают диагноз РА, равно как и необходимость направления пациентов на консультацию к ревматологу.
Рис. 8. Показания для консультации у ревматолога пациента с подозрением на ранний ревматоидлный артрит
Почему при ревматоидном артрите необходима ранняя базисная терапия
Ранее считалось, что лечение РА должно начинаться с «монотерапии» НПВП, а назначение «базисных» противоревматических препаратов следует зарезервировать за пациентами, «не отвечающими» на эти препараты. Это положение основывалось главным образом на представлении о том, что РА – «доброкачественное» заболевание, а лечение НПВП более безопасно, чем «базисными» противоревматическими препаратами, токсичность которых превосходит «пользу» от их назначения. Однако в настоящее время убедительно доказано, что «монотерапия» НПВП ассоциируется с высокой частотой побочных эффектов (в первую очередь, со стороны ЖКТ). Кроме того, НПВП обладают только симптоматическим действием, не влияя на прогрессирование болезни. Фактически по частоте и выраженности побочных эффектов каких–либо различий между НПВП и «базисными» противоревматическими препаратами не отмечено. Более того, результаты плацебо–контролируемых исследований свидетельствуют о том, что назначение в ранний период болезни даже наименее эффективных «базисных» противоревматических препаратов (пероральные препараты золота и гидроксихлорохин) и особенно сульфасалазина позволяет уменьшить выраженность клинических проявлений и улучшить функциональное состояние пациентов [7] (рис. 9). Важно, что пациенты, длительно страдающие РА, значительно хуже «отвечают» на «базисные» противоревматические препараты, чем пациенты, получавшие эту терапию, начиная с ранней стадии болезни.
Ранее считалось, что лечение РА должно начинаться с «монотерапии» НПВП, а назначение «базисных» противоревматических препаратов следует зарезервировать за пациентами, «не отвечающими» на эти препараты. Это положение основывалось главным образом на представлении о том, что РА – «доброкачественное» заболевание, а лечение НПВП более безопасно, чем «базисными» противоревматическими препаратами, токсичность которых превосходит «пользу» от их назначения. Однако в настоящее время убедительно доказано, что (в первую очередь, со стороны ЖКТ). Кроме того, НПВП обладают только симптоматическим действием, не влияя на прогрессирование болезни. Фактически по частоте и выраженности побочных эффектов каких–либо различий между НПВП и «базисными» противоревматическими препаратами не отмечено. Более того, результаты плацебо–контролируемых исследований свидетельствуют о том, что назначение в ранний период болезни даже наименее эффективных «базисных» противоревматических препаратов (пероральные препараты золота и гидроксихлорохин) и особенно сульфасалазина позволяет [7] (рис. 9). Важно, что пациенты, длительно страдающие РА, значительно хуже «отвечают» на «базисные» противоревматические препараты, чем пациенты, получавшие эту терапию, начиная с ранней стадии болезни.
Рис. 9. Преимущества раннего назначения базисной терапии при ревматоидном артрите
Принципиальное значение имеют данные, касающиеся влияния базисной терапии на жизненный прогноз пациентов РА. Оказалось, что у тех из них, которые получали адекватную «базисную» терапию на протяжении всего периода болезни, продолжительность жизни достоверно выше (практически не отличается от популяционной), чем у пациентов, которые в силу различных причин не принимали базисные препараты или принимали их эпизодически. Примечательно, что эффективное лечение метотрексатом (но не другими базисными препаратами) позволяет существенно снизить кардиоваскулярную летальность у пациентов РА, которая является одной из основных причин уменьшения продолжительности жизни.
Таким образом, результаты клинических исследований, во многом базирующихся на опыте работы специализированных клиник, куда госпитализируются больные с подозрением на «ранний» РА, организованных в середине 90–х годов в ряде стран Западной Европы, свидетельствует о том, что раннее активное лечение больных РА позволяет снизить риск ранней инвалидизации и улучшить отдаленный прогноз болезни. Хотя исследования в этом направлении еще только разворачиваются, имеющиеся данные со всей очевидностью свидетельствуют о насущной необходимости скорейшего внедрения концепции «ранняя диагностика–ранняя терапия» и в нашей стране.
Литература:
1. El–Gabalawy H.D., Lipsky P.E. Why do we not have a cure for rheumatoid arthritis? Arthritis Rheum., 2002:4 (suppl 3):S297–S301
2. O`Dell. Treating rheumatoid arthritis early: a window of opportunity? Arthritis Rheum., 2002;46:283–185
3. Scott D.L. The diagnosis and prognosis of early arthritis: rationale for new prognostic criteria. Arthritis Rheum., 2002; 46: 286–290
4. Pincus T., Gibofsky A., Weinblatt M.E. Urgent care and tight control of rheumatoid arthritis as in diabetes and hypertension: better treatment but shortage of rheumatology. Arthritis Rheum., 2002; 46: 851–854.
5. Emery P., Breedveld F.C., Dougados M., et al. Early referral recommendation for newly diagnosed rheumatoid arthritis: evidence based development of a clinical guide. Ann. Rheum. Dis., 2002; 61: 290–297.
6. Quinn M.A., Conaghan P.G., Emery P. The therapeutic approach of early intervention for rheumatoid arthritis: what is the evidence? Rheumatology 2001;40:1211–1220
Источник
Ревматоидный артрит (РА) – хроническое системное заболевание соединительной ткани с прогрессирующим поражением преимущественно периферических (синовиальных) суставов по типу эрозивно-деструктивного полиартрита, с возможным развитием полиорганного поражения и тяжелых осложнений, таких как вторичный амилоидоз. РА представляет собой наиболее распространенное аутоиммунное заболевание, регистрируется во всех странах мира и во всех климатогеографических зонах, во всех возрастных, расовых и этнических группах, поражая 0,5–2% взрослого населения в наиболее работоспособном возрасте – 35–55 лет [1–3]; женщины болеют чаще чем мужчины (соотношение женщин и мужчин 3:1). По данным 2012 г., заболеваемость РА в РФ составляет 241,3 на 100 тыс. населения [4].
Основными клиническими проявлениями РА являются суставные поражения в виде эрозивного артрита с болью и припухлостью пораженных суставов, утренняя скованность, образование ревматических узелков. В развернутых стадиях заболевания возникают деформации пораженных суставов, повреждения связочного аппарата и синовиальной сумки. Помимо поражения суставов для пациентов с РА характерно развитие системных внесуставных проявлений, таких как ревматоидный васкулит, плеврит, перикардит, синдром Фелти, периферическая полиневропатия, поражение глаз, гломерулонефрит [5].
Наиболее характерным проявлением заболевания, наряду с прогрессирующим поражением суставов, потерей подвижности, утомляемостью, внесуставными проявлениями, является хронический болевой синдром, локализованный обычно в области суставов. Именно хронический болевой синдром служит ведущей жалобой пациентов и оказывает решающее влияние на снижение качества жизни. Боль рассматривают как показатель активности болезни, и в то же время активность заболевания не всегда является предиктором интенсивности боли и нарушения функции суставов.
Неврологические нарушения при РА
В настоящее время существует ряд клинико-экспериментальных исследований, демонстрирующих роль неврогенных механизмов в патогенезе болевого синдрома при РА [6–8]. Наряду с клиническими признаками воспаления у пациентов с РА наблюдаются специфические сенсорные феномены, характерные для невропатической боли [9–11].
Среди неврологических нарушений при РА наиболее часто выявляется поражение периферической нервной системы (ПНС) [12]. Американскими ревматологами было проведено клиническое, электрофизиологическое и патоморфологическое исследование ПНС у 108 больных РА. У 62 обследованных (57,4%) выявлены электрофизиологические доказательства наличия невропатии. Среди них 53 (85,5%) имели чисто сенсорную или сенсомоторную аксональную невропатию, а 9 (14,5%) – демиелинизирующую полиневропатию. Синдром запястного канала выявлен у 11 из 108 больных. Поражения ПНС имели разнообразную клиническую картину: боль, парестезии, моторные и сенсорные нарушения. Авторы обращали внимание на то, что эти симптомы могут имитировать суставную боль или сопровождать ее. Однако не было получено данных о взаимосвязи неврологических проявлений с длительностью заболевания, наличием эрозий, деформаций суставов и приемом противовоспалительных препаратов [13].
В целом, по данным литературы, частота неврологических осложнений у больных РА имеет большой разброс (от 0,5 до 85%) и представлена преимущественно полиневропатией (сенсорной, моторной или сенсомоторной), а также множественными мононевропатиями, шейной миелопатией или туннельным синдромом [14–18].
Полиневропатия, при которой поражаются как двигательные (моторные), так и чувствительные (сенсорные) волокна, выявляется более чем в 50% случаев. На сегодняшний день трудными для диагностики остаются моторные нарушения, поскольку имеющиеся деформации суставов с ограничением активных и пассивных движений, сопутствующей мышечной атрофией зачастую препятствуют определению причины пареза: патология суставов или патология периферических нервов. Полиневропатия характерна больше при длительном течении болезни [11, 13, 18].
Основной причиной поражения ПНС являются васкулит и ишемия сосудов, питающих периферические нервы. Диагностика поражения ПНС основывается на чувствительных нарушениях в дистальных отделах конечностей, снижении поверхностной и глубокой чувствительности, данных стимуляционной электронейромиографии (ЭНМГ) (снижение скорости распространения возбуждения по моторным и сенсорным волокнам и М-ответа в дистальных отделах конечностей).
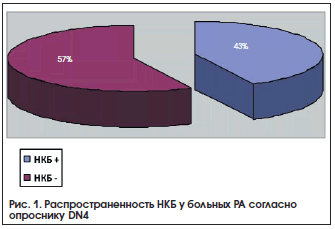
В 2012 г. нами проведено исследование с целью выявить нейропатический компонент боли (НКБ) у больных с РА. Обследовано 183 пациента с достоверным РА, (средний возраст 46,5±11,7 года) с длительностью заболевания от 3-х месяцев до 30 лет (в среднем 9,1±7,6 года) [19]. По данным опросника DN4 для диагностики вида боли, 73 пациента (43%) набрали 4 и более баллов, что свидетельствует о нейропатическом характере боли (рис. 1).
Статистический анализ 2-х групп пациентов – с НКБ (НКБ+) и без НКБ (НКБ–) – показал, что с увеличением возраста больного, длительности заболевания, клинической стадии и снижением функциональных возможностей возрастает вероятность наличия НКБ у больного. Причем индекс DAS28, позволяющий определить активность болезни и эффективность терапии при РА, и СОЭ не являются предикторами боли.
Анализ болевого синдрома с помощью наиболее популярного в России опросника DN4 [20] выявил различные качественные характеристики хронического болевого синдрома у пациентов с РА. Наиболее частыми дескрипторами невропатической боли были прострелы, похожие на удар током (51%), ползание мурашек (40%), покалывание (54%) и онемение (57%).
Исследование неврологического статуса выявило у пациентов с НКБ в 96% случаев поражение ПНС, которое было представлено дистальной сенсомоторной полиневропатией (55%), туннельным синдромом (14%), мононевропатией (19%), шейной миелопатией (4%), сочетанием полиневропатии с туннельным синдромом (4%). Лишь у 4% поражение ПНС отсутствовало [21]. Полиневропатия чаще выявлялась у пациентов более старшего возраста, длительно болеющих РА, что подтвердило данные зарубежных коллег (рис. 2).
Для подтверждения полиневропатии пациентам проведена стимуляционная ЭНМГ, которая выявила преимущественное снижение скорости распространения возбуждения и амплитуды М-ответа в дистальных отделах конечностей, что позволило говорить о наличии у них смешанного типа поражения ПНС – аксонального и демиелинизирующего.
Основные принципы терапии невропатической боли при РА
Проведенное нами исследование показало, что хронический суставной болевой синдром при РА носит смешанный характер. Наряду с ноцицептивным компонентом, обусловленным воспалением, у 43% пациентов преобладает НКБ, что требует комплексной терапии. Наряду с НПВП, базисной противовоспалительной, глюкокортикостероидной и генно-инженерной биологической терапией, направленной на основное заболевание и ноцицептивный компонент, необходимо рассмотреть терапию нейропатического компонента. Согласно международным рекомендациям, наряду с вышеуказанными препаратами, для лечения НКБ необходимо использовать препараты центрального действия (анктиконвульсанты и антидепрессанты) и витамины группы В.
В течение многих лет ученые занимаются клиническими исследованиями применения при различных неврологических заболеваниях витаминов группы В, прежде всего витаминов В1 (тиамин), В6 (пиридоксин) и В12 (цианокобаламин), обладающих определенным механизмом действия.
• Тиамин (В1) оказывает репаративное действие на пораженные нейроны, а также замедляет прогрессирование поражения сосудистого русла.
• Пиридоксин (В6) оказывает нейротропное действие (активируя синтез миелиновой оболочки нервного волокна и транспортных белков в аксонах, ускоряет процесс регенерации периферических нервов) и противоболевое действие.
• Цианокобаламин (В12) активно влияет на энергообеспечение клеток, синтез белка, регенерацию нервной ткани [22–24].
На сегодняшний день уже не ставится под сомнение анальгетический эффект этих витаминов [22, 25, 26] и целесообразность их использования в лечении болевых синдромов с сенсорными нарушениями, а также в комплексной терапии невропатической боли с применением Габапентина [27, 28]. В 2016 г. A. Mimenza и S. Aguilar провели исследование с применением антиконвульсантов и витаминов В1 и В12 у больных с диабетической полиневропатией. В течение 12 нед. пациентам с болевой формой диабетической полиневропатии проводили терапию по 2-м схемам: 1) Габапентин 300–3600 мг + В12 (20 мг) и В1 (100 мг); 2) Прегабалин 75–600 мг. Достоверное снижение выраженности болевого синдрома получено в обеих группах, однако комбинация Габапентина с витаминами В1 и В12 позволила использовать меньшие дозы антиконвульсанта, что является немаловажным аспектом.
Спектр заболеваний нервной системы, при которых патогенетически обосновано применение витаминов группы В, разнообразен. Полиневропатия как основной этиологический фактор периферической нейропатической боли у больных с РА – один из основных показаний к применению витаминов группы В.
Оригинальным препаратом, содержащим комплекс витаминов В1, В6, В12, является Нейробион (МЕРК), он оказывает тройное действие на нейроны: нормализует обмен углеводов (за счет витамина В1); увеличивает синтез нейромедиаторов (за счет витамина В6); стимулирует синтез защитной миелиновой оболочки (за счет витамина В12). Препарат выпускается в 2-х формах: инъекционной и таблетированной, при этом отсутствие в препарате лидокаина снижает риск развития аллергии.
Показания к применению препарата Нейробион (МЕРК):
• нейропатическая боль при полинейропатии;
• болевой синдром при заболеваниях позвоночника (люмбоишиалгия, плексопатия, корешковый синдром, вызванный дегенеративными изменениями позвоночника);
• невриты и невралгии (невралгия тройничного нерва, неврит лицевого нерва, межреберная невралгия).
Схемы применения препарата Нейробион (МЕРК) различаются в зависимости от интенсивности болевого синдрома. При выраженном болевом синдроме лечение целесообразно начинать с внутримышечного введения 3 мл/сут (1 ампула) до снятия острых симптомов. После уменьшения выраженности симптомов или при умеренной их тяжести назначают по 3 мл (1 ампула) 3 р./нед. в течение 2–3-х недель. В целях профилактики рецидива рекомендуется поддерживающая схема: внутрь по 1 таблетке 1–3 р./сут в течение 1–1,5 мес. или по назначению врача.
Следует обратить внимание, что при длительном курсе терапии (18 нед.) диабетической полиневропатии витаминами группы В не наблюдалось побочных эффектов, которые могли бы свидетельствовать о передозировке препарата [29].
Синергическое взаимодействие препаратов с различными механизмами действия обусловливает больший болеутоляющий эффект при меньших неблагоприятных явлениях.
Источник
