Ревматоидный артрит по воз
Содержание:
«В движении жизнь» – это выражение, вероятно, слышали все. Действительно, для осуществления нормальной жизнедеятельности человеку приходится постоянно перемещать свое тело в пространстве. В ходе эволюции организм обзавелся прекрасными элементами, которые обеспечивают данную функцию на высшем уровне. Эти удивительные части тела – суставы. Все кости человека удивительно прочны и упруги по отдельности, что позволяет им выдерживать колоссальные нагрузки. Соединяясь же воедино, они формируют удивительно подвижный скелет, который позволяет выполнять невероятные движения. Все это достигается благодаря слаженной работе массы суставов.
К сожалению, есть заболевания, в результате прогрессирования которых суставы организма поражаются и теряют свою подвижность. В результате у пациента значительно снижается качество жизни. Ревматоидный артрит – очень актуальная проблема современной ревматологии. Это системное заболевание, поражающее соединительную ткань. В результате его развития у пациента поражаются мелкие суставы по эрозивно-деструктивному типу. Во всем мире от данного заболевания страдает около 60 миллионов пациентов, что составляет до 1% от всей популяции.
Еще более усугубляет всю ситуацию то, что врачи не смогли до настоящего времени определить точную причину развития заболевания. Есть отдельные теории и предположения, но ни одна из них не нашла действительно весомого подтверждения. С течением времени же все симптомы болезни неуклонно усугубляются, постепенно приводя к стойкой утрате нетрудоспособности человеком. Примерно в три раза чаще заболевают женщины. Средний возраст пациента при выявлении заболевания – 30-35 лет.
Причины ревматоидного артрита
В настоящее время есть несколько наиболее вероятных этиологических факторов болезни. Каждая версия имеет свои преимущества и недостатки. В целом же все больше медиков склоняются к тому, что ревматоидный артрит – полифакторное заболевание, которое развивается при комбинировании сразу нескольких причин.
— Генетическая предрасположенность – у пациентов с данным диагнозом установлена предрасположенность к нарушениям активности иммунной системы на генетическом уровне. Уже обнаружены некоторые антигены, наличие которых может приводить к изменению гуморального и клеточного иммунитета вследствие воздействия некоторых инфекций. Также можно проследить повышенную вероятность развития ревматоидного артрита у людей, ближайшие родственники которых также болели ним.
— Инфекционные агенты, способные в результате своих специфических свойств вызывать изменения в иммунитете человека, в результате чего собственные защитные факторы атакуют свою соединительную ткань. На роль этих возбудителей выдвигаются: вирус Эбштейн-Бара, ретровирусы, возбудители краснухи, герпеса, цитомегаловирус, микоплазмы. У врачей есть некоторые доказательства в пользу этой гипотезы:
- У 80% пациентов выявляются повышенные титры антител к вирусу Эбштейн-Бара.
- В лимфоцитах больных ревматоидным артритом Эбштейн-Бара выявляется намного чаще, чем у здоровых людей.
Выше были указаны факторы, которые создают предпосылки для развития заболевания. Выделяют также пусковые факторы, которые провоцируют его проявление у конкретного пациента в определенное время.
- Переохлаждение.
- Повышенное воздействие солнечного света (гиперинсоляция).
- Интоксикация, в том числе и токсинами микроорганизмов.
- Бактериальная инфекция.
- Прием некоторых лекарственных препаратов.
- Нарушение функции эндокринных желез.
- Эмоциональное перенапряжение и стрессы.
Что интересно, кормление грудью на протяжении двух лет и более снижает вероятность развития ревматоидного артрита в два раза.
Механизм развития ревматоидного артрита
Установлено, что при воздействии одного или комбинации провоцирующих факторов в организме пациента запускает неверная иммунная реакция. Собственные клетки вырабатывают вещества, которые вызывают повреждение синовиальной оболочки суставов. Сначала развивается синовиит, который впоследствии переходит в пролиферативную стадию и вызывает повреждение самого хряща и костей.
Также иммунитет вырабатывает патологические цитокины, которые обладают рядом отрицательных свойств:
- провоцируют выработку в повышенном количестве провоспалительных факторов, способствующих дальнейшему прогрессированию заболевания;
- активирую некоторые ферменты, которые способны разрушать хрящ, покрывающий сустав и обеспечивающий эластичное скольжение поверхностей;
- поставляют на мембраны тучных слеток специальные молекулы, которые заставляют эти лейкоциты проявлять аутоиммунное действие;
- привлекают в став дополнительные иммунокомпетентные клетки, которые также отрицательно сказываются на течении заболевания в данном случае;
- усиление ангиогенеза, что позволяет сосудам прорастать в хрящ и облегчает для агрессивных факторов попадание вглубь хрящевой ткани.
Классификация ревматоидного артрита
Есть несколько критериев, по которым классифицируется данное заболевание.
Клинико-анатомические формы
- Ревматоидный артрит (олигоартрит, моноартрит, полиартрит) – форма заболевания, при котором происходит поражение исключительно суставов, а другие органы нормально функционируют без нарушения функции.
- Ревматоидный артрит с системными проявлениями – дополнительно аутоиммунные процессы затрагивают серозные оболочки организма (перикард сердца, плевру), легкие, кровеносные сосуды, почки, нервную систему, вызывает отложение во внутренних органах патологического белка – амилоида.
- Ревматоидный артрит, сочетающийся с деформирующим остеоартрозом, ревматизмом.
- Ювенильный ревматоидный артрит.
Характеристика с точки зрения иммунологии
В зависимости от того, выявляется ли ревматоидный фактор в крови пациента, все случаи заболевания делят на серопозитивные и серонегативные. Это имеет большое значение для врачей во время диагностики и планирования предстоящего лечения.
Течение заболевани
- Медленно прогрессирующее – заболевание на протяжении многих лет медленно переходит на другие суставы, больные сочленения не сильно повреждаются.
- Быстро прогрессирующее – болезнь очень часто обостряется, постепенно вовлекая все больше суставов. Суставные поверхности претерпевают значительные изменения в худшую сторону. Лечение не дает большого эффекта.
- Без заметного прогрессирования – наиболее благоприятная форма. С которой пациент может прожить всю жизнь, сохранив достаточно высокое качество жизни.
Рентгенологическая стадия заболевания
- Околосуставной остеопороз – уменьшение плотности костной ткани за счет снижения содержания в ней кальциевых солей.
- Остеопороз, дополняющийся незначительным снижением суставной щели.
- Сужение суставной щели и остеопороз дополняются множественными узурами.
- Ко всему указанному выше присоединяются костные анкилозы – главная и самая стойкая причина снижения подвижности вплоть до полного ее отсутствия.
Узуры – это глубокие эрозии на суставной поверхности хрящей.
Степень функциональной недостаточности опорно-двигательного аппарата
- 0 – пациент может совершать все движения в полном объеме.
- 1 – человек не может в полной мере выполнять все движения, которые обеспечивают ему возможность выполнять свои профессиональные обязанности.
- 2 – пациент не может трудиться за счет утраты профессиональной трудоспособности.
- 3 – человек не может самостоятельно себя обслуживать в полной мере.
Симптомы ревматоидного артрита
На начальных этапах заболевание протекает без яркой клинической картины. Пациент может годами и не подозревать о том, что у него ревматоидный артрит. Ведущим клиническим проявлением болезни является суставной синдром.
- Утренняя скованность – специфическое проявление заболевания, на котором пациент не заостряет внимания. Во время сна синовиальные оболочки суставов несколько воспаляются за счет снижения секреции глюкокортикоидов в ночное время. Иногда пациенты просто не могут, нормально снять с себя одеяло. Спустя примерно час все симптомы проходят, и человек может активно двигаться.
- Периодические боли в суставах, снижение аппетита, усталость, похудание – все это можно отметить в продромальном периоде.
- Острые боли в суставах, лихорадка – вот так у пациента начинается болезнь. Чаще всего поражаются суставы кистей и стоп, запястья, коленные и локтевые. Другие сочленения поражаются реже. Около сустава отмечается отек, а поверхность кожных покровов имеет более высокую температуру, чем на остальном теле. Также область сустава гиперемирована за счет протекания воспалительных процессов.
- При пальпации суставы болезненны, движение в них ограничено. По мере прогрессирования болезни пролиферативные процессы начинают преобладать, и может происходить значительное ограничение подвижности, деформация и подвывих суставов.
- Ревматоидные узелки – специфическое проявление заболевания, при котором на разгибательной поверхности сустава можно пальпировать плотные подкожные образования. Этот признак является одним из важных диагностических критериев ревматоидного артрита.
Также у пациента могут поражаться практически все органы в теле, в зависимости от степени активности процесса, но это отмечается относительно редко.
Диагностика ревматоидного артрита
Лабораторные исследования
- Общий анализ крови – выявляют анемию, увеличение скорости оседания эритроцитов, увеличение количества лейкоцитов.
- Биохимическое исследование крови – позволяет определить степень активности воспалительного процесса.
- Иммунологическое исследование крови – может определяться ревматоидный фактор, иногда обнаруживаются иммунные комплексы.
Инструментальная диагностика
- Рентгенологическое исследование суставов – в классификации описаны все критерии, которыми руководствуются врачи при выставлении рентгенологической стадии заболевания.
- Радиоизотопное исследование – вводимый элемент активно накапливается в пораженных суставах, а нормальная синовиальная ткань привлекает не так много атомов.
- Пункция сустава и исследование синовиальной жидкости.
- В самых тяжелых случаях – биопсия участка синовиальной оболочки.
Ревматоидный артрит: лечение
Системное лечение данного заболевания предусматривает использование следующих основных групп препаратов:
- нестероидные противовоспалительные вещества;
- базисные препараты;
- гормональные вещества (глюкокортикоиды);
- биологические агенты.
Нестероидные противовоспалительные вещества
Эти лекарства уже относительно давно хорошо себя зарекомендовали в лечении ревматоидного артрита и до сих пор являются лечебными средствами первой линии. Они позволяют относительно быстро купировать острые проявления заболевания и иногда добиться наступления стойкой ремиссии – состояния, при котором симптомы болезни отсутствуют, и пациент может жить полноценной жизнью.
Если пациент попадает к ревматологу в острый период заболевания, то одними только нестероидными противовоспалительными препаратами не обходятся – дополняют их высокими дозами глюкокортикоидов. Этот способ лечения называется пульс-терапией.
Эффект достигается за счет блокирования циклооксигеназы – фермента, благодаря которому в норме арахидоновая кислота распадается с образованием простагландинов и прочих биологически активных веществ, играющих важное значение в развитии воспалительной реакции.
Более старые препараты инактивируют циклооксигеназу-1, за счет чего при передозировке может происходить нарушение функции почек, печени, развиваться энцефалопатия. Современные препараты, используемые для лечения ревматоидного артрита, имеют большую селективность и не так опасны, поэтому пациентам нечего опасаться.
Врачи избегают комбинирования нестероидных противовоспалительных препаратов друг с другом, поскольку в таком случае значительно повышается вероятность развития у пациента побочных реакций, а вот лечебный эффект остается практически неизменным.
Базисные препараты для лечения ревматоидного артрита
Наиболее популярными и эффективными лекарствами для лечения ревматоидного артрита в настоящее время являются: препараты золота, метотрексат, лефлуномид, пеницилламин, сульфасалазин.
Есть также средства резерва: циклофосфан, азатиоприн, циклоспорин – они используются тогда, когда основные препараты не дали желаемого эффекта.
Еще относительно недавно врачи предпочитали постепенно наращивать дозу препарата, получаемую пациентом (принцип пирамиды). В настоящее время доказано, что при начале лечения с использованием высоких доз можно добиться более впечатляющих результатов за счет изменения характера течения заболевания. Только что обнаруженный ревматоидный артрит характеризуется практически полным отсутствием изменений в суставах пациента и высокой вероятностью наступления длительной ремиссии.
Если на протяжении первых месяцев заболевания лечение базисными препаратами не приносит желаемого эффекта, то врачи комбинируют их с глюкокортикоидами. Гормональные препараты снижают активность воспалительного процесса и позволяют подобрать эффективную базисную терапию. Считается, что врачи должны подобрать эффективное лечение ревматоидного артрита препаратами данной группы за полгода.
В процессе лечения пациент должен периодически проходить медицинский осмотр на предмет наличия побочных эффектов от приема препаратов и оценки степени активность самого заболевания.
Глюкокортикоиды
Данная группа препаратов может использоваться по-разному.
- В виде пульс-терапии – прием пациентом высоких доз препарата в сочетании с веществами базисной терапии заболевания. Это позволяет очень быстро снизить активность процесса и убрать воспалительные явления. При этом курс приема препарата не может быть длительным ввиду высокой вероятности развития побочных эффектов.
- В виде курсового лечения с целью угнетения воспалительной реакции при неэффективности других веществ. В данном случае доза значительно отличается в меньшую сторону, а медики стараются подобрать ее таким образом, чтобы пациент принимал минимум гормона, который при этом окажет необходимое действие.
- Локальная терапия – в составе мазей, которыми смазывают пораженные суставы. Показанием в большинстве случаев является олигоартрит или моноартрит крупных суставов. Также использоваться они могут при наличии противопоказаний к системному лечению гормонами и значительным преобладанием местных симптомов над общими.
- Внутрисуставное введение геля, содержащего в своем составе гормональные препараты. Это позволяет на относительно длительное (до месяца) время обеспечить непрерывное воздействие препарата на поврежденную суставную поверхность.
Биологические средства
Моноклональные антитела к некоторым цитокинам обеспечивают нейтрализацию фактора некроза опухолей, который в случае ревматоидного артрита провоцирует поражение собственных тканей.
Также есть исследования, предлагающие использовать в качестве лечения ревматоидного артрита регуляторы дифференцировки лимфоцитов. Это позволит избежать повреждения синовиальных оболочек Т-лимфоцитами, которые неверно «направляются» в суставы иммунитетом.
Другие лечебные мероприятия
- Физиотерапевтические процедуры.
- Профилактика остеопороза.
- Лечебная гимнастика в период ремиссии.
- Хирургическая коррекция патологии суставов.
Источник

Введение
Ревматоидный артрит (РА) — хроническое аутоиммунное заболевание, характеризующееся преимущественным поражением синовиальных суставов и постепенной деструкцией структур сустава. В национальных рекомендациях с 2014 г., а в европейских — с 2016 г. постулируется, что ведение больных РА должно осуществляться ревматологами [1–3]. Однако надо учитывать, что максимальный эффект противовоспалительной терапии при РА развивается на ранних стадиях заболевания. Поэтому вопрос о раннем выявлении больных с РА или с подозрением на развитие РА во многом зависит от знания врачами первичного звена симптомов, характерных для ранней стадии заболевания.
Роль терапевта в ранней диагностике и проведении адекватного лечения ревматоидного артрита
Возможности ранней диагностики ревматоидного артрита
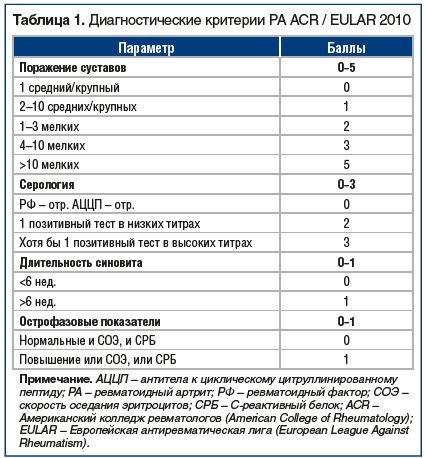
Первый шаг к возможности установить диагноз РА как можно раньше был сделан в 2010 г., когда были опубликованы новые классификационные критерии РА [4]. Они были ориентированы на выявление РА на ранних стадиях (табл. 1). Однако диагноз РА в соответствии с этими критериями устанавливается при наличии полиартрита в сочетании с результатами лабораторных исследований. Еще в 2002 г. были предложены упрощенные критерии раннего РА, которые вошли в национальные рекомендации по ведению больных РА [2, 5]: при наличии у больного как минимум 3 воспаленных суставов определенной локализации (мелкие суставы кистей и стоп), утренней скованности и положительного теста «поперечного сжатия» (рис. 1) больного следует сразу направлять к ревматологу. В статье, описывающей данные критерии раннего РА [5], имеется несколько рекомендаций, которые могут помочь практикующим врачам. Во-первых, применение нестероидных противовоспалительных препаратов (НПВП) способно маскировать симптомы на ранней стадии заболевания, таким образом, врач может не выявить при осмотре припухлости, поэтому в сомнительных случаях возможна отмена НПВП и повторный осмотр через 2–3 дня. Конечно, больного следует предупредить, что боли могут нарастать, но задержка с установкой диагноза нанесет больному больше вреда, поскольку ведет за собой задержку с назначением необходимого лечения. Кроме того, в статье [4] четко указывается, что назначение глюкокортикоидов (ГК) до установления нозологического диагноза недопустимо.

![Рис. 1. Алгоритм ранней диагностики ревматоидного артрита на этапах оказания медицинской помощи [2, 4, 5] Рис. 1. Алгоритм ранней диагностики ревматоидного артрита на этапах оказания медицинской помощи [2, 4, 5]](https://www.rmj.ru/upload/medialibrary/d94/51-3.png)
Наиболее частые варианты дебюта РА — развитие симметричного полиартрита мелких суставов кистей и/или стоп, что сопровождается наличием утренней скованности в суставах, ухудшением общего самочувствия, иногда появлением субфебрилитета. Но РА может дебютировать с развития артрита плечевого или коленного сустава. В национальных рекомендациях по ревматологии [2] четко указано, что каждому больному с ранним артритом (любой локализации) нужно назначить лабораторное обследование, которое включает клинический анализ крови, определение уровня С-реактивного белка, ревматоидного фактора (РФ), антител к циклическому цитруллинированному пептиду (АЦЦП) или к цитруллинированному виментину (анти-MCV) и антинуклеарного фактора, и провести рентгенографию суставов кистей и стоп (в прямой проекции).
Следует ясно представлять, что РА, как и другие хронические заболевания, проходит несколько стадий эволюции — доклиническую и клиническую (рис. 2). РА может дебютировать с развития артритов или с появления только болей в суставах (артралгий). Поэтому врач первичного звена и при отсутствии артритов должен уметь заподозрить дебют РА и без промедления направить больного к ревматологу. В 2017 г. было опубликовано определение артралгий, подозрительных на развитие РА, сформулированное экспертами Европейской антиревматической лиги (EULAR) [6]:
![Рис. 2. Классификация и длительность ревматоидного артрита [4] Рис. 2. Классификация и длительность ревматоидного артрита [4]](https://www.rmj.ru/upload/medialibrary/fa8/51-4.png)
5 параметров врач выясняет при сборе анамнеза:
недавнее начало симптомов (<1 года);
локализация симптомов в мелких суставах;
длительность утренней скованности ≥60 мин;
наибольшая выраженность симптомов в утренние часы;
наличие 1 (рентгенологической) стадии относительно РА.
2 параметра выявляются при осмотре больного (это занимает менее 1 мин):
больной испытывает затруднения при сжатии кулака;
положительный тест «поперечного сжатия» суставов кисти (стоп).
Чувствительность и специфичность этих критериев приведены в таблице 2. Как следует из ее данных, выявление у пациента 4 параметров говорит о том, что у больного дебют РА (в 93,6% случаев), а 5 и более параметров — о необходимости срочного направления больного к ревматологу для верификации диагноза РА. Необходимый объем лабораторного дообследования указан выше.
![Таблица 2. Чувствительность и специфичность оценивае- мых параметров при наличии артралгий как риска РА при экспертизе клинически подозрительных артралгий [6] Таблица 2. Чувствительность и специфичность оценивае- мых параметров при наличии артралгий как риска РА при экспертизе клинически подозрительных артралгий [6]](https://www.rmj.ru/upload/medialibrary/cd5/51-2.png)
Принципы лечения ревматоидного артрита
Основные принципы лечения РА хорошо известны клиницистам. В соответствии с разработанной в настоящее время стратегией лечения РА [7] основной целью является достижение ремиссии (или низкой активности заболевания) у всех больных. Для достижения этой цели необходимо раннее назначение базисных противовоспалительных препаратов (БПВП). При раннем начале лечения (первые 3–6 мес.) у большинства пациентов возможно добиться ремиссии или течения РА с низкой активностью, что и является критерием эффективного лечения РА. Задержка с назначением БПВП приводит к уменьшению эффекта лечения. Был проведен анализ данных 14 рандомизированных контролируемых исследований, в которых оценивалась частота развития эффекта у 1435 больных (886 получали различные БПВП и 549 — плацебо) при различной длительности РА. Учитывались демографические факторы (пол, возраст), функциональные возможности больных, клинико-лабораторные параметры активности болезни (боль, число болезненных и припухших суставов, СОЭ и др.) [8]. При любой длительности РА различие в частоте развития эффекта между активным лечением и плацебо было примерно одинаково — около 30%. Но по мере увеличения длительности РА эффективность БПВП снижалась с 52% (начало терапии при длительности РА <1 года) до 35% (при длительности РА >10 лет).
Первым БПВП, который назначается больным РА, является метотрексат (МТ), который также называют якорным препаратом. Он эффективен у большинства больных РА и обладает хорошей переносимостью доз, используемых в ревматологии [9, 10]. МТ имеет ограниченные противопоказания (острая инфекция, алкоголизм, беременность). Успех лечения зависит от ряда моментов: использование оптимальных терапевтических доз — 15–25 мг/нед.; контроль за эффективностью терапии с коррекцией дозы и формы МТ при недостаточном эффекте; клинический и лабораторный контроль переносимости МТ. Следует подчеркнуть, что с учетом антифолатного действия МТ показано его применение в комбинации с фолиевой кислотой в дозе 1–2 мг в те дни, когда МТ не принимается, что позволяет уменьшить частоту нежелательных реакций (НР) [11]. Перед назначением МТ следует оценить факторы риска НР: прием алкоголя, ожирение, нарушение функции печени, почек; исследовать лабораторные параметры (АСТ, АЛТ, альбумин, общий анализ крови, креатинин, глюкоза, липидный профиль), выполнить тест на беременность, оценить маркеры вирусных инфекций (ВИЧ, гепатит В/С), провести рентгенографию органов грудной клетки.
При отсутствии противопоказаний к назначению МТ после установки диагноза назначается 15 мг/нед. МТ + 5 мг/нед. фолиевой кислоты. Поскольку эффект МТ развивается обычно через 8–12 нед., на этот период к лечению добавляют НПВП с учетом факторов риска развития побочных эффектов (ПЭ) (табл. 3) [12]. При назначении НПВП следует учитывать несколько правил: назначать НПВП в наименьших, но достаточных дозах; предпочитать препараты с короткой продолжительностью жизни; при поражении ЖКТ избегать высокоселективных ингибиторов ЦОГ-1 (индометацин, пироксикам); при поражении сердечно-сосудистой системы избегать высокоселективных ингибиторов ЦОГ-2; назначать ацетилсалициловую кислоту не менее чем за 2 ч до приема НПВП.
![Таблица 3. Факторы риска побочных эффектов со стороны ЖКТ и ССС при использовании НПВП [12] Таблица 3. Факторы риска побочных эффектов со стороны ЖКТ и ССС при использовании НПВП [12]](https://www.rmj.ru/upload/medialibrary/cdb/51-5.png)
Необходимость в использовании ГК должна определяться только ревматологами; данная терапия не является рутинной в связи с большим количеством НЯ по мере нарастания кумулятивной дозы ГК. И в международных, и в национальных рекомендациях [2, 3] указывается, что используемые дозы должны быть невысокими (в дебюте лечения — обычно 7,5–10 мг/сут). В последнем систематическом обзоре с метаанализом, посвященным месту ГК и БПВП в терапии РА [13], указывается, что применение высоких доз ГК не имеет преимуществ перед низкими дозами. В настоящий момент пульс-терапия мегадозами ГК (1000 мг преднизолона в течение 3 дней внутривенно) для лечения РА практически не используется. Но и использование низких доз ГК с учетом необходимой многомесячной терапии неизбежно приводит к развитию вторичного остеопороза, профилактику которого начинают сразу после назначения ГК, к значительному увеличению частоты деструкции крупных суставов, чаще тазобедренных, что приводит к инвалидности и увеличивает частоту проведения тотального эндопротезирования, а также к развитию хорошо знакомых клиницистам осложнений стероидной терапии (сахарный диабет, катаракта, ожирение, кушингоид, нарастание частоты инфекционных заболеваний, увеличение риска развития кардиоваскулярных заболеваний и пр.) [14, 15]. ГК назначаются в начале применения БПВП и должны быть отменены так быстро, как позволяет клиническая ситуация, в идеале в течение 6 мес. Но изменение дозы ГК осуществляется только лечащим врачом, о чем необходимо предупредить больного.
Другими составляющими успешного лечения РА являются длительное контролируемое лечение, предупреждение ятрогении, обучение больных и активное вовлечение их в процесс лечения. Роль терапевта в ведении больных РА важна. Терапевт должен понимать и уметь объяснить пациенту, какова цель лечения РА, что представляют собой синтетические БПВП, цитостатики (отличие доз в ревматологии и онкологии), генно-инженерные биологические препараты (ГИБП), их достоинства и недостатки. Терапевт, как и ревматолог, контролирует переносимость терапии и течение коморбидных состояний.
Контроль эффективности терапии осуществляется каждые 3 мес., пока не будет достигнута цель лечения (ремиссия или низкая активность болезни), далее контрольное обследование проводится 1 раз в 6–12 мес. При недостаточной эффективности и переносимости (нетяжелые НР, такие как гастралгии, тошнота, диспепсия) перорального МТ целесообразно назначение парентеральной (подкожной) формы препарата [1, 2]. Биодоступность подкожной формы МТ выше, чем пероральной. Кроме того, концентрация МТ в сыворотке при приеме его per os нарастает только до недельной дозы в 15 мг, а дальнейшее увеличение дозы не приводит к значимому нарастанию концентрации препарата в сыворотке крови (рис. 3) [16].
![Рис. 3. Преимущества парентерального введения метотрексата [16] Рис. 3. Преимущества парентерального введения метотрексата [16]](https://www.rmj.ru/upload/medialibrary/d1f/51-6.png)
Неоднократно приходится сталкиваться с необоснованной отменой терапии МТ, в т. ч. врачами общей практики. Отсутствие значимого эффекта в первые 3–4 мес. не является основанием для отмены терапии — проводится коррекция дозы, перевод больного с оральной формы на парентеральную, возможна коррекция симптоматической терапии (нестероидной и стероидной). Вопрос о смене БПВП решается положительно только в том случае, когда, несмотря на применение МТ, активность заболевания нарастает, т. е. имеет место не недостаточный эффект, а отсутствие эффекта терапии МТ при приеме в максимальной терапевтической дозе (25 мг/нед.) в течение не менее 8–12 нед.
Наиболее часто необоснованная отмена МТ связана с неправильной трактовкой изменений в лабораторных показателях либо с развитием нетяжелых НР. Мониторинг переносимости МТ в начале лечения или при увеличении дозы МТ включает определение уровня АЛТ/АСТ, креатинина, проведение общего анализа крови, что необходимо повторять каждые 1–1,5 мес. до достижения стабильной дозы МТ, затем — каждые 3 мес.; клиническую оценку НР следует проводить во время каждого визита пациентов. Наиболее частые НР при терапии МТ и рекомендации по их купированию приведены в таблице 4.
![Таблица 4. Рекомендации по профилактике и лечению нежелательных реакций, связанных с приемом метотрексата [2] Таблица 4. Рекомендации по профилактике и лечению нежелательных реакций, связанных с приемом метотрексата [2]](https://www.rmj.ru/upload/medialibrary/dec/51-7.png)
Окончательная отмена МТ проводится при реакциях по типу идиосинкразии (кожные реакции, легочная инфильтрация с гипоксемией), выраженных гематологических НР или тяжелом поражении печени, что при использовании низких «ревматологических» доз МТ встречается крайне редко. Во всех остальных случаях доза МТ может корректироваться, осуществляется перерыв в лечении. Так, терапию МТ следует прервать при повышении концентрации АЛТ/АСТ >3 верхней границы нормы (ВГН) на время; возобновить лечение в более низкой дозе после нормализации лабораторных показателей. При стойком увеличении уровня АСТ/АЛТ >3 ВГН следует скорректировать дозу МТ; при сохранении увеличения уровня АСТ/АЛТ >3 ВГН после отмены МТ следует провести соответствующие диагностические процедуры. В нашей клинической практике встречались случаи необоснованной отмены МТ при выявлении каких-либо изменений в ткани печени при УЗИ, например жирового гепатоза. Врач, прерывающий лечение МТ без веских на то оснований, должен знать, что это ведет к обострению заболевания, а повторное назначение МТ может привести к ухудшению состояния больного.
Внедрение в практику клиницистов подкожной формы МТ позволило повысить эффективность терапии. По нашим данным, назначение подкожного МТ больным РА в первые 6 мес. позволяет у всех больных в течение 6–12 мес. достичь ремиссии (в ряде случаев без лекарственной ремиссии) или минимальной активности заболевания, предотвратить разрушение суставов, сохранить функциональные способности больного [17]. Также применение подкожной формы МТ позволяет в среднем на 50% уменьшить частоту развития НР со стороны ЖКТ. По данным метаанализа 7 исследований (n=1335 пациентов с РА, получавших метотрексат в дозе ≥15 мг/нед. перорально или подкожно), при подкожном введении данного препарата на 45% уменьшалась частота развития НР со стороны ЖКТ в целом (p=0,0005), а также частота тошноты и рвоты (на 47 и 57% соответственно, p=0,04 в обоих случаях) [18].
Актуальной проблемой как для пациентов, длительно получающих иммуносупрессивную терапию, так и для медицинского персонала, обеспечивающего инъекции МТ, являются удобство и безопасность инъекции. По результатам финансируемого ВОЗ исследования, проведенного в 2014 г., до 1,7 млн человек были инфицированы вирусом гепатита С, а 33 800 человек были инфицированы ВИЧ в результате небезопасных инъекций. От 10 до 51% больных РА и спондилоартропатиями являются носителями гепатита В [20]. С целью снижения риска внутрибольничных заражений, а также повышения удобства самостоятельной инъекции для пациентов с деформацией суставов кисти ВОЗ рекомендует к 2020 г. полностью перейти от приготовления растворов для инъекции к предварительно наполненным шприцам с системой автоматической защиты иглы. Наличие такой системы снижает риск заражения в результате укола по неосторожности: механизм сконструирован таким образом, что игла взаимодействует с тканями непосредственно во время инъекции, а после ее проведения мгновенно закрывается защитным колпачком [21]. Таким образом, наличие МТ в предварительно наполненных шприцах для подкожной инъекции позволяет не только улучшить эффективность, переносимость терапии и удобство для пациента, но и существенно снизить риски, ассоциированные с инъекцией.
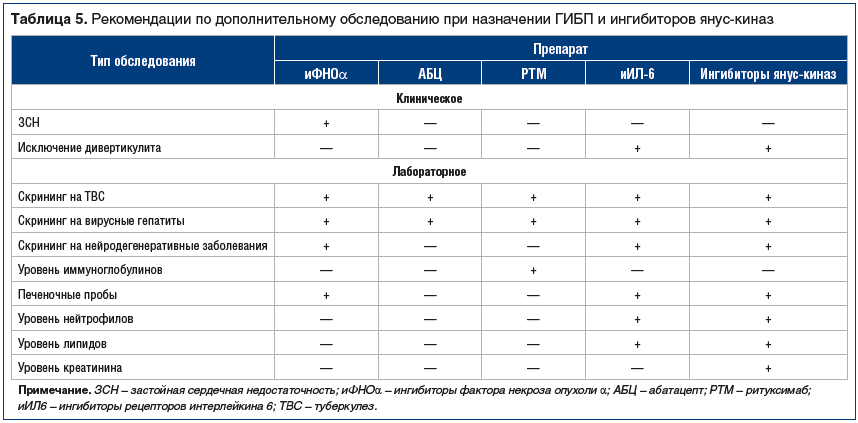
Вторым препаратом из группы БПВП является лефлуномид, который может использоваться у больных РА в случае неэффективности и/или непереносимости МТ, при условии отсутствия быстрого нарастания клинической и лабораторной активности РА, быстрого прогрессирования деструкции суставов, появления или увеличения выраженности внесуставных проявлений, высокого уровня иммунологических маркеров РА (РФ, АЦЦП). При наличии этих прогностически неблагоприятных факторов ревматологи переходят к лечению ГИБП или таргетными БПВП (ингибиторами янус-киназ). Это экономически затратные виды терапии, вызывающие различные НР, частично совпадающие с таковыми при приеме классических БПВП. В первую очередь это развитие инфекций, в т. ч. оппортунистических, хотя некоторые НР связаны с механизмом действия ГИБП или ингибиторов янус-киназ. Рекомендации по необходимому обследованию перед назначением этой терапии представлены в таблице 5. Пациенты с РА могут обращаться к терапевту со своими «неревматологическими» проблемами, например, в связи с появлением признаков застойной сердечной недостаточности или с банальной инфекцией и пр. Поэтому терапевт должен быть иметь в виду, что это может быть связано с проводимой по поводу РА терапией, и решать вопрос о ее коррекции совместно с ревматологом.
Заключение
Несмотря на то, что ведение больных РА должно осуществляться ревматологами, роль терапевта в улучшении непосредственных и отдаленных исходов этого тяжелого, потенциально инвалидизирующего заболевания очевидна. Больные с ранней клинической, а подчас и доклинической стадией РА в первую очередь обращаются к врачам общей практики. Поэтому терапевт должен быть информирован об основных симптомах ранней стадии РА для своевременного направления больного к ревматологу. Терапевт должен уметь заподозрить развитие системного воспалительного заболевания суставов, назначить адекватное обследование. Следует избегать назначения излишних лабораторных исследований, что происходит примерно в 20% случаев. Излишнее обследование не только увеличивает материальную нагрузку на систему здравоохранения и на пациента, но и может затянуть время до назначения адекватной терапии. Кроме того, возможно получение ложнопозитивных или ложнонегативных данных, что также увеличивает продолжительность диагностического поиска. Высокая частота ложноположительных результатов (гипердиагностика) обусловливает неоправданную психологическую нагрузку на пациента и назначение неадекватного лечения [19]. Терапевт должен как можно р
