Ревматоидный артрит рекомендации 2015 pdf
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
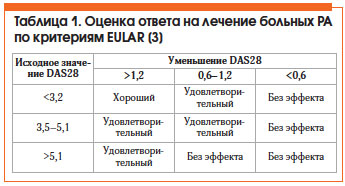
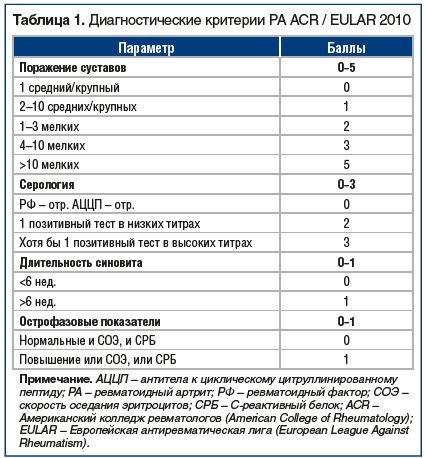
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

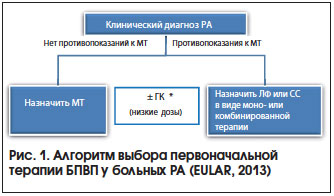
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.
II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
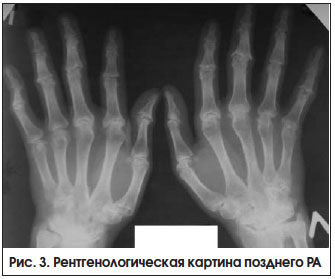
III. Пациент с поздним РА и остеопоротическими переломами
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.

Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
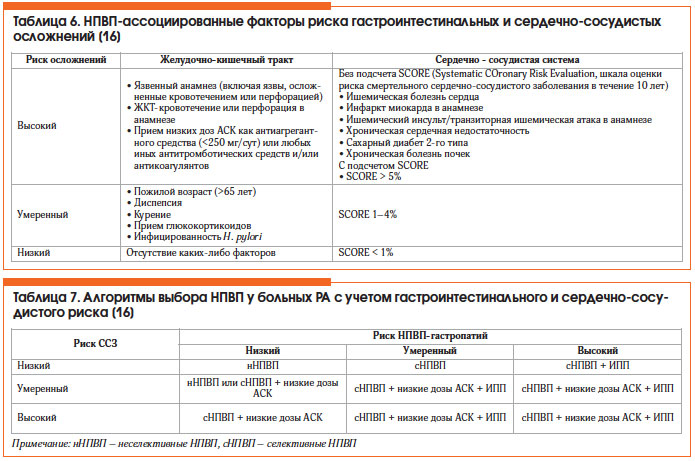
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник

Введение
Ревматоидный артрит (РА) — хроническое аутоиммунное заболевание, характеризующееся преимущественным поражением синовиальных суставов и постепенной деструкцией структур сустава. В национальных рекомендациях с 2014 г., а в европейских — с 2016 г. постулируется, что ведение больных РА должно осуществляться ревматологами [1–3]. Однако надо учитывать, что максимальный эффект противовоспалительной терапии при РА развивается на ранних стадиях заболевания. Поэтому вопрос о раннем выявлении больных с РА или с подозрением на развитие РА во многом зависит от знания врачами первичного звена симптомов, характерных для ранней стадии заболевания.
Роль терапевта в ранней диагностике и проведении адекватного лечения ревматоидного артрита
Возможности ранней диагностики ревматоидного артрита
Первый шаг к возможности установить диагноз РА как можно раньше был сделан в 2010 г., когда были опубликованы новые классификационные критерии РА [4]. Они были ориентированы на выявление РА на ранних стадиях (табл. 1). Однако диагноз РА в соответствии с этими критериями устанавливается при наличии полиартрита в сочетании с результатами лабораторных исследований. Еще в 2002 г. были предложены упрощенные критерии раннего РА, которые вошли в национальные рекомендации по ведению больных РА [2, 5]: при наличии у больного как минимум 3 воспаленных суставов определенной локализации (мелкие суставы кистей и стоп), утренней скованности и положительного теста «поперечного сжатия» (рис. 1) больного следует сразу направлять к ревматологу. В статье, описывающей данные критерии раннего РА [5], имеется несколько рекомендаций, которые могут помочь практикующим врачам. Во-первых, применение нестероидных противовоспалительных препаратов (НПВП) способно маскировать симптомы на ранней стадии заболевания, таким образом, врач может не выявить при осмотре припухлости, поэтому в сомнительных случаях возможна отмена НПВП и повторный осмотр через 2–3 дня. Конечно, больного следует предупредить, что боли могут нарастать, но задержка с установкой диагноза нанесет больному больше вреда, поскольку ведет за собой задержку с назначением необходимого лечения. Кроме того, в статье [4] четко указывается, что назначение глюкокортикоидов (ГК) до установления нозологического диагноза недопустимо.
![Рис. 1. Алгоритм ранней диагностики ревматоидного артрита на этапах оказания медицинской помощи [2, 4, 5] Рис. 1. Алгоритм ранней диагностики ревматоидного артрита на этапах оказания медицинской помощи [2, 4, 5]](https://www.rmj.ru/upload/medialibrary/d94/51-3.png)
Наиболее частые варианты дебюта РА — развитие симметричного полиартрита мелких суставов кистей и/или стоп, что сопровождается наличием утренней скованности в суставах, ухудшением общего самочувствия, иногда появлением субфебрилитета. Но РА может дебютировать с развития артрита плечевого или коленного сустава. В национальных рекомендациях по ревматологии [2] четко указано, что каждому больному с ранним артритом (любой локализации) нужно назначить лабораторное обследование, которое включает клинический анализ крови, определение уровня С-реактивного белка, ревматоидного фактора (РФ), антител к циклическому цитруллинированному пептиду (АЦЦП) или к цитруллинированному виментину (анти-MCV) и антинуклеарного фактора, и провести рентгенографию суставов кистей и стоп (в прямой проекции).
Следует ясно представлять, что РА, как и другие хронические заболевания, проходит несколько стадий эволюции — доклиническую и клиническую (рис. 2). РА может дебютировать с развития артритов или с появления только болей в суставах (артралгий). Поэтому врач первичного звена и при отсутствии артритов должен уметь заподозрить дебют РА и без промедления направить больного к ревматологу. В 2017 г. было опубликовано определение артралгий, подозрительных на развитие РА, сформулированное экспертами Европейской антиревматической лиги (EULAR) [6]:
![Рис. 2. Классификация и длительность ревматоидного артрита [4] Рис. 2. Классификация и длительность ревматоидного артрита [4]](https://www.rmj.ru/upload/medialibrary/fa8/51-4.png)
5 параметров врач выясняет при сборе анамнеза:
недавнее начало симптомов (<1 года);
локализация симптомов в мелких суставах;
длительность утренней скованности ≥60 мин;
наибольшая выраженность симптомов в утренние часы;
наличие 1 (рентгенологической) стадии относительно РА.
2 параметра выявляются при осмотре больного (это занимает менее 1 мин):
больной испытывает затруднения при сжатии кулака;
положительный тест «поперечного сжатия» суставов кисти (стоп).
Чувствительность и специфичность этих критериев приведены в таблице 2. Как следует из ее данных, выявление у пациента 4 параметров говорит о том, что у больного дебют РА (в 93,6% случаев), а 5 и более параметров — о необходимости срочного направления больного к ревматологу для верификации диагноза РА. Необходимый объем лабораторного дообследования указан выше.
![Таблица 2. Чувствительность и специфичность оценивае- мых параметров при наличии артралгий как риска РА при экспертизе клинически подозрительных артралгий [6] Таблица 2. Чувствительность и специфичность оценивае- мых параметров при наличии артралгий как риска РА при экспертизе клинически подозрительных артралгий [6]](https://www.rmj.ru/upload/medialibrary/cd5/51-2.png)
Принципы лечения ревматоидного артрита
Основные принципы лечения РА хорошо известны клиницистам. В соответствии с разработанной в настоящее время стратегией лечения РА [7] основной целью является достижение ремиссии (или низкой активности заболевания) у всех больных. Для достижения этой цели необходимо раннее назначение базисных противовоспалительных препаратов (БПВП). При раннем начале лечения (первые 3–6 мес.) у большинства пациентов возможно добиться ремиссии или течения РА с низкой активностью, что и является критерием эффективного лечения РА. Задержка с назначением БПВП приводит к уменьшению эффекта лечения. Был проведен анализ данных 14 рандомизированных контролируемых исследований, в которых оценивалась частота развития эффекта у 1435 больных (886 получали различные БПВП и 549 — плацебо) при различной длительности РА. Учитывались демографические факторы (пол, возраст), функциональные возможности больных, клинико-лабораторные параметры активности болезни (боль, число болезненных и припухших суставов, СОЭ и др.) [8]. При любой длительности РА различие в частоте развития эффекта между активным лечением и плацебо было примерно одинаково — около 30%. Но по мере увеличения длительности РА эффективность БПВП снижалась с 52% (начало терапии при длительности РА <1 года) до 35% (при длительности РА >10 лет).
Первым БПВП, который назначается больным РА, является метотрексат (МТ), который также называют якорным препаратом. Он эффективен у большинства больных РА и обладает хорошей переносимостью доз, используемых в ревматологии [9, 10]. МТ имеет ограниченные противопоказания (острая инфекция, алкоголизм, беременность). Успех лечения зависит от ряда моментов: использование оптимальных терапевтических доз — 15–25 мг/нед.; контроль за эффективностью терапии с коррекцией дозы и формы МТ при недостаточном эффекте; клинический и лабораторный контроль переносимости МТ. Следует подчеркнуть, что с учетом антифолатного действия МТ показано его применение в комбинации с фолиевой кислотой в дозе 1–2 мг в те дни, когда МТ не принимается, что позволяет уменьшить частоту нежелательных реакций (НР) [11]. Перед назначением МТ следует оценить факторы риска НР: прием алкоголя, ожирение, нарушение функции печени, почек; исследовать лабораторные параметры (АСТ, АЛТ, альбумин, общий анализ крови, креатинин, глюкоза, липидный профиль), выполнить тест на беременность, оценить маркеры вирусных инфекций (ВИЧ, гепатит В/С), провести рентгенографию органов грудной клетки.
При отсутствии противопоказаний к назначению МТ после установки диагноза назначается 15 мг/нед. МТ + 5 мг/нед. фолиевой кислоты. Поскольку эффект МТ развивается обычно через 8–12 нед., на этот период к лечению добавляют НПВП с учетом факторов риска развития побочных эффектов (ПЭ) (табл. 3) [12]. При назначении НПВП следует учитывать несколько правил: назначать НПВП в наименьших, но достаточных дозах; предпочитать препараты с короткой продолжительностью жизни; при поражении ЖКТ избегать высокоселективных ингибиторов ЦОГ-1 (индометацин, пироксикам); при поражении сердечно-сосудистой системы избегать высокоселективных ингибиторов ЦОГ-2; назначать ацетилсалициловую кислоту не менее чем за 2 ч до приема НПВП.
![Таблица 3. Факторы риска побочных эффектов со стороны ЖКТ и ССС при использовании НПВП [12] Таблица 3. Факторы риска побочных эффектов со стороны ЖКТ и ССС при использовании НПВП [12]](https://www.rmj.ru/upload/medialibrary/cdb/51-5.png)
Необходимость в использовании ГК должна определяться только ревматологами; данная терапия не является рутинной в связи с большим количеством НЯ по мере нарастания кумулятивной дозы ГК. И в международных, и в национальных рекомендациях [2, 3] указывается, что используемые дозы должны быть невысокими (в дебюте лечения — обычно 7,5–10 мг/сут). В последнем систематическом обзоре с метаанализом, посвященным месту ГК и БПВП в терапии РА [13], указывается, что применение высоких доз ГК не имеет преимуществ перед низкими дозами. В настоящий момент пульс-терапия мегадозами ГК (1000 мг преднизолона в течение 3 дней внутривенно) для лечения РА практически не используется. Но и использование низких доз ГК с учетом необходимой многомесячной терапии неизбежно приводит к развитию вторичного остеопороза, профилактику которого начинают сразу после назначения ГК, к значительному увеличению частоты деструкции крупных суставов, чаще тазобедренных, что приводит к инвалидности и увеличивает частоту проведения тотального эндопротезирования, а также к развитию хорошо знакомых клиницистам осложнений стероидной терапии (сахарный диабет, катаракта, ожирение, кушингоид, нарастание частоты инфекционных заболеваний, увеличение риска развития кардиоваскулярных заболеваний и пр.) [14, 15]. ГК назначаются в начале применения БПВП и должны быть отменены так быстро, как позволяет клиническая ситуация, в идеале в течение 6 мес. Но изменение дозы ГК осуществляется только лечащим врачом, о чем необходимо предупредить больного.
Другими составляющими успешного лечения РА являются длительное контролируемое лечение, предупреждение ятрогении, обучение больных и активное вовлечение их в процесс лечения. Роль терапевта в ведении больных РА важна. Терапевт должен понимать и уметь объяснить пациенту, какова цель лечения РА, что представляют собой синтетические БПВП, цитостатики (отличие доз в ревматологии и онкологии), генно-инженерные биологические препараты (ГИБП), их достоинства и недостатки. Терапевт, как и ревматолог, контролирует переносимость терапии и течение коморбидных состояний.
Контроль эффективности терапии осуществляется каждые 3 мес., пока не будет достигнута цель лечения (ремиссия или низкая активность болезни), далее контрольное обследование проводится 1 раз в 6–12 мес. При недостаточной эффективности и переносимости (нетяжелые НР, такие как гастралгии, тошнота, диспепсия) перорального МТ целесообразно назначение парентеральной (подкожной) формы препарата [1, 2]. Биодоступность подкожной формы МТ выше, чем пероральной. Кроме того, концентрация МТ в сыворотке при приеме его per os нарастает только до недельной дозы в 15 мг, а дальнейшее увеличение дозы не приводит к значимому нарастанию концентрации препарата в сыворотке крови (рис. 3) [16].
![Рис. 3. Преимущества парентерального введения метотрексата [16] Рис. 3. Преимущества парентерального введения метотрексата [16]](https://www.rmj.ru/upload/medialibrary/d1f/51-6.png)
Неоднократно приходится сталкиваться с необоснованной отменой терапии МТ, в т. ч. врачами общей практики. Отсутствие значимого эффекта в первые 3–4 мес. не является основанием для отмены терапии — проводится коррекция дозы, перевод больного с оральной формы на парентеральную, возможна коррекция симптоматической терапии (нестероидной и стероидной). Вопрос о смене БПВП решается положительно только в том случае, когда, несмотря на применение МТ, активность заболевания нарастает, т. е. имеет место не недостаточный эффект, а отсутствие эффекта терапии МТ при приеме в максимальной терапевтической дозе (25 мг/нед.) в течение не менее 8–12 нед.
Наиболее часто необоснованная отмена МТ связана с неправильной трактовкой изменений в лабораторных показателях либо с развитием нетяжелых НР. Мониторинг переносимости МТ в начале лечения или при увеличении дозы МТ включает определение уровня АЛТ/АСТ, креатинина, проведение общего анализа крови, что необходимо повторять каждые 1–1,5 мес. до достижения стабильной дозы МТ, затем — каждые 3 мес.; клиническую оценку НР следует проводить во время каждого визита пациентов. Наиболее частые НР при терапии МТ и рекомендации по их купированию приведены в таблице 4.
![Таблица 4. Рекомендации по профилактике и лечению нежелательных реакций, связанных с приемом метотрексата [2] Таблица 4. Рекомендации по профилактике и лечению нежелательных реакций, связанных с приемом метотрексата [2]](https://www.rmj.ru/upload/medialibrary/dec/51-7.png)
Окончательная отмена МТ проводится при реакциях по типу идиосинкразии (кожные реакции, легочная инфильтрация с гипоксемией), выраженных гематологических НР или тяжелом поражении печени, что при использовании низких «ревматологических» доз МТ встречается крайне редко. Во всех остальных случаях доза МТ может корректироваться, осуществляется перерыв в лечении. Так, терапию МТ следует прервать при повышении концентрации АЛТ/АСТ >3 верхней границы нормы (ВГН) на время; возобновить лечение в более низкой дозе после нормализации лабораторных показателей. При стойком увеличении уровня АСТ/АЛТ >3 ВГН следует скорректировать дозу МТ; при сохранении увеличения уровня АСТ/АЛТ >3 ВГН после отмены МТ следует провести соответствующие диагностические процедуры. В нашей клинической практике встречались случаи необоснованной отмены МТ при выявлении каких-либо изменений в ткани печени при УЗИ, например жирового гепатоза. Врач, прерывающий лечение МТ без веских на то оснований, должен знать, что это ведет к обострению заболевания, а повторное назначение МТ может привести к ухудшению состояния больного.
Внедрение в практику клиницистов подкожной формы МТ позволило повысить эффективность терапии. По нашим данным, назначение подкожного МТ больным РА в первые 6 мес. позволяет у всех больных в течение 6–12 мес. достичь ремиссии (в ряде случаев без лекарственной ремиссии) или минимальной активности заболевания, предотвратить разрушение суставов, сохранить функциональные способности больного [17]. Также применение подкожной формы МТ позволяет в среднем на 50% уменьшить частоту развития НР со стороны ЖКТ. По данным метаанализа 7 исследований (n=1335 пациентов с РА, получавших метотрексат в дозе ≥15 мг/нед. перорально или подкожно), при подкожном введении данного препарата на 45% уменьшалась частота развития НР со стороны ЖКТ в целом (p=0,0005), а также частота тошноты и рвоты (на 47 и 57% соответственно, p=0,04 в обоих случаях) [18].
Актуальной проблемой как для пациентов, длительно получающих иммуносупрессивную терапию, так и для медицинского персонала, обеспечивающего инъекции МТ, являются удобство и безопасность инъекции. По результатам финансируемого ВОЗ исследования, проведенного в 2014 г., до 1,7 млн человек были инфицированы вирусом гепатита С, а 33 800 человек были инфицированы ВИЧ в результате небезопасных инъекций. От 10 до 51% больных РА и спондилоартропатиями являются носителями гепатита В [20]. С целью снижения риска внутрибольничных заражений, а также повышения удобства самостоятельной инъекции для пациентов с деформацией суставов кисти ВОЗ рекомендует к 2020 г. полностью перейти от приготовления растворов для инъекции к предварительно наполненным шприцам с системой автоматической защиты иглы. Наличие такой системы снижает риск заражения в результате укола по неосторожности: механизм сконструирован таким образом, что игла взаимодействует с тканями непосредственно во время инъекции, а после ее проведения мгновенно закрывается защитным колпачком [21]. Таким образом, наличие МТ в предварительно наполненных шприцах для подкожной инъекции позволяет не только улучшить эффективность, переносимость терапии и удобство для пациента, но и существенно снизить риски, ассоциированные с инъекцией.
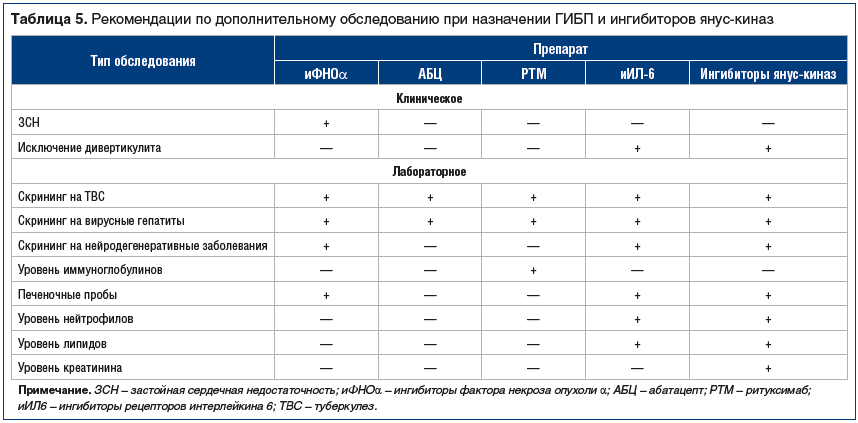
Вторым препаратом из группы БПВП является лефлуномид, который может использоваться у больных РА в случае неэффективности и/или непереносимости МТ, при условии отсутствия быстрого нарастания клинической и лабораторной активности РА, быстрого прогрессирования деструкции суставов, появления или увеличения выраженности внесуставных проявлений, высокого уровня иммунологических маркеров РА (РФ, АЦЦП). При наличии этих прогностически неблагоприятных факторов ревматологи переходят к лечению ГИБП или таргетными БПВП (ингибиторами янус-киназ). Это экономически затратные виды терапии, вызывающие различные НР, частично совпадающие с таковыми при приеме классических БПВП. В первую очередь это развитие инфекций, в т. ч. оппортунистических, хотя некоторые НР связаны с механизмом действия ГИБП или ингибиторов янус-киназ. Рекомендации по необходимому обследованию перед назначением этой терапии представлены в таблице 5. Пациенты с РА могут обращаться к терапевту со своими «неревматологическими» проблемами, например, в связи с появлением признаков застойной сердечной недостаточности или с банальной инфекцией и пр. Поэтому терапевт должен быть иметь в виду, что это может быть связано с проводимой по поводу РА терапией, и решать вопрос о ее коррекции совместно с ревматологом.
Заключение
Несмотря на то, что ведение больных РА должно осуществляться ревматологами, роль терапевта в улучшении непосредственных и отдаленных исходов этого тяжелого, потенциально инвалидизирующего заболевания очевидна. Больные с ранней клинической, а подчас и доклинической стадией РА в первую очередь обращаются к врачам общей практики. Поэтому терапевт должен быть информирован об основных симптомах ранней стадии РА для своевременного направления больного к ревматологу. Терапевт должен уметь заподозрить развитие системного воспалительного заболевания суставов, назначить адекватное обследование. Следует избегать назначения излишних лабораторных исследований, что происходит примерно в 20% случаев. Излишнее обследование не только увел
