Сирдалуд при артрозе тазобедренного сустава
Немного фактов
Сирдалуд — миорелаксант из группы антагонистов альфа2-адренорецепторов, обладающий противоспазматическими свойствами. Оказывает действие на нейронные сети восходящего тракта спинного мозга. Угнетает полисинаптические рефлексы, за счет чего уменьшается выраженность спастических болей и клонических судорог.
Нозологическая классификация болезней (МКБ-10)
Миорелаксант центрального действия применяется в терапии заболеваний, вызванных патологическими нейрофизиологическими реакциями:
- G35 — хроническое аутоиммунное заболевание, сопровождающееся поражением головного и спинного мозга (рассеянный склероз);
- G80 — патологии ЦНС, вызванные повреждением тканей одного или нескольких отделов головного мозга (детский церебральный паралич);
- G95.9 — дегенеративные процессы в спинном мозге неуточненной этиологии (миелопатия);
- I69 — осложнения цереброваскулярных патологий;
- M16 — остеоартроз тазобедренных суставов;
- M42 — дегенеративные изменения в суставах позвоночного столба (остеохондроз);
- M54.1 — корешковый синдром;
- M54.3 — компрессия или воспаление седалищного нерва;
- M54.4 — прострелы в пояснице, спровоцированные поражением седалищного нерва;
- R25.2 — приступообразное сокращение мышц.
Форма производства и лекарственный состав
Сирдалуд выпускается в виде плоских цилиндрических таблеток со скошенным краем, на одной из сторон которых вытеснена надпись «OZ» или «RL». Лекарственный состав представлен следующими компонентами:
- тизанидин (2 мг или 4 мг);
- полисорб;
- октадекановая кислота;
- МКЦ;
- молочный сахар.
Белые таблетки упаковываются в ячейковые блистеры по 10 штук. В бело-голубой коробке содержится 30 таблеток вместе с инструкцией по применению миорелаксанта.
Фармакологическое действие
Тизанидин относится к антагонистам альфа2-адренорецепторов, снижающим тонус мышечных волокон скелетной мускулатуры. Ключевым местом воздействия Сирдалуда является спинной мозг. Его компоненты препятствуют высвобождению аминокислот, которые влияют на активность NMDA-рецепторов. Угнетение полисинаптических путей передачи импульсов на уровне межнейронных связей приводит к снижению напряжения в мышцах и, как результат, устранению симптомов гипертонуса мышечных волокон.
Миорелаксант обладает выраженным обезболивающим действием. Его используют для купирования сильных болей при развитии острых или вялотекущих спастических патологий спинальной или церебральной этиологии. При применении таблеток уменьшаются клонические спазмы, а также частота возникновения судорог.
Фармакокинетические свойства
Сирдалуд всасывается в плазму крови через тонкий кишечник. Пик сывороточной концентрации тизанидина наблюдается через 50-60 минут после приема таблеток. Более 34% лекарственных компонентов метаболизируются в печени. Половая принадлежность никак не сказывается на фармакокинетических свойствах антагониста альфа2-адренорецепторов.
Период полувыведения лекарственных продуктов распада составляет в среднем 3 часа. Не менее 70% метаболитов элиминируются почками, оставшаяся часть выводится желчью вместе с каловыми массами в неизменном виде. При нарушении клубочковой фильтрации средний плазменный уровень тизанидина повышается в 2 раза. У больных с недостаточностью почек период полувыведения метаболитов препарата увеличивается до 11-14 часов.
Показания к применению
Антиспастическое средство применяется в паллиативной терапии болевого синдрома, спровоцированного функциональным или органическим поражением нейронных сеток в головном или спинном мозге. Показаниями к назначению миорелаксанта считаются:
- остеохондроз позвоночника;
- хроническая миелопатия;
- клонические судороги;
- мышечные спазмы в послеоперационном периоде;
- судороги на фоне детского церебрального паралича;
- спазмы мышц при нарушении мозгового кровообращения.
Таблетки Сирдалуд могут использоваться для облегчения состояния больных при опийной наркомании и алкоголизме. Тизанидин нормализует тонус скелетной мускулатуры, благодаря чему снижается вероятность появления мышечных спазмов и судорог.
Дозировочный режим
Миорелаксирующее средство имеет узкий фармакотерапевтический диапазон, но достаточно высокую вариабельность плазменной концентрации тизанидина у пациентов разных категорий. В связи с этим терапию начинают с приема не более 2 мг препарата в день. По мере изменения дозировочного режима определяется оптимальная терапевтическая доза Сирдалуда.
Дозировка во многом зависит от формы заболевания и характера патологических нейрофизиологических реакций:
- мышечные спазмы — до 4 мг три раза в сутки;
- миелопатия — до 8 мг три раза в сутки;
- судороги на фоне неврологических нарушений — по 2 мг три раза сутки на протяжении 3-7 дней, затем — по 6-8 мг три-четыре раза в сутки.
Суточная доза антиспастического лекарства не может превышать 36 мг. Несоблюдение рекомендаций чревато передозировкой и возникновением нежелательных эффектов со стороны ЦНС, ЖКТ и других систем.
Особые указания
Опыт применения противоспазматического препарата в терапии детей и подростков ограничен. В связи с риском обострения побочных эффектов таблетки не используют в педиатрии. При наличии строгих показаний, таких как клонические судороги при ДЦП, лечение проводят в стационаре под наблюдением медперсонала.
Больным после 65 лет с осторожностью назначают миорелаксант из-за возможного нарушения функций почек. Фармакотерапию начинают с 2 мг тизанидина в день, повышая дозу с периодичностью в 5-7 дней.

При тяжелой недостаточности печени Сирдалуд не используют, т.к. большая часть его компонентов расщепляется и инактивируется в паренхиме. С осторожностью нужно использовать миорелаксант при умеренном повреждении тканей печени. Быстрое увеличение дозы тизанидина чревато развитием интоксикации.
Если скорость гломерулярной фильтрации не превышает 25 мл в минуту, стартовая доза противоспазматических таблеток составит 2 мг. Дозировку увеличивают постепенно до тех пор, пока не будет достигнуто оптимальное соотношение терапевтической дозы и нормальной переносимости препарата.
Гестация и лактация
Испытания на крысах и кроликах не выявили тератогенной активности лекарства. Но Сирдалуд не применялся в контролируемых исследованиях при лечении пациенток в период гестации и кормления грудью. В связи с этим миорелаксант не рекомендуется использовать во время беременности при отсутствии серьезных показаний.
Эксперименты на млекопитающих доказали, что примерно 20% лекарственных метаболитов экскретируются с грудным молоком. Поэтому при приеме таблеток во время лактации рекомендуется перевести младенца на искусственное вскармливание.
Совместимость с алкоголем
Алкоголь потенцирует седативно-снотворную активность таблеток, поэтому комбинировать их с этанол содержащими напитками нежелательно.
Взаимодействие с медикаментами
Лекарство не сочетают с приемом ингибиторов CYP1A2 по причине повышения сывороточной концентрации тизанидина. Увеличение уровня активных компонентов в кровотоке чревато передозировкой и возникновением нежелательных эффектов, а также увеличением периода их полувыведения.

Из-за возможного развития брадикардии, аритмии и других осложнений не рекомендуется сочетать миорелаксант с:
- индукторами CYP1A2;
- антигистаминными лекарствами;
- оральными контрацептивами;
- противоаритмическими таблетками;
- фторхинолоновыми антибиотиками;
- антигипертензивными средствами;
- антипсихотиками.
Сочетанный прием антагониста альфа2-адренорецепторов с медикаментами центрального действия и наркотическими анальгетиками чреват усилением седативного действия. В связи с высокой вероятностью возникновения аддиктивного антигипертензивного эффекта, запрещается комбинировать таблетки с другими антагонистами адренорецепторов.
Передозировка
В случае приема более 40 мг тизанидина у пациентов развивается передозировка, проявлениями которой могут стать:
- респираторный дистресс;
- снижение АД;
- тошнота;
- рвотные позывы;
- сонливость;
- тревожность;
- брадикардия;
- паралитический миоз;
- головокружение.
Для скорейшего выведения лекарственных веществ из организма рекомендуется принять активированный уголь. При ухудшении самочувствия показан форсированный диурез.
Побочные эффекты
В большинстве случаев Сирдалуд не вызывает побочных реакций. Патологическая симптоматика проявляется в случае передозировки и при гиперчувствительности к компонентам миорелаксанта:
- расстройства стула;
- головокружение;
- гипотензия;
- быстрая утомляемость;
- сонливость;
- обезвоживание слизистой рта;
- рвота.

При комбинировании таблеток с наркотическими анальгетиками и ингибиторами CYP1A2 у некоторых больных диагностировали брадикардию, гепатит и галлюцинации. Появление вышеперечисленных эффектов является основанием для отказа от терапии.
Противопоказания к применению
Не следует принимать противоспазматические таблетки при:
- гиперчувствительности к тизанидину;
- тяжелой недостаточности почек;
- беременности и лактации;
- язвенной болезни желудка.
Лекарство не назначают, если скорость клубочковой фильтрации не превышает 20 мл в минуту, т.к. при тяжелой почечной недостаточности риск передозировки увеличивается на 55%.
Аналоги
Заменить Сирдалуд можно миорелаксантами из той же фармакологической группы:
- Занафлекс;
- Тизанидин-Ратиофарм;
- Миоластан;
- Тизанил-Тева;
- Муксомед;
- Тизалуд.

Условия продажи и хранения
Противоспазматический медпрепарат продается только по рецепту. Таблетки хранятся в оригинальной упаковке в проветриваемом месте при комнатной температуре не более 5 лет.
Цены на Сирдалуд и способы доставки в Москве и других городах России

Заберите заказ в ближайшем пункте выдачи или в аптеке WER (г. Москва)
Цена: от 231 руб.
Источник
В настоящее время проблема медицинской и социальной реабилитации пациентов с двигательными нарушениями, возникающими вследствие широкого спектра воспалительных и дегенеративно-дистрофических поражений суставов и позвоночника стала особенно актуальной.
Несмотря на то, что человечество страдало этими заболеваниями во все времена, на современном этапе развития общества в связи с урбанизацией, низкой двигательной активностью, изменением режима и качества питания, а также глобальным ухудшением экологических условий окружающей среды, различные нарушения функциональной активности опорно-двигательного аппарата большей или меньшей степени выраженности наблюдаются практически у 80% населения Земли.
Кардинальными клиническими признаками данной группы заболеваний являются боль, нарушения мышечного тонуса, что в большинстве случаев выражается существенной утренней скованностью, и ограничение объема движений, приводящие к временной или стойкой потере трудоспособности и сокращению продолжительности жизни.
По данным международных исследований, широкомасштабный опрос жителей некоторых европейских стран, в том числе России, и ряда штатов Северной Америки показал, что патологические симптомы, связанные с болью в шее, плечелопаточной области, пояснице и конечностях, хотя бы раз в жизни отмечали примерно 58-81% опрошенных, а приблизительно 25-42% отмечали их в течение последнего месяца до опроса.
Данные четырехлетних наблюдений показали, что, например, в Великобритании вследствие ревматических болей было потеряно 52 млн. рабочих дней, что уступает только заболеваниям органов кровообращения и дыхания, а штату Калифорния ежегодные потери трудоспособности в случаях заболеваний артритами (в том числе анкилозирующим спондилитом) обходятся в 200 млн. долларов.
Таким образом, данная проблема имеет огромное не только медицинское, но и социально-экономическое значение.
В настоящее время уже не вызывает сомнения, что возникновение боли при ревматических заболеваниях в большинстве случаев обусловлено наличием воспалительного процесса непосредственно в структурах сустава, окружающих его мягких тканях, а также прогрессирующей деструкцией суставного хряща и возникающего мышечного спазма.
Таким образом, боль в суставах и позвоночнике имеет полимодальную природу, включающую как периферический, так и центральный компоненты. Доказано, что при одном и том же заболевании в развитии боли могут принимать участие различные механизмы, а при разных заболеваниях — общие механизмы.
Лучше всего изучен периферический механизм боли, связанный с активацией неинкапсулированных нервных окончаний (ноцицепторов) «провоспалительными» медиаторами (цитокины, простагландины, оксид азота и др.), синтез которых определяет характерную для артритов корреляцию между интенсивностью болей и воспалением.
При дегенеративных заболеваниях суставов и позвоночника боль может быть также связана не только с «биомеханическими» факторами, но и с локальным воспалением. При остеоартрозе о наличии «воспалительного» компонента свидетельствует внезапное усиление болей в отсутствие провоцирующих факторов, «ночные» боли, скованность в суставах (ощущение «геля»), припухание суставов.
Некоторые авторы полагают, что именно наличие воспалительного компонента при остеоартрозе лежит в основе выраженного анальгетического эффекта локальных глюкокортикоидов, которые не влияют на боль в отсутствие воспаления.
Однако следует иметь в виду, что нередко интенсивность боли не соответствует клиническим и лабораторным признакам выраженности воспалительных и дегенеративных изменений и во многом зависит от степени выраженности мышечного спазма. Данный фактор очень важен для практического врача в связи с выбором адекватной тактики лечения.
Разнообразие механизмов боли особенно хорошо видно на примере остеоартроза крупных суставов и остеохондроза позвоночника, при которох боль может зависеть от многих причин, как воспалительной, так и невоспалительной природы.
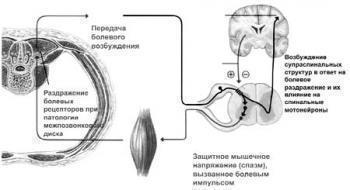
Доказано, что физиологическая напряженность мышц, которая следует за любой болью, заключается в иммобилизации пораженного участка тела и создании мышечного корсета.
Однако сам мышечный спазм приводит к стимуляции болевых рецепторов мышцы. Таким образом, возникает порочный круг по механизму самовоспроизведения: боль — мышечный спазм — усиленная боль — болезненный мышечный спазм.
Предположительно в мышце формируются триггерные точки, содержащие множественные локусы сенситизации, состоящие из одного или нескольких сенситизированных нервных окончаний.
Таким образом, все вышеизложенное дает основание утверждать, что врач в своей ежедневной практике чаще всего имеет дело с болезненным мышечным спазмом при болях в спине или конечностях в рамках воспалительных и дегенеративно-дистрофических поражений позвоночника и суставов, т.е рефлекторными мышечно-тоническими или миофасциальными синдромами.
Многочисленными клиническими исследованиями доказано, что источником болевой импульсации, например, при разного рода поражениях позвоночника, как правило, служит раздражение болевых рецепторов фиброзного кольца межпозвонкового диска и сухожильно-связочного аппарата межпозвонковых суставов.
Ноцицептивная импульсация пораженного двигательного сегмента активизирует мотонейроны передних рогов спинного мозга, что приводит к спазму мышц, иннервируемых данным сегментом спинного мозга.
При мышечном спазме происходит стимуляция ноцицепторов самой мышцы. В спазмированных мышцах развиваются очаги локальной ишемии, что вызывает вазомоторные и дистрофические изменения в тканях, еще более усиливая активацию ноцицепторов мышечного волокна.
Таким образом, спазмированная мышца становится источником дополнительной болевой импульсации, что увеличивает активность передних рогов спинного мозга, которая приводит к еще большему спазму мышц. При этом в процесс могут вовлекаться практически все мышцы — как паравертебральные, так и экстравертебральные.
Рефлекторное напряжение мышц изначально, как правило, носит защитный характер, поскольку приводит к иммобилизации пораженного сегмента, однако в дальнейшем этот фактор становится причиной хронического болевого синдрома и может привести к патологической деформации позвоночника.
В схеме, разработанной В.А. Парфеновым, с нашей точки зрения, наиболее точно определена роль мышечного спазма при болях в спине (рис. 1).
Учитывая сложную природу болей при ревматических заболеваниях, для их подавления используются разнообразные лекарственные средства.
В настоящее время довольно часто со страниц солидных медицинских журналов и трибун научно-практических конференций можно услышать, что клиницисты и фармакологи, опираясь на достижения фундаментальной науки, создают новые лекарственные средства с механизмом действия, направленным на определенные звенья формирования и развития патологических процессов.
Поскольку процесс воспаления является ведущим механизм «ревматических» болей, патогенетически особенно хорошо обосновано применение нестероидных противовоспалительных препаратов (НПВП).
Эти препараты, хотя и уступают «простым» анальгетикам (парацетамол) по безопасности, но превосходят их по анальгетической активности. Не удивительно, что более двух третей пациентов, страдающих остеоартрозом и ревматоидным артритом, предпочитают принимать НПВП, несмотря на осведомленность о побочных эффектах последних.
Еще одной из основных задач терапии широкого спектра воспалительных и дегенеративно-дистрофических поражений опорно-двигательного аппарата с проявлениями мышечно-тонического синдрома является быстрое и эффективное купирование боли и связанного с ней мышечного спазма, что в значительной мере уменьшает вероятность хронизации патологического процесса и улучшает общий прогноз.
В данном случае, с нашей точки зрения, особого внимания заслуживают миореалаксанты центрального действия.
По мнению большинства исследователей, одним из наиболее эффективных и безопасных представителей этой группы препаратов является Сирдалуд. Международное непатентованное название — тизанидин. Производитель препарата — фармацевтическая компания «Новартис Фарма АГ» (Базель, Швейцария).
Сирдалуд относится к производным имидазолина, являясь селективным a2-агонистом, тем самым проявляет избирательное действие в отношении мышечного тонуса. Миорелаксирующий эффект препарата связывают с его влиянием на a2-адренорецепторы в головном и спинном мозге.
Сирдалуд снижает высвобождение возбуждающих нейромедиаторов, в первую очередь норадреналина и аспартата на уровне «синего пятна — locus ceruleus», таким образом уменьшая их воздействие на рецепторы, что соответственно приводит к снижению возбудимости a- и g-мотонейронов в спинном мозге.
Препарат преимущественно угнетает полисинаптические спинальные рефлексы, отвечающие за гипертонус мышц, и вызывает снижение тонуса сгибательной и разгибательной мускулатуры, тем самым уменьшая болезненный мышечный спазм.
В последние годы было показано что, помимо a2-адренорецепторов, Сирдалуд влияет и на имидазолиновые рецепторы. Некоторые авторы предполагают, что ингибирующее влияние тизанидина на спинальные рефлексы на супраспинальном уровне может быть обусловлено его влиянием на имидазолиновые рецепторы, а на спинальном уровне — как на имидазолиновые, так и на a2-адренорецепторы.
Также доказано, что Сирдалуд ингибирует высвобождение субстанции P из небольших сенсорных афферентных нервных волокон и замедляет проведение возбуждения по нисходящим подкорково-спинальным путям.
Клинические исследования, проведенные а странах Западной Европы, в большинстве своем показали, что Сирдалуд оказывает антиспастическое действие при хронических спастических состояниях спинального и церебрального происхождения, устраняет острые болезненные мышечные спазмы и клонические судороги, снижает сопротивление мышц в отношении пассивных движений и повышает силу произвольных мышечных сокращений.
За последнее время получены данные о высокой эффективности комплексного применения Сирдалуда и диклофенака (Вольтарен) в лечении больных ревматологического профиля.
Причем в ходе проведения этих исследований у пациентов, получающих данное комбинированное лечение, значительно быстрее наблюдалось уменьшение интенсивности и/или полное прекращение болей и улучшение общего состояния, а также достоверно снижалась выраженность диспептических явлений и вероятность возникновения желудочно-кишечных кровотечений в сравнении с пациентами, принимающими диклофенак в качестве монотерапии.
Поскольку неоднократно доказано, что Сирдалуд не только усиливает эффективность НПВП, но и уменьшает побочные эффекты этих препаратов со стороны желудочно-кишечного тракта, в настоящее время он считается наиболее предпочтительным миорелаксантом для комбинированной терапии с НПВП.
Заслуживают внимания результаты анализа клинических исследований, проведенных за последние десятилетие в ведущих научно-исследовательских институтах РФ, которые показали эффективность применения Сирдалуда у пациентов с острыми болями в спине и конечностях, возникшими вследствие спортивной и бытовой травмы с явлениями хронического болевого мышечно-тонического синдрома.
Весьма успешным явилось применение Сирдалуда у пациентов с клиническими проявлениями головных болей напряжения с характерным для них спазмом и напряжением перикраниальных мышц.
После месячного курса терапии Сирдалудом улучшение состояния отмечалось у 90% больных. Причем в этом случае необходимо отметить значительный регресс психо-невротических и вегетативных нарушений у большинства наблюдаемых больных — в виде уменьшения тревожно-депрессивных проявлений и нормализации ночного сна.
Необходимо отметить, что большинство авторов отмечают хорошую переносимость и безопасность применения тизанидина у пациентов как среднего, так и особенно пожилого возраста, имеющих в анамнезе наличие сопутствующей хронической патологии. Клинически доказано, что побочные эффекты на фоне приема обычно назначаемых доз Сирдалуда (до 12 мг в сутки) были минимальны и чаще выражались в виде незначительной сонливости, общей слабости, снижении АД, сухости слизистых полости рта, что чаще всего прекращалось через 1-2 часа после приема препарата.
В целом клиницистами в большинстве случаев отмечалась хорошая переносимость препарата у большинства пациентов, причем независимо от длительности терапевтического курса.
Нами также была произведена оценка эффективности Сирдалуда у больных с дорсопатиями.
Под наблюдением находилось 40 пациентов (19 мужчин и 21 женщина) в возрасте от 38 до 62 лет. Критериями включения в исследование были: наличие острой боли в пояснично-крестцовой области. Длительность болевого синдрома в среднем составляла 3 дня до момента обращения пациентов за врачебной помощью.
После проведенного первичного осмотра и обследования было выявлено, что у 32 (80%) пациентов данный эпизод заболевания являлся обострением хронического процесса, у 8 (20%) пациентов болевой синдром данной локализации отмечался впервые.
Всем больным в качестве монотерапии был назначен Сирдалуд. Начальная доза составила 2 мг/сут. на ночь. Максимальня доза составила 4 мг 3 раза в сутки.
Клиническое наблюдение пациентов продолжалось 14 дней. Контрольное обследование с оценкой эффективности проводилось через 3,7 дней и после завершения терапевтического курса. Результат лечения оценивался как хороший, удовлетворительный и неудовлетворительный
При первом контрольном исследовании (3-й день) уменьшение выраженности болевого синдрома, улучшение общего самочувствия и повышение психоэмоционального статуса выявлено у 28 (70%) пациентов. 7 (17,5%) отмечали незначительную положительную динамику в общем самочувствии и состоянии двигательной активности. Отсутствие положительной динамики показателей наблюдалось у 5 (12,5%) пациентов пожилого и старческого возраста с давностью заболевания 10 и более лет.
Проведение второго контрольного обследования (7 день) показало у 34 (85%) больных значительное улучшение самочувствия и общего состояния в виде полного исчезновения болевых ощущений и чувства напряжения и скованности паравертебральных мышц и восстановление двигательной активности. 4 (10%) больных отмечали уменьшение интенсивности болей и скованности движений в пояснично-крестцовой области. У 2 (5%) пациентов каких-либо изменений общего состояния не было выявлено, но незначительно улучшилось самочувствие.
Все 38 (95%) пациентов с хорошими и удовлетворительными результатами лечения отмечали улучшение самочувствия, физической активности и фонового настроения.
Заключительное контрольное обследование (14 день) у 38 (95%) пациентов констатировало стойкое восстановление физической активности, трудоспособности и полное отсутствие негативных субъективных ощущений.
У 2 (5%) пациентов при обследовании отмечено существенное улучшение общего самочувствия, однако в связи с фоновыми нагрузками периодически возникали эпизоды болевых ощущений в пояснично-крестцовой области, но значительно меньшей интенсивности, чем до и на начальных этапах лечения. Оценка результатов лечения представлена в таблице 1.
Все обследуемые пациенты на момент заключительного контрольного обследования отмечали повышение двигательной активности, работоспособности и повышение психоэмоционального статуса, что, естественно, позитивно влияло на качество жизни пациентов в целом.
Необходимо отметить, что незначительные негативные ощущения (сухость во рту, сонливость), вызванные приемом Сирдалуда, отмечали только 7 пациентов. Данные нежелательные прявления наблюдались в начале терапевтического курса, не оказывали существенного влияния на обычный режим жизни пациентов и соответственно не явились поводом для отмены препарата. Таким образом, можно с уверенностью сказать, что на сегодняшний день Сирдалуд является препаратом выбора в лечении рефлекторных болевых синдромов, развившихся вследствие воспалительных и дегенеративно-дистрофических заболеваний, одним из основных клинических признаков которых является синдром спастичности.
В этой связи определяющим моментом является такая его отличительная особенность, как оптимальное сочетание миорелаксирующего и анальгетического эффектов, при котором уменьшение выраженности боли обусловлено не только целенаправленным расслаблением мышц, но и непосредственным центральным анальгетическим действием.
В заключение считаем необходимым отметить,что Сирдалуд показан для лечения больных ревматологического и неврологического профилей как в качестве монотерапии, так и в виде комбинации с НПВП, принимая во внимание, что в данном сочетании Сирдалуд значительно уменьшает частоту вызываемых НПВП желудочно-кишечных побочных эффектов.
Следует отметить хорошую переносимость Сирдалуда больными и минимальное число побочных реакций на фоне его применения. Все вышеизложенное дает основание предполагать, что данный препарат займет достойное место в практике врачей широкого терапевтического профиля — ревматологов, неврологов и травматологов-ортопедов.
Литература
1. Торопцова Н.В., Беневоленская Л.И., Карякин А.Н., Сергеев И.Л. Клиническая ревматология. 1995, 5, 26-29.
2. Клинические рекомендации для практических врачей, основанные на доказательной медицине.,- Изд. Дом ГЭОТАР-МЕД.-2001 -С. 606-611.
3. Воробейчик Я.М., Кукушкин М.Л., Решетняк В.К., Овечкин А.М., Гнездилов А.В. Лечение фантомно-болевого синдрома тизанидином. Журн. неврол. и псих. им. С.С.Корсакова. 1997; 3: 36-9.
4. Филатова Е.Г., Соловьeва А.Д., Данилов А.В. Лечение ГБН сирдалудом. Журн. неврол. и псих. им. С.С.Корсакова. 1997; 11: 36-8.
5. Вознесенская Т.Г., Вейн А.М. Головная боль напряжения. Conslium Medicum 1999; 1
6. Jain NK, Kulkarni SK, Singh A. Modulation of NSAID-induced antinociceptive and anti-inflammatory effects by alpha2-adrenoceptor agonists with gastroprotective effects. Life Sci 2002 May 3; 70 (24): 2857-69.
7. Berry H, Hutchinson DR. Tizanidine and ibuprofen in acute low-back pain: results of a double-blind multicentre study in general practice. J Int Med Res 1987.
8. Sirdalud Ternelin Asia-Pacific Study Group. Effecacy and gustroprotective effects of tizanidine plus diclofenac versus placebo plus diclofenac in patients with painful muscle spasms. Curr Ther Re 1998; 59 (1): 13-22.
9. Wallace JD. Summary of combined clinical analysis of controlled clinical trials with tizanidine. Neurology 1994; 44 (suppl. 9): S60-9.
10. Gelber DA, Good DC, Dromerick A et al. Open-Label Dose-Titration Safety and Efficacy Study of Tizanidine Hydrochloride in the Treatment of Spasticity Associated With Chronic Stroke. Stroke 2001; 32: 1841.
Источник
