Статьи по реактивным артритом
Термин «реактивный артрит», как нозологическая форма, впервые была предложена в 1969 году финскими исследователями P. Ahvonen, K. Sievers и K. Aho, описавшими артрит при энтероколите иерсиниозной этиологии [5]. При этом подразумевалось, что реактивные артриты (РеА) — это «стерильные» воспалительные заболевания суставов, при которых в синовиальной жидкости и синовиальной оболочке больных отсутствуют инфекционные агенты и их антигены.
Вместе с тем уже в 70-80-х годах XX века в биоптатах синовиальной оболочки методами световой и электронной микроскопии с применением иммуноцитохимии были обнаружены микроскопические внутриклеточные включения Chlamidia trachomatis, впоследствии признанной наиболее значимым артритогенным микроорганизмом при РеА [11]. С внедрением в клиническую практику в начале 90-х годов метода обратной транскриптазо-полимеразной цепной реакции (ОТ-ПЦР) в полости сустава были обнаружены небольшие количества ДНК и РНК Ch.trachomatis. Наличие этих нуклеиновых кислот, которые имеют очень непродолжительное время жизни в тканях (несколько минут), свидетельствовало о возможности транскрипции и, следовательно, активного размножения бактерий в полости сустава [12].
Позднее было обнаружено, что сустав и в норме не является стерильной средой [23]. Так, ДНК различных микроорганизмов была обнаружена в биоптатах синовиальной оболочки здоровых людей и больных остеоартрозом (у 9 и 20% соответственно).
Активно изучаются генетические факторы в патогенезе РеА. В частности, доказана тесная ассоциация заболевания с антигеном HLA-B27. Существует несколько точек зрения о его роли в развитии РеА. Согласно одной из них антиген HLA-B27 является антигенпрезентирующей молекулой, способной представлять артритогенные пептиды цитотоксическим CD8 Т-лимфоцитам [24]. Объектом лизиса при этом, вероятно, являются хондроциты, локализующиеся как в хрящевой ткани, так и в энтезисах, где также развивается воспалительный процесс [8]. По мнению Y. Sobao и соавт. (1999), для некоторых бактерий (Yersinia, Salmonella) наличие HLA-B27 является фактором, существенно облегчающим их инвазию в клетки синовиальной оболочки [28].
В 2000 году R.A. Colbert и соавт. была предложена новая теория патогенеза РеА, суть которой заключается в том, что под воздействием липополисахаридов клеточной стенки причинных микроорганизмов в процессе антигенной обработки в моноцитах человека возможна неправильная «сборка» тяжелых цепей HLA-B27, что приводит к аккумуляции молекул HLA-B27 в эндоплазматической сети этих клеток [9]. Это, в свою очередь, может приводить к активации в ней стрессорных сигнальных путей. В настоящее время известны два из них. Первый — это ответ «перегруженной» эндоплазматической сети, при котором активируется нуклеарный фактор kB (NF-kB) моноцитов, следствием чего является гиперпродукция провоспалительных цитокинов, в том числе ФНО-α. Второй — это развернутый белковый ответ, который ведет к стрессовой активации генов-мишеней и киназ, участвующих в процессах фосфорелирования отдельных внутриклеточных белков, регулирующих генную экспрессию [9,24]. Вышеописанные процессы могут приводить к разрегуляции генов, отвечающих за эффективную фагоцитарную активность макрофагов, нарушению процессов элиминирования внутриклеточных бактерий, следствием чего может быть индукция иммуно-воспалительных нарушений и развитие РеА.
Известно, что важную роль в эрадикации инфекционных агентов, особенно в случае с внутриклеточными бактериями, играют провоспалительные цитокины Th1 типа, такие как интерферон гамма (ИФ-α) и фактор некроза опухоли-альфа (ФНО-α). В многочисленных исследованиях было показано, что при РеА антибактериальный Тh1-иммунный ответ (продукция ИФ-γ, ФНО-α, ИЛ-2 и ИЛ-12) снижен в пользу Th2-иммунного ответа (синтез ИЛ-4 и ИЛ-10) [21]. Так возникла наиболее распространенная в настоящее время гипотеза патогенеза РеА, предложенная J. Sieper (2001), в основе которой лежит дисбаланс цитокинов [25]. По мнению автора, активные мононуклеарные клетки синовиальной жидкости больных РеА переключаются на Th2-иммунный ответ с низкой продукцией ИФ-γ и ФНО-α и гиперпродукцией ИЛ-4, что способствует длительной персистенции бактерий в синовиальной оболочке и полости сустава. В частности, S. Bas и соавт. (1999) подтвердили низкую продукцию антител у мужчин, больных РеА, что, по их мнению, указывало на провоспалительный Th1 тип иммунного ответа и могло способствовать индукции артрита [6].
Вместе с тем, несмотря на большое количество проведенных исследований, посвященных изучению механизмов развития реактивного артрита, окончательный ответ на этот вопрос до настоящего времени не сформулирован, что, естественно, отражается и на эффективности терапии данного заболевания.
Клинические проявления РеА
Реактивный артрит развивается у 1-3% больных, перенесших хламидийную инфекцию, и у 1,5-4% больных после кишечных инфекций [13,22]. Клинически заболевание проявляется поражением суставов, преимущественно нижних конечностей, возможно развитие энтезопатий и болей в нижних отделах спины. Характерно асимметричное поражение крупных (реже мелких) суставов в виде моно- или олигоартрита, «лестничный» тип поражения суставов, «сосискообразная» дефигурация пальцев стоп [1].
У некоторых больных наряду с артритом развивается конъюнктивит и уретрит (триада Рейтера), в более редких случаях могут развиваться и другие системные проявления, такие как ирит, изъязвления слизистой оболочки полости рта, иногда — кольцевидный баланит, кератодермия, гиперкератоз ногтей, ахиллобурсит и подошвенный фасциит, поражения сердца и нервной системы (рис.1 и 2) [1,2].
Продолжительность первичных случаев РеА составляет в среднем 3-6 месяцев, однако часто клинические симптомы заболевания сохраняются до 12 месяцев и более. При урогенитальном РеА, особенно у пациентов с синдромом Рейтера, отмечается склонность к более частому рецидивированию заболевания, что объясняется как возможностью реинфицирования, так и персистирующей хламидийной инфекцией. Рецидивы, как правило, протекают с суставным синдромом, поражением глаз, кожи, слизистых оболочек и уретритом.
Характер течения заболевания отличается большим разнообразием, у многих пациентов развивается стойкая ремиссия, вместе с тем в 12-15% случаев РеА приобретает хроническое течение [15].
Лечение РеА
Комплексная терапия РеА включает применение нестероидных противовоспалительных препаратов (НПВП), глюкокортикоидов (в некоторых случаях), медленно действующих болезнь-модифицирующих препаратов (базисных средств) при затяжных и хронических вариантах течения заболевания, а также биологических агентов. Отдельное место в лечении РеА занимает антибактериальная терапия.
Основными средствами «актуальной» терапии РеА являются нестероидные противовоспалительные препараты (НПВП), которые применяются для купирования суставного синдрома (артрита, синовита, энтезита и др.). Они обладают рядом общих свойств: неспецифичность противовоспалительного эффекта, т.е. торможение воспалительных реакций независимо от их этиологических и нозологических особенностей; сочетание противовоспалительного, обезболивающего и жаропонижающего эффекта; относительно хорошая переносимость.
Терапевтический эффект НПВП реализуется через подавление продукции циклооксигеназы (ЦОГ) с последующим снижением синтеза провоспалительных простагландинов, в частности, ПГЕ2 [3]. Все НПВП по степени ингибирования ЦОГ подразделяются на 2 группы — неселективные («классические», стандартные), в равной степени ингибирующие продукцию ЦОГ-1 и ЦОГ-2 (диклофенак, индометацин, ибупрофен и др.), и селективные (специфические) ЦОГ-2 ингибиторы — нимесулид, мелоксикам, коксибы.
Больным РеА широко назначаются «стандартные» НПВП — диклофенак, ацеклофенак, кетопрофен, напроксен и др., обладающие высоким терапевтическим индексом. В частности, ацеклофенак ингибирует оба изофермента циклооксигеназы с преимущественным угнетением ЦОГ-2, а также подавляет синтез ряда провоспалительных цитокинов, в частности, ИЛ-1β [14]. Лечебная доза ацеклофенака составляет 200 мг в сутки, поддерживающая — 100 мг в сутки. Не выявлено каких-либо изменений при совместном приеме ацеклофенака и метотрексата, назначаемого при хронических вариантах течения РеА [4].
К настоящему времени накоплен большой практический опыт по применению ацеклофенака при различных ревматических заболеваниях. В экспериментах на животных было показано, что ацеклофенак при равной эффективности со стандартными НПВП оказывает гораздо меньшее повреждающее действие на слизистую ЖКТ. Так, его ульцерогенная доза в эксперименте оказалась примерно в 4 раза выше, чем у диклофенака, индометацина и напроксена. Проведенное сравнительное исследование ацеклофенака и селективных НПВП (целекоксиба и рофекоксиба) в отношении подавления активности ЦОГ-1 и ЦОГ-2 в цельной крови человека показало, что ацеклофенак ингибирует оба изофермента, но преимущественно экспрессию ЦОГ-2, приближаясь таким образом по механизму действия к селективным [20]. Доказана способность ацеклофенака ингибировать синтез ряда провоспалительных цитокинов (ФНО-α и ИЛ-1β), что имеет важное значение при применении его при воспалительных артритах.
Одним из серьезных побочных эффектов НПВП, ограничивающих их применение, является развитие НПВП-индуцированных гастропатий, проявляющихся эрозиями (часто множественными) и язвами антрального отдела желудка. Основными факторами риска развития НПВП-гастропатии являются пожилой возраст больных, наличие в анамнезе язвенной болезни, желудочно-кишечного кровотечения или мелены, длительный прием высоких доз НПВП, прием одновременно НПВП и препаратов других фармакологических групп (антикоагулянтов и др.) [3]. Данные многочисленных клинических исследований свидетельствуют о том, что частота возникновения неблагоприятных явлений со стороны органов ЖКТ при приеме подавляющего большинства неселективных НПВП достигает 30%, а госпитализация пациентов пожилого возраста из-за развития пептической язвы в 4 раза выше по сравнению с лицами той же возрастной группы, не принимающих НПВП.
В этой связи представляет интерес исследование А. Yanagawa и соавт. (1998), в котором изучалось возможное побочное действие ацеклофенака и диклофенака на слизистую оболочку 12-перстной кишки [30]. Было установлено, что эндоскопические изменения после 2-недельного приема ацеклофенака, диклофенака и плацебо достоверно чаще наблюдались в группе диклофенака. При этом у пациентов, получавших диклофенак, содержание гексозамина (фактора, оказывающего цитопротективное действие) и локальный кровоток в слизистой оболочке желудка и 12-перстной кишки были значимо снижены, в то время как при лечении ацеклофенаком эти показатели достоверно не отличались от группы плацебо.
При высокой активности РеА, а также недостаточной эффективности НПВП больным показано назначение пероральных глюкокортикоидов. Доза преднизолона зависит от активности заболевания и составляет 30-60 мг/сут. После достижения терапевтического эффекта доза препарата постепенно снижается до полной отмены. Для достижения иммуносупрессии при высокой активности РеА применяется «пульс-терапия»- 1000 мг метилпреднизолона внутривенно капельно на 150 мл изотонического раствора хлорида натрия, 3 введения на курс [29]. При показаниям (рецидивирующий артрит, энтезит) глюкокортикоиды вводят внутрисуставно, периартикулярно или в область энтезиса (0,5-1 мл бетаметазона).
При рефрактерности к проводимому лечению, развитии системных поражений (лихорадки, снижения массы тела, лимфоаденопатии, анемии и др.), а также при хронических формах РеА в комплексную терапию включают базисные средства — сульфасалазин 2-3 г/сут., азатиоприн 150 мг/сут., метотрексат 10-15 мг в неделю. Терапевтический эффект базисных препаратов развивается медленно и достигает максимума через 4-6 мес. непрерывной терапии [29].
В последние годы с появлением генно-инженерных биологических препаратов они начали активно назначаться больным с серонегативными спондилоартропатиями. В немногочисленных публикациях приведены сведения об эффективности инфликсимаба и у больных РеА, назначаемого при низком эффекте традиционных иммуносупрессантов [10,16].
Необходимость применения антибактериальных препаратов при различных вариантах РеА порождает больше вопросов, чем ответов. В первую очередь это связано с противоречивыми результатами исследований, проводимых различными авторами. Так, первые попытки лечения урогенитальных РеА короткими курсами антибиотиков (1-2 недели) не оказывали существенного влияния на течение и длительность заболевания. Вместе с тем рядом исследователей было показано снижение частоты развития РеА с 37% у больных урогенитальными инфекциями, нелеченных антибиотиками или получавших пенициллин, до 10% у больных, получивших короткий курс эритромицина или тетрациклина [19]. Yli-Kertulla К. и соавт. (2003), анализируя отдаленные результаты 3-месячного курса лечения ципрофлоксацином больных с урогенитальными и постэнтероколитическими РеА в острой фазе, пришли к выводу, что пациенты, получавшие антибактериальную терапию, независимо от этиологии имели более благоприятные исходы заболевания по сравнению с группой плацебо [31].
В настоящее время антибактериальная терапия назначается больным РеА с доказанной хламидийной инфекцией с учетом чувствительности причинных микроорганизмов. Применяются антибиотики тетрациклинового ряда — доксициклин по 0,3 г/сут., фторхинолоны — ципрофлоксацин — 0,5 г/сут., ломефлоксацин — 0,8 г/сут., из группы макролидов эффективен кларитромицин — 0,5 г/сут. [7]. Применение антибиотиков из группы пенициллинов при РеА хламидийной этиологии противопоказано, так как они могут способствовать переводу хламидий в L-формы, весьма устойчивые к антибактериальной терапии. При лечении урогенитальных РеА большинство исследователей отдают предпочтение длительной антибактериальной терапии (до 28 дней и более) [17,18,22,27].
Результаты многоцентровых исследований свидетельствуют о вероятной неэффективности антибактериальной терапии у больных постэнтероколитическими РеА, хотя этот вопрос нельзя считать окончательно решенным [26,29].
Таким образом, существующее многообразие предлагаемых к лечению антибактериальных препаратов, а также попытки разработать новые схемы терапии свидетельствуют об отсутствии в настоящее время единой стратегии в этом вопросе и требуют дальнейшего изучения.
Литература
1. Лила А.М., Мазуров В.И., Гапонова Т.В. Реактивные артриты / Учебное пособие. — СПб.: издательство СПбМАПО, 2008. — 36 с.
2. Мазуров В.И., Лила А.М., Блохин М.П. Случай группового заболевания синдромом Рейтера у больных, перенесших острую кишечную инфекцию // Терапевт. арх. — 1990. — Т.62, N 12. — C.117-119.
3. Насонов Е.Л. Нестероидные противовоспалительные препараты: новые аспекты применения в ревматологии и кардиологии // Русский медицинский журнал. — 2003. — Т.11, №23. — С.1280-1284.
4. Насонова В.А. Ацеклофенак — безопасность и эффективность // Русский медицинский журнал. — 2003. — Т.11, №5. — С. 3-6.
5. Ahvonen P., Sievers K., Aho K. Arthritis associated with Yersinia enterocolitica infection. Acta Rheum Scand 1969;15:232-253.
6. Bas S., Scieux C., Vischer T.L. Male sex predominance in Chlamydia trachomatis sexually acquired reactive arthritis: are women more protected by anti-chlamydia antibodies? Ann Rheum Dis 2001;60:605-611.
7. Carter J.D., Valeriano J., Vasey F.B. Doxycycline versus doxycycline and rifampin in undifferentiated spondyloarthropathy, with special reference to Chlamydia-induced arthritis. A prospective, randomized 9-month comparison // J. Rheumatol. — 2004. — Vol. 31, № 10. — Р. 1973-1980.
8. Cohen Susanne E., Bodmer Hellen C. Cytotoxic T lymphocytes recognize and lyse chondrocytes under inflammatory, but not non-inflammatory conditions. Immunology 2003;109:8-14.
9. Colbert R.A. HLA-B27 misfolding: a solution to the spondyloarthropathy conudrum? Mol Med Today 2000;6:224-230.
10. El-Shabrawi Y., Mangge H, Hermann J. Anti-tumour necrosis factor and treatment in chronic recurrent inflammation of the anterior segment of the eye in patients resistant to standard immunomodulatory treatment. Ann Rheum Dis 2003;62:1243-1244.
11. Gordon F.B., Quan A.L., Steinman T.I., Philip R.N. Chlamydia isolates from Reiter’s syndrome. Br J Venereal Dis 1973;49:376-379.
12. Hammer M., Nettelnbreker E., Hopf S., Schmitz E., Porshke K., Zeidler H. Chlamidial rRNA in the joints of patients with Chlamydia-induced arthritis and undifferentiated arthritis. Clin Exp Rheumatol 1992;10:63-66.
13. Hannu T., Mattila L., Siitonen A., Leirisalo-Repo M. reactive arthritis attributable to Shigella infection: a clinical and epidemiological nationwide study. Ann Rheum Dis 2005;64:594-598.
14. Henrotin Y., De Leval Х, Mathy-Hartet M et al. In vitro effects of aceclofenac and its bolites on the production by chondrocytes of inflammatory tors // Inflamm.Res. — 2001. — Vol. 50. — P. 391-399.
15. Kohnke Susan J. Reactive Arthritis. A Clinical Approach. Orthopaedic Nursing 2004;23:274-280.
16. Kruithof E., F. van den Bosch. Repeated infusions of infliximab, chimeric anti- TNF a monoclonal antibody in patients with active spondyloarthropathy, one year follow up. Ann Rheum Dis 2002;61:207-212.
17. Kvein T.K., Gaston J.S.N., Bardin T., et al. Three month treatment of reactive arthritis with azithromycin: a EULAR double blind, placebo controlled study. Ann Rheum Dis, 2004;63:1113-1119.
18. Laasila K, Laasonen L, Leirisalo-Repo M. Antibiotic treatment and long term prognosis of reactive arthritis. Ann Rheum Dis, 2003;62:655-658.
19. Leirisalo-Repo M. Reactive arthritis // Scand. J. Rheumatol. — 2005. — Vol. 34, № 4. — Р. 251-259.
20. Lidburg P.s., Vojnovic J., Warner T.D. «COX2/COX1 selectivity of aceclofenac in comparison with celecoxib and rofecoxob in the human whole blood assay / Fith world Congress og the OARS, Barselona, Spain, 4-6 October, 2000. — Suppl B, Th053.
21. Mertz Andreas K.N., Wu Peihua, Sturniolo Tiziana, et al. Multispecific CD4+T Cell Response to a 12-mer Epitope of the Immunodominant Heat-Shock Protein 60 of Yersinia enterocolitica in Yersinia-Triggered Reactive Arthritis: Overlap with the B27- Restricted CD8 Epitope, al Properties, and Epitope Presentation by Multiple DR Alleles. J Immunol 2000;164:1529-1537.
22. Rihl M., Kohler L., Kloss A., Zeidler H. Persistent infection of Chlamydia in reactive arthritis. Ann Rheum Dis 2006;65:281-284.
23. Schumaher H.R. Jr, Arayssi T., Crane M., et al. Chlamydia trachomatis nucleic acids can be found in the synovium of some asymptomatic subjects. Arthritis Rheum 1999;42:1281-1284.
24. Sibilia J., Libmach F-X. Reactive arthritis or chronic infectious arthritis? Ann Rheum Dis 2002;61:580-587.
25. Sieper J. Pathogenesis of reactive arthritis. Curr Rheumatol Rep 2001;3:412-418.
26. Sieper J., Fendler C., Eggens U. et al. Long term antibiotic treatment in reactive arthritis and undifferentiated oligoarthritis: results of a double-blinded placebo-controlled randomized study. Arthritis Rheum 1997;40:S227.
27. Smieja M., MacPherson D.W. et al. Randomised, blinded, placebo-controlled trial of doxycycline for chronic seronegative arthritis. Ann Rheum Dis 2001;60: 1088-1094.
28. Sobao Y., Tsuchiya N., Takiguchi M., et al. Overlapping peptide- binding specificities of HLA-B27 and B39. Arthritis Rheum 1999;42:175-181. Toivanen A. Managing reactive arthritis. Rheumatology 2000;39:117-121.
29. Toivanen A. Managing reactive arthritis. Rheumatology 2000;39:117-121.
30. Yanagawa A., Endo T., Kusakari K. et al. Endoscopie evaluation of aceclofenac-induced gastroduodenal mucosal damage: a double-blind comparison with sodium diclofenac and placebo // J.J.Rheumaco L. — 1998 — Vol. 18. — P. 249-259.
31. Yli-Kerttula T. et al. Effect of a three month course of ciprofloxacin on the late prognosis of reactive arthritis // Ann. Rheum. Dis. — 2003. — Vol. 62, № 9. — Р. 880-884.
Источник
Программа лечения Врачи Цены Отзывы
В последние годы отмечается рост заболеваемости реактивным артритом. Причины и механизм развития болезни изучены далеко не полностью, но уже существуют клинически подтвержденные схемы лечения, позволяющие подавлять воспалительный процесс на ранних стадиях. Надеемся, что информация из этой статьи поможет пациентам своевременно заподозрить заболевание и обратиться за медицинской помощью. Как лечить реактивный артрит, хорошо знают специалисты московской клиники «Парамита».
Что такое реактивный артрит (РеА)
Термин «реактивный артрит» впервые был использован более 50 лет назад для названия артритов, развивающихся после перенесенного иерсиниоза при отсутствии в суставах возбудителей инфекции. Но уже через несколько лет это название стали связывать с некоторыми инфекциями желудочно-кишечного тракта, мочеполовых органов и носоглотки.
В настоящее время реактивным артритом считается негнойное воспаление суставов, развивающееся не позднее, чем через 6 — 8 недель после перенесенной урогенитальной, кишечной или носоглоточной инфекции. Код по МКБ-10 М02.
Болеют чаще молодые мужчины в возрасте 17 — 40 лет после перенесенных половых инфекций (женщины болеют значительно реже). У детей, подростков, а также лиц любого возраста и пола реактивный артрит может развиваться после перенесенных кишечных инфекций, а также инфекций носоглотки.
Распространенность РеА в нашей стране среди взрослых около 43 на 100000 населения, среди детей — 99, среди подростков — 172. Заболеваемость растет, что во многом связано с генетической предрасположенностью, бессимптомным течением инфекций и несвоевременным назначением адекватного лечения.
Выделяют также синдром Рейтера, развивающийся после перенесенной урогенитальной инфекции и проявляющийся в виде трех основных симптомов: артрита, конъюнктивита и уретрита.
Причины заболевания
Основными причинами реактивного артрита являются перенесенная инфекция и генетическая предрасположенность. К инфекциям, способным вызывать РеА, относятся:
- урогенитальная форма РеА — хлимидиоз, уреаплазмоз, микоплазмоз;
- кишечная форма РеА — шигенеллез (дизентерия), сальмонеллез, иерсиниоз, кишечная инфекция, вызванная кишечной палочкой;
- носоглоточная форма — перенесенные носоглоточные инфекции, вызванные стафилококковой, стрептококковой и др. инфекцией.
Перенесенная инфекция является триггером (пусковым фактором), запускающим цепь иммуно-аллергических и воспалительных реакций. Происходит это преимущественно у генетически предрасположенных лиц, имеющих в организме антиген HLA-B27, вызывающий дисбаланс в иммунной системе, что приводит к усиленному образованию простагландинов и цитокинов — биологически активных веществ, вызывающих воспаление.
Длительный воспалительный процесс поддерживается также не полностью удаленными инфекционными возбудителями и появлением антител к ним. Особенно длительно протекают реактивные артриты, вызванные урогенитальной инфекцией (хламидиями, микоплазмами, уреаплазмами), внедряющейся в клетки и сохраняющей жизнеспособность в течение длительного времени. Сбои в иммунной системе вызывают аллергические и аутоиммунные (с аллергией на собственные ткани организма) процессы, также поддерживающие длительное воспаление.
Симптомы реактивного артрита
Независимо от причины заболевания, реактивный артрит развивается одинаково. К моменту появления первых симптомов реактивного артрита все проявления триггерной инфекции заканчиваются или протекают незаметно.
 Боль, отек и покраснение над пораженным суставом — одни из первых симптомов реактивного артрита
Боль, отек и покраснение над пораженным суставом — одни из первых симптомов реактивного артрита
Первые признаки РеА
Заболевание начинается через 3 — 30 дней (иногда больше) после перенесенной инфекции остро с повышения температуры тела, головной боли, недомогания, появления воспалительного процесса в суставах. Поражаются чаще один или несколько асимметрично расположенных суставов нижних конечностей. Чаще всего это коленный, голеностопный и суставы пальцев стоп.
Кожа и подкожные ткани над пораженным суставом покрасневшие, отекшие, болезненные. Иногда сразу же появляются боли в нижней части спины — признак поражения крестцово-подвздошных сочленений и суставов позвоночника. При появлении первых признаков воспаления суставов необходимо обращаться в врачу. В клинике «Парамита» вам обязательно помогут.
Явные симптомы
Реактивный артрит может протекать в виде:
- острого воспалительного процесса — до 3-х месяцев;
- подострого — в течение 3 — 6 месяцев;
- затяжного — 6 — 12 месяцев;
- хронического — более 12 месяцев;
- рецидивирующего — с рецидивами и ремиссиями.
Кроме симптомов реактивного артрита с болями и нарушением функции пораженных суставов характерно также поражение околосуставных тканей — связок, сухожилий, околосуставных капсул (энтезиты). Особенно характерно поражение пятки (подпяточный бурсит), сопровождающееся сильными болями и воспаление околосуставных тканей, а также 1-го пальца стопы с покраснением и отеком тканей — «палец-сосиска». Такие симптомы могут полностью нарушать функцию нижних конечностей — передвигаться становится невозможно из-за боли.
РеА урогенитального происхождения часто сочетается с длительно протекающим уретритом у мужчин или цервицитом у женщин, а также с поражением глаз (синдром Рейтера). Поражение глаз может протекать в виде небольшого конъюнктивита, но в некоторых случаях поражаются и более глубокие оболочки глаза.
Иногда при реактивном артрите появляются псориазоподобные высыпания на коже, ладонях и подошвах, а также похожие на псориатические поражения ногтей. На слизистой полости рта появляются безболезненные эрозии. Возможно также увеличение лимфатических узлов в паховой области.
Опасные симптомы
Наиболее опасным является реактивный артрит, связанный с урогенитальной инфекцией. Эта форма заболевания склонна к длительному рецидивирующему течению с последующим формированием ревматоидоподобного течения. Поэтому очень важно своевременно проводить адекватное лечение артрита.
Чем опасно заболевание
Опасность реактивного артрита в том, что он может перейти в длительно протекающее хроническое рецидивирующее заболевание с трудом поддающееся лечению.
Стадии РеА
Воспалительный процесс в суставах протекает в несколько стадий:
- начальная — при остром начале появляются общие симптомы: лихорадка, головная боль, недомогание, а также воспаление, отечность и болезненность суставов; вначале чаще поражаются голеностопные суставы и суставы 1-го пальца стопы;
- развернутая — асимметричное поражение суставов ног (снизу вверх), начиная от голеностопных суставов до коленных; появляются боли в нижней части спины, связанные с поражением суставов позвоночника, кожные высыпания, эрозии на слизистых, увеличение лимфоузлов; при синдроме Рейтера — конъюнктивиты и уретриты;
- завершающая — при кишечной и носоглоточной форме реактивного артрита воспалительный процесс заканчивается через 3 месяца выздоровлением; при подостром течении процесс может длиться до 6 месяцев и также заканчиваться выздоровлением; урогенитальная форма РеА часто протекает хронически.
Возможные осложнения
 Хронический реактивный артрит может стать причиной хромоты
Хронический реактивный артрит может стать причиной хромоты
Реактивный артрит нужно начинать лечить как можно раньше.
Длительный воспалительный процесс может привести к появлению хронических болей, особенно, в области пятки, стопы и пальцев ног, что приведет к хромоте.
При длительном хроническом течении синдрома Рейтера возможно поражение зрительного нерва и слепота, а также к поражение репродуктивной системы и бесплодие.
Что делать при обострении
Если воспалительный процесс принял хроническое рецидивирующее течение, то необходимо проводить длительное лечение под контролем врача. При появлении первых признаков рецидива реактивного артрита следует:
- ограничить двигательную активность;
- принять лекарство из группы НПВП (нестероидных противовоспалительных препаратов) — Диклофенак, Ибупрофен, Мелоксикам; таблетку любого средства можно принять внутрь, а наружно нанести на область пораженного сустава крем, гель или мазь с тем же составом;
- срочно обратиться к лечащему врачу за назначением адекватного лечения.
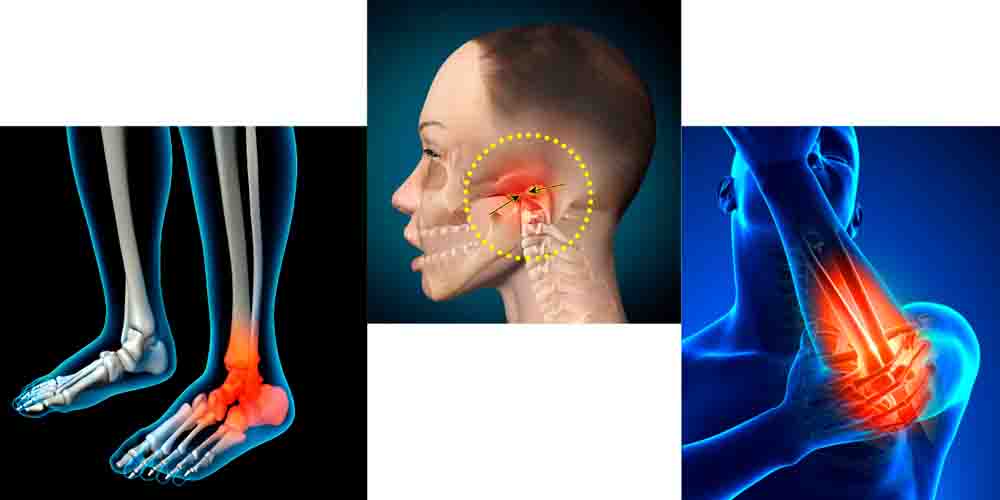
Возможная локализация воспаления
При кишечной и урогенитальной формах реактивного артрита чаще поражаются суставы нижних конечностей. При носоглоточной форме — суставы верхних конечностей и височно-челюстной сустав.
Артрит нижних конечностей
Поражение нижних конечностей преимущественно начинается с больших пальцев ног и поднимается вверх (симптом лестницы), асимметрично поражая вышележащие суставы. При реактивном артрите воспаляются от одного до пяти суставов:
- межфаланговые пальцев ног; чаще всего поражается I палец стопы, он отекает и краснеет — симптом «палец-сосиска»;
- голеностопные с поражением окружающих тканей; особенно характерно поражение сухожилий и связок в пяточной области с формированием рыхлых пяточных шпор, что вызывает постоянную боль, усиливающуюся при хождении и наступлению на пятку;
- коленные — для этой локализации характерно образование большого количества экссудата (воспалительной жидкости в суставе), что приводит к образованию подколенных кист; разрыв кист приводит к развитию тромбофлебитов и нарушению венозного кровообращения;
- тазобедренные — поражается редко, протекает в виде умеренных суставных болей.
Хондропротекторы что это как выбрать, насколько они эффективны
Боль в суставах в состоянии покоя
Артрит верхних конечностей
Локализация реактивного артрита в суставах верхних конечностей встречается гораздо реже. В основном это происходит при заболеваниях носоглотки и стоматологических инфекционно-воспалительных процессах.
Чаще всего при РеА поражаются суставы:
- локтевой — локоть отекает, краснеет, становится болезненным, рука с трудом сгибается и разгибается;
- лучезапястный с поражением связок и сухожилий кисти — боли в суставе передаются на кисть; сильная боль не позволяет сжимать и разжимать кисть, удерживать в ней предметы;
- плечевой — поражается редко, характерна отечность и болезненность.
Височно-челюстной артрит
 Реактивнй артрит поражает суставы нижних и верхних конечностей, височно-челюстные суставы
Реактивнй артрит поражает суставы нижних и верхних конечностей, височно-челюстные суставы
Триггером являются инфекции носоглотки, уха и полости рта. Характерна небольшая припухлость, покраснение и отечность в области развития реактивного артрита. При открытии рта наблюдается небольшая асимметричность, может нарушаться и становиться болезненным процесс жевания. Заболевание протекает остро или подостро, хорошо лечится, прогноз благоприятный.
Диагностика
Диагностика реактивного артрита включает в себя выявление характерных проявлений заболевания и подтверждение диагноза следующими исследованиями:
- Лабораторная диагностика:
- общеклинические анализы крови и мочи — данные исследования выявляют наличие воспалительного процесса, анемии;
- биохимические исследования крови — общий белок и белковые фракции, наличие С-реактивного белка (признак воспалительной реакции);
- иммунологические исследования — ревматоидный фактор, антитела к циклическим цитруллинированным пептидам для исключения ревматоидного артрита; маркеры системной красной волчанки;
- выявление антигена HLA-B27 путем исследования крови методом ПЦР (полимеразной цепной реакции), позволяющим выявить мельчайшие частицы ДНК этого белка;
- выявление урогенитальных, кишечных инфекций и очагов носоглоточных инфекций с помощью микроскопических, микробиологических (посев на питательные среды), иммунологических исследований;
- для исключения гнойного артрита иногда исследуется синовиальная жидкость.
- Рентгенография суставов, в процессе которой выявляется степень их поражения.
- УЗИ — позволяет выявить изменения в околосуставных тканях.
- Артроскопия — исследование внутренней суставной поверхности с помощью оптической аппаратуры. При РеА применяется редко.
Лечение реактивного артрита
Вылечить реактивный артрит может только врач после проведенного обследования и с учетом его результатов. Основные принципы лечения реактивного артрита:
- устранение воспаления и болей в суставах;
- подавление инфекционно-аллергического и аутоиммунного процессов;
- устранение триггерной инфекции.
Проводятся следующие виды лечения реактивного артрита:
- медикаментозное;
- немедикаментозное;
- с использованием народных средств.
Медикаментозная терапия
Хруст в суставах — когда стоит беспокоиться
Внутрисуставные инъекции гиалуроновой кислоты
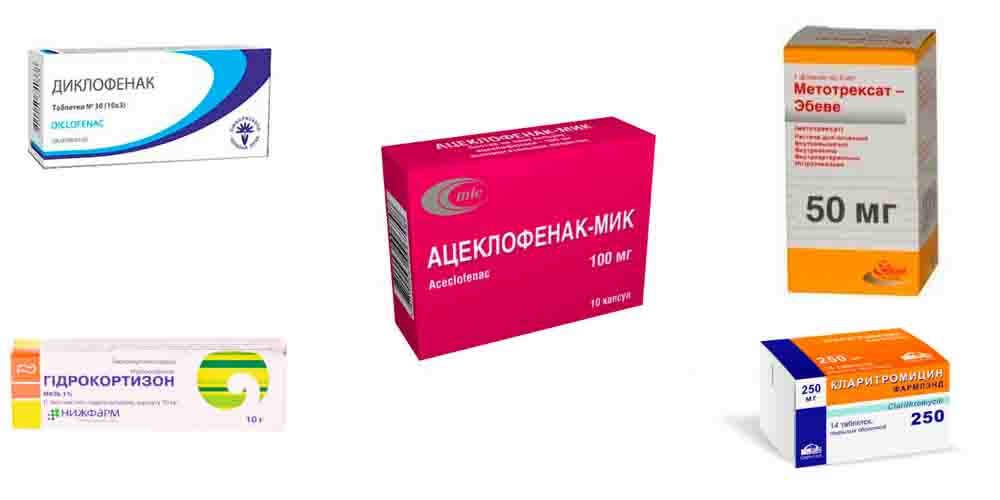
Лечение реактивного артрита начинается с устранения воспаления, отека и болей. С этой целью больным назначают лекарственные препараты группы НПВП. К наиболее эффективным лекарствам относятся Диклофенак, Ацеклофенак, Ибупрофен и другие в виде инъекций, таблеток или наружно (гели, мази).
При выраженном отеке и воспалении не устраняющимися лекарствами группы НПВС, назначают глюкокортикоидные гормоны. Их назначают курсами в виде таблеток внутрь (Преднизолон), в виде пульс-терапии — коротких интенсивных курсов внутривенно капельно (Метилпреднизолон), а также путем введения в сустав или в околосуставные ткани (Гидрокортизон, Дипроспан).
Если появляется риск перехода в хроническое течение, назначают базисную терапию — лекарственные препараты, подавляющие иммунные реакции: Сульфасалазин, Метотрексат, Азатиоприн и др. Назначаются также биологические агенты — биологически активные вещества (антитела, цитокины и др.), принимающие участие в иммунных реакциях (Мабтера).
При триггерных урогенитальных инфекциях обязательно назначают длительный курс антибактериальной терапии: антибиотики из группы макролидов (Кларитромицин), тетрациклинов (Доксициклин) или фторхинолонов (Ципрофлоксацин) на протяжении месяца и более.
При кишечных инфекциях антибактериальная терапия считается нецелесообразной. При носоглоточных и стоматологических инфекциях решение о назначении антибиотиков принимается врачом индивидуально.
 Лекарства для лечения реактивного артрита
Лекарства для лечения реактивного артрита
Немедикаментозное лечение
К немедикаментозным методам лечения относятся:
- Диета. Специальной диеты нет, но учитывая аллергический компонент заболевания, из рациона исключаются продукты, вызывающие аллергию (яйца, орехи, цитрусовые, красные и оранжевые овощи и фрукты и др.), острые приправы, жареные, консервированные, копченые блюда, сладости и сдоба.
- Физиотерапевтические процедуры. В остром периоде для устранения отека и болей назначают электрофорез с Гидрокортизоном, а затем лазеро-, магнитотерапию. На стадии восстановления рекомендуется санаторно-курортное лечение с проведением бальнео- и грязелечения.
- Курсы рефлексотерапии.
- PRP-терапия — стимуляция регенеративных способностей организма путем введения собственной плазмы пациента, обогащенной тромбоцитами.
- Лечебная гимнастика и массаж — проводятся после устранения острого воспалительного процесса.
Народные средства
Лечение реактивного артрита народными средствами часто включается в состав комплексного лечения для усиления эффективности лекарств и снижения лекарственной нагрузки на организм пациента. Народные средства подбираются для каждого больного индивидуально в зависимости от характера течения заболевания.
Самостоятельное лечение реактивного артрита народными средствами неэффективно.
Подход к лечению заболевания в нашей клинике
При поступлении в клинику пациента с симптомами реактивного артрита перед назначением комплексного лечения проводится обязательное всестороннее обследование. Одновременно пациенту проводятся экстренные процедуры для устранения воспаления и боли. Это медикаментозное лечение, иглоукалывание, физиопроцедуры и др. После обследование назначается комплексное лечение, в состав которого входят:
- современные западные способы лечения с применением новейших препаратов, лечебных схем и немедикаментозных методов, направленных на устранение симптомов реактивного артрита;
- традиционные восточные методы лечения, направленные на восстановление здоровья всего организма, в том числе функции суставов.
Подобный подход позволяет быстро и эффективно полностью вылечить реактивный артрит.
Общие клинические рекомендации
При остром и подостром течении РеА после проведения курса лечения пациент должен находиться под наблюдением ревматолога в течение полугода с проведением клинического и лабораторного контроля раз в 3 месяца.
При хроническом течении заболевания диспансерное наблюдение более длительное с назначением курсов противорецидивной терапии до появления состояния стойкой ремиссии.
После перенесенного заболевания рекомендуется избегать тяжелых физических нагрузок и силовых видов спорта. Для восстановления функции суставов хорошо подойдут занятия плаванием.
Лицам, имеющим генетическую предрасположенность (наличие антигена HLA-B27) к реактивному артриту, рекомендуется иметь одного проверенного полового партнера.
Профилактика
Для предупреждения реактивного артрита необходимо:
- вести здоровый подвижный образ жизни;
- избавиться от лишнего веса и вредных привычек;
- правильно питаться;
- своевременно лечить все острые заболевания и очаги инфекции.
Частые вопросы
Заразен ли реактивный артрит?
Есть ли какие-то особенности протекания, диагностики, лечения у детей?
Какие прогнозы обычно дают врачи?
Прогноз при реактивном артрите благоприятный, в большинстве случаев наступает полное выздо
