Увеит при ювенильном идиопатическом артрите
Статья посвящена проблеме увеита, ассоциированного с ювенильным идиопатическим артритом
Ювенильный идиопатический артрит (ЮИА) на современном этапе рассматривается как артрит неустановленной причины, возникший ранее 16-летнего возраста и протекающий не менее 6 нед. При ведении пациентов с ЮИА одной из важнейших проблем является возможность развития ревматоидного увеита. Увеит – воспаление различных частей сосудистой оболочки глаза, может проявляться покраснением глаза, болезненностью, светочувствительностью, снижением зрения, в этом случае диагностика не представляет сложности. В большинстве же случаев увеит протекает бессимптомно и может привести к значительной потере зрения и слепоте. Ревматоидный увеит рассматривается как внесуставное проявление ЮИА. В большинстве случаев ревматоидный увеит носит двусторонний характер, а при одностороннем процессе прогрессирование его с поражением контралатерального глаза часто отмечается в течение первых 12 мес. от манифестации суставного синдрома ЮИА [1]. Ранняя диагностика и своевременное начало терапии увеита, как топической, так и в рамках противоревматической терапии, позволят снизить частоту слепоты у пациентов с ЮИА, а также снизить бремя инвалидизации для пациента, его семьи и государства.
Факторы риска развития увеита при ЮИА:
– раннее начало, до 6–7 лет [2-5];
– повышение СОЭ [2];
– положительные антинуклеарные антитела [3–5];
– олигоартикулярный вариант [3–5].
Основной клинической задачей в ведении пациента с ЮИА и поражением глаз является подавление воспалительной активности, как суставного синдрома, так и увеита. Большинство современных противоревматических препаратов эффективны не только в отношении активности суставного синдрома, но и оказывают действие на активность увеита [6–9]. В то же время даже современные биологические высокоэффективные препараты не всегда предупреждают развитие так называемого увеита de-novo.
Цель и задачи исследования: на основе анализа городского регистра детей, получающих генно-инженерную биологическую терапию, изучить клинико-демографические данные пациентов, страдающих ЮИА с увеитом; оценить варианты течения увеита (одно- и двустороннее поражение глаз, активность процесса, дебют увеита по отношению к дебюту суставного синдрома); выявить варианты течения ЮИА, при которых достоверно чаще встречается увеит; оценить эффективность терапии.
Материал и методы
Проанализированы данные 53 пациентов, проживающих в г. Москве, в возрасте от 1 года до 17 лет, страдающих ЮИА с увеитом и находящихся на генно-инженерной биологической терапии (ГИБТ). Данные о пациентах были получены из Единого московского регистра пациентов, получающих генно-инженерную биологическую терапию [10]. В данный регистр включено 237 пациентов, получающих следующие генно-инженерные биологические препараты: этанерцепт, адалимумаб, тоцилизумаб, абатацепт. Нами проанализированы следующие показатели: структура вариантов течения ЮИА с увеитом, структура генно-инженерных биологических препаратов, сопутствующая базисная противовоспалительная терапия (метотрексат, циклоспорин А), использовавшиеся у данных пациентов.
Результаты исследования
1. Место увеита в популяции пациентов с ювенильным идиопатическим артритом
Всего в Москве на 01.06.2016 237 детей с ЮИА получают генно-инженерную биологическую терапию: 110 (46,4%) пациентов получают этанерцепт, 63 (26,6%) – адалимумаб, 46 (19,4%) – тоцилизумаб, 18 – (7,6%) абатацепт. Доля пациентов, страдающих ЮИА с увеитом, составляет 22,4% (53 пациента).
Клинико-демографические данные. Среди пациентов с ЮИА и увеитом, находящихся на ГИБП, 41 (77,4%) девочка и 12 (22,6%) мальчиков, средний возраст на период исследования составил 9,5 года (4 года – 17 лет). Средний возраст дебюта ЮИА, ассоциированного с увеитом, составил 3,4 года (1,0–12,5 года). Дебют ЮИА с поражением глаз в 3,8% случаев (2 человека) отмечался до начала суставного синдрома, в 13,2% случаев (7 человек) увеит выявлен параллельно с дебютом суставного синдрома, в 83% случаев (44 человека) – после дебюта суставного синдрома. У 66% пациентов (35 человек) увеит носит двусторонний характер. Антинуклеарный фактор был положительным у 20,8% пациентов (11 человек).
У 66% пациентов (35 человек) к настоящему времени достигнута ремиссия увеита, что свидетельствует о достаточно высокой эффективности ГИБП. Активность увеита сохраняется у 34% пациентов (18 человек). В настоящее время выявить достоверные причины сохранения активности увеита не удалось. У ряда пациентов ввиду недавно начатой ГИБТ еще не достигнута контрольная точка эффективности терапии, у другой группы пациентов в настоящее время достигнута ремиссия суставного синдрома, но сохраняется вялотекущее течение увеита.
Терапия биологическими препаратами инициируется в федеральных центрах: ФГАУ НЦЗД МЗ РФ, ФГБНУ «НИИ ревматологии им. В.А. Насоновой», УДКБ Первого МГМУ им. И.М. Сеченова, а также в Морозовской детской городской клинической больнице. Рабочей группой по детской ревматологии г. Москвы, разработан план диспансерного наблюдения за пациентами с ЮИА, в т. ч. ассоциированного с увеитом. Пациенты в обязательном порядке осматриваются офтальмологами с кратностью от 1 раза в 3 мес. до 1 раза в год, что позволяет своевременно выявлять увеит и контролировать лечение. Назначения офтальмолога включают местную терапию топическими кортикостероидами, мидриатиками и нестероидными противовоспалительными препаратами (НПВП). Квалифицированная офтальмологическая помощь в виде консультаций, а при необходимости и оперативного лечения оказывается в Московском НИИ глазных болезней им. Гельмгольца, а также в офтальмологическом отделении Морозовской ДГКБ.
Анализ терапии ГИБП больных с ЮИА и увеитом представлен на рисунке 1.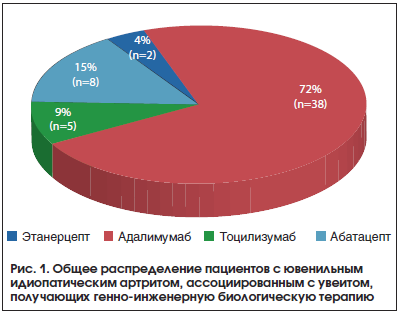
Доминирующее число пациентов (38 человек, 71,7%), страдающих увеитом, получают терапию адалимумабом. Это обусловлено высокой эффективностью терапии данным препаратом как в отношении активности суставного синдрома, так и активности увеита [7, 9, 11]. Отдельная группа пациентов (8 человек, 15,1%) получает терапию абатацептом, это связано с тем, что на сегодняшний день накоплен значительный успешный опыт в применении данного препарата у пациентов с увеитом [8, 12]. По данным регистра, тоцилизумаб используется у 5 пациентов. Из них в 2-х случаях как препарат первой линии (в первом случае у пациента с системной формой ЮИА, во втором случае – у пациента с полиартикулярным серонегативным вариантом ЮИА с высокой клинико-лабораторной активностью). В 2-х случаях тоцилизумаб используется как препарат второй линии (после применения адалимумаба, вследствие обострения суставного синдрома) и в 1 случае как препарат четвертой линии (после применения инфликсимаба, адалимумаба, абатацепта, вследствие обострения суставного синдрома на каждом из препаратов). В настоящее время появляются работы, свидетельствующие о высокой эффективности тоцилизумаба в отношении активности увеита и рекомендующие данный препарат во второй и третьей линии терапии [13–17]. Этанерцепт используется в 2-х случаях. В первом случае у ребенка с отягощенным анамнезом по туберкулезной инфекции, на фоне активности суставного процесса и увеита. Во втором случае увеит дебютировал на 4-м году от начала генно-инженерной биологической терапии этанерцептом.
Также нами рассчитана доля пациентов с увеитом по каждому генно-инженерному биологическому препарату (табл. 1). 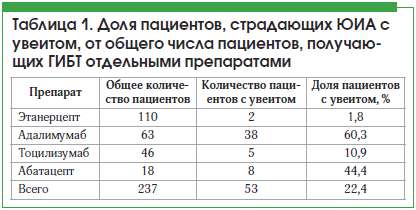
Как видно из таблицы 1, 60,3% (38 человек) и 44,4% (5 человек) пациентов, получающих терапию адалимумабом и абатацептом соответственно, страдают увеитом.
2. Структура вариантов течения ювенильного идиопатического артрита с увеитом у пациентов г. Москвы, получающих генно-инженерную биологическую терапию
В своей работе мы пользовались классификацией ЮИА Международной лиги ревматологических ассоциаций (ILAR). По данным нашего регистра, пациенты с псориатическим вариантом ЮИА и увеитом не зарегистрированы, зарегистрированные варианты течения ЮИА представлены в таблице 2.
Из таблицы 2 мы видим, что увеит достоверно чаще (p<0,05) встречается у больных с полиартикулярным серонегативным по РФ вариантом ЮИА – 26 пациентов (49,0%) и олигоартикулярным вариантом ЮИА – 22 пациента (41,5%).
3. Место базисной противовоспалительной терапии в лечении ювенильного идиопатического артрита с увеитом
Всего из пациентов, страдающих увеитом и получающих ГИБП, сопутствующую базисную противовоспалительную терапию получают 44 пациента (83%), из них 42 пациента получают метотрексат в дозе от 7,5 до 20 мг/нед. и 2 пациента получают циклоспорин А в дозе 150–200 мг/сут (табл. 3).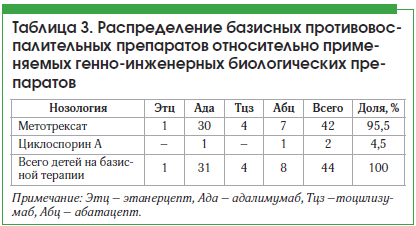
Выводы
1. Доля пациентов, страдающих ЮИА с увеитом, среди пациентов с ЮИА, получающих генно-инженерную биологическую терапию, составляет 22,4%.
2. Средний возраст дебюта ЮИА, ассоциированного с увеитом, составляет 3,4 года (1,0–12,5 года).
3. Дебют увеита в 3,8% случаев отмечался до появления суставного синдрома ЮИА, в 13,2% случаев – параллельно с ним, в 83% случаев – после развития суставного синдрома.
4. У 66% пациентов увеит носит двусторонний характер.
5. Активность увеита на фоне ГИБП сохраняется у 34% пациентов, у 66% пациентов увеит находится в состоянии ремиссии.
6. Доминирующее число пациентов (71,7%), страдающих увеитом, получают терапию адалимумабом.
7. В группах пациентов, получающих терапию адалимумабом и абатацептом, 60,3 и 44,4% соответственно страдают увеитом.
8. В структуре ЮИА с увеитом преобладает полиартикулярный серонегативный по РФ вариант – 49,0% и олигоартикулярный вариант – 41,5%.
9. Сопутствующую базисную противовоспалительную терапию получают 44 (83%) пациента с ЮИА и увеитом, получающих ГИБТ, из них 42 пациента получают метотрексат.
Источник
Эпидемиология
Ювенильный ревматоидный артрит (ЮРА) чаще встречается у девочек и манифестирует, как правило, в возрасте до 16 лет (наиболее часто в 2—8 лет).
Классификация
Отсутствует.
Этиология
Этиология заболевания не установлена. Среди возможных факторов, лежащих в основе патологического процесса, обсуждаются инфекционная природа заболевания, травма, иммунологическая предрасположенность, стрессовые состояния.
Патогенез
Механизм возникновения переднего увеита, по-видимому, связан с возникновением аутоиммунной внутриглазной реакции вследствие молекулярной мимикрии.
Клинические признаки и симптомы
Поражение суставов может протекать в виде моно-, олиго- или полиартрита. Фактором риска развития воспалительного процесса в глазу служит наличие моно- или олигоартрита, при полиартрите передний увеит встречается довольно редко. В большинстве случаев определение ревматоидного фактора дает отрицательный результат.
Наиболее часто хронический иридоциклит возникает у девочек с моно- или олигоартритом нижних конечностей и наличием антинуклеарных антител. Вторую группу риска составляют мальчики с моно-или олигоартритом, у которых выявляется рецидивирующий негранулематозный передний увеит, имеющий сходство с таковым при анкилозирующем спондилоартрите. У 75% мальчиков с моно-или олигоартритом имеется антиген HLA-B27; у некоторых из них в дальнейшем развивается анкилозирующий спондилоартрит.
У больных с острыми увеитами заболевание суставов начинается в возрасте 7,5—9 лет, в то время как у больных с хроническими иридоциклитами — в возрасте 4—6,3 лет. Примерно у 50% больных к возрасту 6 лет выявляется хронический увеит. Обычно поражение глаз возникает через несколько лет после поражения суставов, однако известны случаи манифестации заболевания с развития переднего увеита, а поражение суставов возникало спустя 2 мес — 11 лет.
Прогноз при увеите у мальчиков сходен с таковым при увеите, ассоцированном с HLA-B27. У девочек, обычно негативных по HLA-B27 и позитивных по антинуклеарному фактору, хронический увеит в большинстве случаев протекает бессимптомно, поэтому они должны наблюдаться офтальмологом с целью своевременного выявления поражения глаз. Обычно у этих детей обнаруживается неправильная форма зрачка из-за появления задних синехий или даже заращение зрачка. Как правило, клеточная реакция влаги передней камеры не превышает 2+ и уменьшается при местном применении ГКС. Степень тяжести увеита не зависит от активности артрита. По мере роста ребенка активность воспалительных изменений в суставах может уменьшаться и вообще исчезнуть, а воспаление в глазах сохраняется довольно долго, вплоть до взрослого возраста.
К возможным осложнениям хронического увеита относятся развитие лентовидной дистрофии радужки, образование задних синехий, катаракта (в 60% случаев), гипотония глаза, глаукома (в 20% случаев). Глаукома развивается вследствие пупиллярного блока или нарушения оттока в трабекулярной зоне. Примерно в 50% случаев выявляется лентовидная кератопатия, наличие которой существенно снижает зрительные функции. У некоторых больных заболевание протекает с выраженным воспалением в стекловидном теле, отеком макулярной зоны сетчатки и образованием макулярных складок.
Диагноз и рекомендуемые клинические исследования
Диагноз устанавливают на основании особенностей клинической картины поражения глаз и суставов.
Лабораторные методы исследования:
- определение антинуклеарных антител у девочек (положительный результат);
- определение ревматоидного фактора (чаще отрицательный результат);
- общий анализ крови (увеличение СОЭ);
- определение антигена HLA-B27 (положительный результат у мальчиков; у девочек обычно отрицательный).
Дифференциальный диагноз
Наиболее часто поражение глаз при ЮРА приходится дифференцировать с саркоидозом. При последнем выявляются поражение суставов и кожи, реже изменения в легких. Отличительными признаками поражения глаз при ЮРА служат наличие антинуклеарного фактора, изменение суставов, первичное поражение переднего отрезка глаза и отсутствие системных симптомов, характерных для саркоидоза.
Общие принципы лечения
Как правило, лечение проводят в амбулаторных условиях. Больные с ЮРА и хроническим передним увеитом нуждаются в динамическом наблюдении с целью своевременной диагностики латентного воспалительного процесса, служащего фактором риска развития осложнений. Для профилактики образования синехий следует использовать мидриатики.
В активном периоде заболевания показано местное применение ГКС:
Циклопентолат, 1% р-р, в конъюнктивальный мешок по 1 —2 капли 2 р/сут, 5—10 сут
+
Дексаметазон, 0,1% р-р, в конъюнктивальный мешок по 1 —2 капли 3—6 р/сут, 15—30 сут
+
Диклофенак, 0,1% р-р, в конъюнктивальный мешок по 1 —2 капли 3 р/сут, 15—30 сут
+
(при выраженном воспалении)
Фенилэфинефрин, 1% р-р, субконъюнктивально 0,2 мл в сочетании с дексаметазоном 1мг (0,25 мл) 1 р/сут, 5—10 сут.
При неэффективности инстилляций и субконъюнктивального применения ГКС:
Дексаметазон парабульбарно 2—3 мг/сут, 5—10 сут
+
(после окончания курса)
Бетаметазон парабульбарно 1,0 мл 1 р/нед, 3—4 нед или
Метилпреднизолон (депо) парабульбарно 40 мг 1 р/нед, 3—4 нед.
Длительное системное применение ГКС нежелательно, поскольку сопровождается увеличением риска развития побочных эффектов (замедление роста, нарушение формирования костной ткани, атрофия коры надпочечников и др.). При необходимости продолжения лечения рекомендуется прием ГКС короткими курсами или пульс-терапия.
Пульс-терапия:
Дексаметазон, 20—32 мг в 200 мл изотонического р-ра натрия хлорида, в/в капельно в течение 30 мин утром 1 р/2 сут, 10—12 сут (общая доза 100—180 мг) или
Метилпреднизолон, 250—500 мг в 200 мл изотонического р-ра натрия хлорида, в/в капельно в течение 30 мин утром 1 р/2 сут, 10—12 сут (общая доза 1,5—3 г ) или
Дексаметазон внутрь 0,025—0,05 мг/кг 1—2 р/сут в первой половине дня, до полного исчезновения симптомов воспаления переднего отрезка глаза, с последующей постепенной отменой в течение 2—2,5 мес или
Метилпреднизолон внутрь 0,2—0,4 мг/кг 1—2 р/сут в первой половине дня, до полного исчезновения симптомов воспаления переднего отрезка глаза, с последующей постепенной отменой в течение 2—2,5 мес или
Преднизолон внутрь 0,25—0,5 мг/кг 1— 2 р/сут в первой половине дня, до полного исчезновения симптомов воспаления переднего отрезка глаза, с последующей постепенной отменой в течение 2— 2,5 мес.
В неактивном периоде заболевания использование ГКС нецелесообразно, поскольку сопровождается увеличением риска появления помутнений хрусталика и повышения внутриглазного давления.
При образовании катаракты показано ее удаление. Предпочтительнее проводить ленсвитрэктомию на фоне противорецидивной терапии. Поскольку само по себе заболевание протекает с пролиферативным компонентом, а после операции наблюдается выраженная экссудативная реакция, не следует прибегать к имплантации линзы.
Значительные трудности представляет собой лечение глаукомы; нередко требуются повторные оперативные вмешательства.
Оценка эффективности лечения
Адекватная терапия способствует исчезновению симптомов воспаления, однако возможно развитие рецидивов.
Осложнения и побочные эффекты
Длительное системное применение ГКС у детей сопровождается увеличением риска развития побочных эффектов (замедление роста, нарушение формирования костной ткани, атрофия коры надпочечников).
Ошибки и необоснованные назначения
Использование антибиотиков, неэффективных при этом заболевании.
Прогноз
Прогноз заболевания различен у девочек и мальчиков. У девочек вследствие бессимптомного течения нередко значительное снижение зрительных функций из-за развития осложнений (катаракта и/или глаукома). У мальчиков прогноз более благоприятный, так как адекватная терапия обычно способствует быстрому исчезновению симптомов воспаления, хотя возможны рецидивы заболевания, а по мере роста ребенка появление анкилозирующего спондилоартрита.
Шток В.Н.
Опубликовал Константин Моканов
Источник
Ильинская Е.В., Ядыкина Е.В., Дроздова Е.А.
Актуальность
Увеит при ювенильном идиопатическом артрите (ЮИА) относится к одной из наиболее сложных проблем детской офтальмологии. Частота увеита при ЮИА варьирует от 6 до 18%, а по данным ряда авторов достигает 30%. В структуре увеитов детского возраста доля увеита при ЮИА составляет 75% [6]. Увеит имеет тяжелое течение с развитием осложнений, которые составляют до 40% случаев и могут привести к снижению остроты зрения и к слепоте при отсутствии своевременного лечения [1-3].
Наиболее дискутабельными остаются вопросы о причинах развития воспалительного процесса в сосудистой оболочке глаза при ЮИА. В разрозненных публикациях по изучению увеита при ЮИА в разных странах мира приводятся сведения о тех или иных факторах риска развития увеита. Среди факторов риска особую роль отводят самому артриту, его субтипам, времени дебюта артрита, серопозитивности по антинуклеарному фактору, однако единого мнения на сегодняшний день не существует. [4-18].
Цель
Изучить факторы риска развития увеита, ассоциированного с ювенильным идиопатическим артритом.
Материал и методы
Проведено ретроспективное и проспективное исследование за период с 2008 по 2014 гг. Под наблюдением находилось 143 пациента, проходивших обследование и лечение в кардиоревматологическом отделении МБУЗ ДГКБ № 8 и офтальмологическом отделении стационара МБУЗ ДГКБ № 2 г. Челябинска с диагнозом: ювенильный идиопатический артрит (ЮИА), увеит на фоне ЮИА. Возраст детей варьировал от 2 до 18 лет, средний возраст 7,57±4,47 года. По половому составу наблюдалось 89 (62,2%) девочек и 54 (37,8%) мальчика.
Все пациенты обследованы у детского ревматолога согласно протоколу ведения пациентов с ЮИА (2013). На базе лаборатории МБУЗ ДГКБ № 8 были выполнены следующие диагностические тесты: клинический анализ крови, анализ мочи, определение белка в моче, микроскопическое исследование осадка мочи, анализ крови биохимический (сывороточная концентрация общего белка, альбумина, общего билирубина – прямая и непрямая фракции, креатиниа, мочевины, мочевой кислоты, трансаминаз, лактатдегидрогеназы, электролитов); иммунологический анализ крови (С-реактивный белок, ревматоидный фактор, комплимент, циркулирующие иммунные комплексы); определение антител классов А, М, G к сальмонелле кишечной, иерсинии энтероколитика, иерсинии псевдотуберкулеза, бруцелле, хламидиям (Chlamidia trachomatis), токсоплазме в сыворотке крови; определение антител классов М, G к цитомегаловирусу в крови; серологическое исследование крови на вирусы гепатитов В и С, герпеса I и II типа; обследованы на яйца глистов, лямблии.
Исследование цитокинового профиля (ФНО-α, ИНФ-γ , ИЛ-17, ИЛ-10) в сыворотке крови проводилось методом иммуноферментного анализа с применением набора реагентов, выпускаемых «Вектор-Бeст» (Новосибирск), на аппарате Personal Lab. (Adaltis, Италия) в лаборатории НИИ иммунологии ГБОУ ВПО ЮУГМУ Минздрава России (Челябинск). Результаты выражали в пг/мл. Исследованы следующие группы пациентов: 38 пациентов с увеитом на фоне ЮИА, 33 пациента с ЮИА, но без увеита, и 35 пациентов составила группа контроля (на момент обследования у них отсутствовали заболевания ревматической природы и другие острые заболевания).
Все данные обработаны статистически (IBM Statistics SPSS, 21). Достоверность различий рассчитывалась по U-критерию Манна-Уитни, применяемому для малых выборок; различия считались достоверными при р≤0,05. Для анализа результатов, полученных в ходе выполнения клинических и иммунологических исследований, использованы методы многомерной статистики. В своей работе мы использовали метод логистической регрессии.
Результаты и обсуждение
У 143 пациентов на основании обследования у ревматолога были выявлены следующие варианты ЮИА: олигоартикулярный – 96 (67,1%) пациентов; полиартикулярный – 31 (21,7%) пациент; системный – 8 (5,6%) пациентов, спондилоартрит – 3 (2,1%). У 5 (3,5%) пациентов с увеитом по результатам обследования ревматологом был выставлен предварительный диагноз ЮИА, несмотря на отсутствие суставного синдрома на момент обследования. Возраст дебюта ЮИА составил 6,08±3,9 года, девочки заболевали в более раннем возрасте (5,69±0,4), чем мальчики (6,77±0,6).
Всем пациентам, включенным в исследование, при постановке диагноза ЮИА детским ревматологом была назначена базисная терапия: метатрексат 128 (89,5%); циклоспорин 8 (5,6), преднизолон – 6 (4,2%), без базисной терапии – 1 (7%) ребенок.
На основании клинического офтальмологического обследования диагноз увеита был выставлен у 63 из 143 (44,1%) детей, из них 39 (62%) девочек и 24 (38%) мальчика. Диагноз увеита выставлялся в соответствии с рекомендациями рабочей группы по стандартизации номенклатуры увеитов (SUN, 2005).
Частота развития увеита зависела от клинического варианта артрита: при олигоартикулярном варианте ЮИА увеит возник у 43 пациентов (68,3%), при полиартикулярном варианте ЮИА – у 9 (14,3%) пациентов, на фоне системного варианта ЮИА – у 3 (4,8%), спондилоартирта – 3 (4,8%) детей. Увеит без суставного синдрома с предположительным диагнозом ЮИА, по данным ревматолога, наблюдался у 5 (7,8%) мальчиков.
Учитывая важную роль цитокинов в регуляции иммунных реакций следующим этапом нашего исследования было изучение уровня цитокинового статуса у трех групп пациентов детского возраста: первую группу составили 38 пациентов с увеитом, ассоциированным с ЮИА, вторую группу – 33 пациента с ЮИА без увеита и третью – контрольную группу – составили 35 детей у которых на момент обследования не было зарегистрировано острых и ревматичесих заболеваний. Группы пациентов были сопоставимы по возрасту и полу. Для изучения цитокинового профиля исследовали содержание цитокинов в сыворотке крови селективно продуцируемых Th-1 (ФНО-α, ИНФ-γ ), Th-17 (ИЛ-17) и Th-2 (ИЛ-10). Результаты представлены в табл. 1.
На основе анализа данных, приведенных в табл. 1, выявлено статистически достоверное повышение показателей ФНО-α, ИЛ-10, ИЛ-17 у больных с увеитом, ассоциированным с ЮИА, по отношению к группе пациентов с ЮИА без увеита и контрольной группе. При сравнении показателей уровня цитокинов в сыворотке крови у пациентов с увеитом, ассоциированным с ЮИА и пациентов с ЮИА без увеита, выявлено статистически достоверное повышение показателей ФНО-α, ИЛ-10, ИЛ-17. Уровень ФНО-α был выше в 1,2 раза, ИЛ-10 – в 1,8 раза, ИЛ-17 – в 1,1 раза. Уровень ИНФ-γ в группе пациентов с увеитом, ассоциированным с ЮИА, оказался достоверно ниже, чем в группе пациентов с ЮИА без увеита – в 1,2 раза.
В соответствии с целью нашего исследования мы проанализировали влияние различных факторов на развитие увеита у детей с ЮИА на фоне базисной терапии. Для этого нами был проведен логистический регрессионный анализ, который позволил выявить факторы риска развития увеита на фоне ЮИА.
Предикторы, которые учитывались нами при проведении логистического регрессионного анализа, были разделены на 2 группы: немодифицируемые: возраст дебюта ЮИА, пол и модифицируемые: данные анамнеза: аллергоанамнез (отягощен, не отягощен); кратность ОРВИ в течение года (до 4 раз в год, более 4 раза в год); недифференцированный синдром дисплазии соединительной ткани (есть, нет); клинико-иммунологические факторы: вариант ЮИА (олигоартикулярный, полиартикулярный, системный, спондилоартрит); активность ЮИА (активный, неактивный); базисная терапия ЮИА (метотрексат, циклоспорин, преднизолон, адалимумаб); Ig G к ВПГ 1, 2 типа в сыворотке крови (есть, нет); Ig G к ЦМВ в сыворотке крови (есть, нет); уровень ФНО-α в сыворотке крови (пг/мл); уровень ИНФ-γ в сыворотке крови (пг/мл); уровень ИЛ-10 в сыворотке крови (пг/мл); уровень ИЛ-17 в сыворотке крови (пг/мл).
Таким образом, всего в логистическом регрессионном анализе использовано 9 независимых переменных. В качестве зависимой переменной использовалась переменная группа (1 – дети с увеитом на фоне ЮИА и 2 – дети с ЮИА без увеита). Примененный метод позволил определить статистический «вклад» предикторов в модель. При оценке уравнений регрессии использовался метод пошагового включения предикторов (Stepwise Selection Procedure), ранжирующий признаки в соответствии с их вкладом в модель. Рассмотрим основные результаты итоговых вариантов предсказательной ценности признаков, представленных в табл. 2.
Как видно из табл. 2, из 9 предикторов, используемых в регрессионном анализе, методом пошаговой регрессии было оставлено только 4: ФНО-α, ИНФ-γ , ИЛ-17, IgG к ЦМВ. Наибольший вклад в развитие увеита на фоне ЮИА вносят такие переменные, как уровень ИЛ-17 в сыворотке крови и вирусная нагрузка (наличие IgG к ЦМВ в сыворотке крови).
Выводы
На основе проведенного математического анализа выявлены наиболее значимые факторы риска (предикторы) развития увеита у пациентов с ЮИА на фоне базисной терапии: ФНО-α, ИНФ-γ , ИЛ-17 и наличие IgG к ЦМВ. Влияние таких факторов, как пол, вариант ЮИА, базисная терапия, активность ЮИА на развитие увеита у пациентов с ЮИА, получающих базисную терапию системного заболевания, не выявлено.
Источник
