Золотой стандарт лечение артрита
Ювенильный идиопатический артрит (ЮИА) это наиболее распространенное ревматическое заболевание среди детей. В классификации Международной лиги ревматологических ассоциаций (League of Associations for Rheumatology, ILAR) (Durban, 1997 г.) выделяют следующие типы артрита. Системный вариант — это артрит, сопровождающийся лихорадкой в сочетании с летучей эритематозной сыпью, и/или серозитом, и/или генерализованной лимфаденопатией, и/или гепатомегалией, и/или спленомегалией. Олигоартикулярный вариант — это артрит с поражением от 1 до 4 суставов в течение первых 6 месяцев болезни, эта форма артрита является типичной для детей и не наблюдается у взрослых. Выделяется два подтипа олигоартрита: персистирующий олигоартрит — поражается от 1 до 4 суставов за весь период болезни и прогрессирующий олигоартрит — поражается 5 суставов и более после 6 месяцев болезни. Полиартикулярный вариант (негативный/позитивный по ревматоидному фактору) — это артрит с поражением 5 суставов или более в течение первых 6 месяцев болезни, ревматоидный фактор отрицательный/положительный соответственно. Псориатический артрит — поражение, проявляющееся артритом и псориазом или артритом и двумя из следующих симптомов: дактилитом/изменением ногтей/семейным псориазом, подтвержденным дерматологом у лиц 1-й степени родства. Энтезитный артрит — основными клиническими проявлениями являются артрит и энтезит или артрит, либо энтезит с двумя из следующих признаков: чувствительность сакроилеальных сочленений и/или боль в спине (воспаление)/обнаружение HLA-B27 в крови/семейный анамнез (HLA-B27-ассоциированные болезни у лиц 1-й или 2-й степени родства). Другие артриты — это артриты, причина возникновения которых неизвестна, персистирующие в течение 6 недель, не укладывающиеся в характеристику какой-либо категории или отвечающие критериям более чем одной категории. Группа неопределенных артритов включает пациентов, которые не удовлетворяют критериям включения в любую из категорий или которые отвечают критериям более чем одной категории [1].
У больных ЮИА часто встречается устойчивость к терапии различными препаратами, в том числе нестероидными противовоспалительными средствами (НПВС), а также к внутрисуставным инъекциям и физиотерапии [2]. Для лечения ЮИА используется несколько групп препаратов: НПВС, глюкокортикоиды (ГК), иммуносупрессивные препараты и биологически-активные вещества, полученные генно-инженерным путем. Применение НПВС и ГК оказывает обезболивающий и противовоспалительный эффекты, но не способствует предотвращению деструкции суставов и инвалидизации больных.
Известно, что иммуносупрессивная и биологическая терапии зачастую приостанавливают развитие системных проявлений и прогрессирование деструкции суставов. Иммуносупрессивная терапия должна быть дифференцированной, длительной и непрерывной, начинаться сразу после верификации диагноза в течение первых 3-6 месяцев болезни [3].
«Золотым стандартом» в терапии ЮИА можно считать метотрексат (МТХ) [2] — цитостатический препарат из группы антиметаболитов, антагонистов фолиевой кислоты.
МТХ оказывает выраженное иммуносупрессивное действие даже в относительно низких дозах, не характеризующихся заметной гематологической токсичностью. Несмотря на это, при приеме МТХ рекомендовано проводить клинико-лабораторный мониторинг, который необходим для предупреждения побочных эффектов [4]. По данным различных авторов около 70% пациентов, получающих терапию МТХ, входят в ремиссию по заболеванию.
В 1988 г. МТХ был разрешен Управлением по надзору за качеством пищевых продуктов и лекарственных средств США (Food and Drugs Administration of the United es, FDA) для лечения ревматоидного артрита [4]. В настоящее время МТХ является основным препаратом в лечении ЮИА [2]. Популярные терапевтические рекомендации по назначению МТХ основаны на рандомизированном двойном слепом плацебо-контролируемом исследовании, проведенном в 1992 г. В ходе исследования сравнивались группы пациентов с устойчивым к терапии артритом: получающие низкую дозу МТХ (10 мг/м2/нед), получающие очень низкую дозу МТХ (5 мг/м2/нед) и получающие плацебо. Результатом исследования стало повышение дозы МТХ у «плохоотвечающих» на терапию пациентов, так как уже появился длительный опыт применения МТХ. Отчеты еще одного исследования поддерживают использование высоких доз МТХ (25-30 мг/м2 или 0,8-1 мг/кг) у пациентов ЮИА, не отвечающих на стандартную дозу (10-15 мг/м2 или 0,3-0,5 мг/кг) [5]. Однако только одно исследование применения МТХ у детей сравнило эффективность высоких доз (30 мг/м2) МТХ со средней дозой МТХ (15 мг/м2) [6]. Никакой разницы в эффективности и токсичности терапии замечено не было. Более того, это исследование включило только детей с ЮИА, которые до исследования уже имели опыт терапии стандартной дозой МТХ без эффекта. Современные тенденции раннего и агрессивного лечения артритов сопровождаются практическим использованием высоких начальных доз МТХ как попыткой предотвратить поздние осложнения и нетрудоспособность, несмотря на отсутствие объективных клинических исследований, сравнивающих токсичность и эффективность при начальной высокой дозе и стандартной дозе МТХ для поддержки такой практики. По этой причине ученые не могут прийти к единому мнению, с какой дозы стоит начинать терапию МТХ у детей с ЮИА [7].
Ретроспективные данные о терапии метотрексатом у детей и подростков впервые были опубликованы в 1986 г. В метаанализе Giannini и соавт. сравнили МТХ (5-10 мг/м2/нед) с пенициламином, гидроксихлорокином и ауранофином. Только при применении МТХ в дозе 10 мг/м2/нед была отмечена положительная динамика по сравнению с плацебо. Эффективность терапии МТХ у детей была оценена в контролируемом исследовании, которое показало, что МТХ несколько эффективнее лефлуномида. В ходе исследования дети, в том числе подростки, в возрасте 3-17 лет, получали лефлуномид или МТХ в течение 16 недель. Группа, получающая МТХ, дала лучший ответ на терапию [2].
В 2011 г. Американской коллегией ревматологии (American College of Rheumatology, ACR) были выпущены рекомендации по лечению ювенильного идиопатического артрита. Авторами были рассмотрены 4 схемы терапии [8].
Первая схема относится к больным с поражением до 4 суставов. При отсутствии высокой активности рекомендуется начинать с монотерапии НПВС, в случае неэффективности и прогрессирования рекомендовано переходить к внутрисуставному введению ГК, в дальнейшем предусматривалось назначение МТХ. МТХ может быть заменен на сульфасалазин, у больных с энтезитассоциированной формой ЮИА. В случае высокой активности или быстрого прогрессирования рекомендовано начинать с внутрисуставных введений ГК или назначения в/м МТХ. При неэффективности этих схем или прогрессирования заболевания назначаются блокаторы фактора некроза опухоли альфа (ФНО-альфа).
Вторая схема предназначена для больных с поражением 5 суставов и более, таким пациентам рекомендовано назначение МТХ (или лефлуномида), а также возможно назначение НПВС и ГК (локально). Через 3-6 месяцев при отсутствии положительной динамики или сохранении активности рекомендуется назначать ингибиторы ФНО-альфа. В случае, если в течение 4 месяцев положительная динамика не получена, авторы предлагают назначение другого препарата анти-ФНО-альфа или абатацепта.
Для лечения детей с системным вариантом ЮИА используются две вышеописанные схемы. Третья схема предусматривает терапию пациентов с активными системными проявлениями, таким детям рекомендовано назначение системных ГК, в случае невысокой активности можно начинать с курса НПВС. В дальнейшем рекомендован переход на ингибитор интерлейкина-1 (ИЛ-1) (анакинру). В тяжелых случаях заболевания ингибитор ИЛ-1 предлагается как препарат выбора для начального лечения. В четвертой схеме описывается терапия пациентов с системным ЮИА, в настоящий момент имеющих активный артрит. Таким больным рекомендовано начинать терапию с МТХ в сочетании с НПВС и ГК (локально), затем через 3 месяца решать вопрос о назначении блокаторов ФНО-альфа или ингибитора ИЛ-1 (рис. 1).
По рекомендациям Американской коллегии ревматологии по лечению ЮИА 2011 г., больным, получающим терапию МТХ, необходимо проводить клинический анализ крови, определять уровни аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и креатинина в сыворотке крови перед назначением терапии, а также через 1 месяц после первого введения препарата. При повышении дозы МТХ необходимо контролировать показатели крови через 1-2 месяца после изменения дозировки. При нормальном течении заболевания и стабильной дозе МТХ рекомендовано повторять анализ крови 1 раз в 3-4 месяца [8].

В 2012 г. в журнале «Клиническая иммунология» были опубликованы немецкие рекомендации по лечению ЮИА [9]. При олигоартрикулярном варианте рекомендовано начинать терапию с НПВС, затем применяются внутрисуставные введения ГК, при неэффективности такой терапии назначается МТХ. Пациентам с полиартикулярной формой ЮИА в дебюте, кроме НПВС, рекомендовано назначать ГК как локально, так и системно. На втором этапе назначается МТХ. При сохранении активности добавляется терапия анти-ФНО-альфа, а при невысокой активности и недостаточном эффекте МТХ рекомендуется заменить его на препараты анти-ФНО-альфа. У больных с системным вариантом ЮИА, кроме НПВС, в дебюте назначаются ГК в виде пульс-терапии, на следующем этапе назначается МТХ, который в дальнейшем рекомендовано комбинировать с биологической терапией (рис. 2).
Ruperto и соавт. [10] провели исследование по применению более высоких доз для парентерального введения метотрексата (средняя доза 15 мг/м2/нед и высокая доза 30 мг/м2/нед). Результатом исследования стало, что больные, получившие высокие (30 мг/м2/нед) дозы МТХ, не дали большего терапевтического ответа, чем те пациенты, кто получил в средней дозе по 15 мг/м2.
Для корректного назначения МТХ необходимо рассчитать площадь поверхности тела (ППТ), для этого можно использовать формулу — ППТ = (рост × вес/3600), где ППТ — это площадь поверхности тела (м2), рост — рост (см), вес — масса тела (кг), кроме того, для определения ППТ можно использовать специальные таблицы (табл. 1).

Для достижения лучшего эффекта от терапии метотрексатом рекомендуется комбинирование с НПВС, а также с биологическими препаратами [2]. В 2011 г. в Финляндии K. J. Aaltonen и соавт. было проведено большое исследование по применению анти-ФНО-препаратов у детей с различными формами ЮИА. Результатом этого исследования стал вывод, что при комбинации препаратов анти-ФНО с МТХ эффективность значительно выше, чем после применения этих препаратов по отдельности [11].
В клинических рекомендациях для педиатров по детской ревматологии под редакцией А. А. Баранова и Е. И. Алексеевой изложены общепринятые схемы лечения ювенильного артрита и дозирования основных препаратов. Согласно этим рекомендациям у больных с олигоартритом МТХ применяется в дозе 10-15 мг/м2/нед, при полиартритическом варианте в дозе 15-25 мг/м2/нед, а при системном варианте рекомендовано назначать МТХ в дозе 20-25 мг/м2/нед (в случае неэффективности у больных с системным артритом назначается пульс-терапия с МТХ в дозе 50 мг/м2/нед, в течение 8 недель) [12].
Нами было проведено исследование, целью которого стала попытка определения эффективной концентрации МТХ в сыворотке крови у больных с ЮИА.
Было обследовано 103 ребенка больных ЮИА, среди которых — 65 (63,11%) девочек и 38 (36,89%) мальчиков с различными формами ювенильного идиопатического артрита. Детей с полиартритом — 46 (44,66%), с олигоартритической формой ЮИА — 25 детей (24,27%), системный вариант артрита диагностирован у 14 детей (13,59%), энтезитассоциированный артрит встречался у 18 больных (17,48%) (рис. 3).
Все дети, включенные в исследование, получали базисную терапию метотрексатом в дозе 15 мг/м2 в течение трех месяцев и более. У 35 пациентов (34%) к терапии МТХ добавлена биологически активная терапия (тоцилизимуб, этанерцепт, инфликсимаб, голимумаб, абатацепт), 11 пациентов (10,68%) получают в дополнение к терапии МТХ сульфасалазин (ССЗ), 24 ребенка (23,3%) — циклоспорин А (ЦсА), 37 детей (35,92%) — получают преднизолон или метилпреднизолон (в таблетках или в виде пульс-терапии). Обращает внимание, что у 46 (44,66%) пациентов наблюдается положительный эффект от монотерапии МТХ, не требующий назначения дополнительных препаратов (рис. 4).

С. A. Wallace и соавт. разработали критерии «неактивной» болезни. «Неактивная» болезнь — это отсутствие суставов с активным артритом, отсутствие лихорадки, сыпи, серозита, спленомегалии или генерализованной лимфоаденопатии, связанной с ЮИА, отсутствие обострения увеита, нормальные значения скорости оседания эритроцитов (СОЭ) или уровня С-реактивного белка и объективный осмотр, подтверждающий отсутствие активной болезни [13]. Все больные были разделены нами на две группы: с активной и неактивной болезнью. Концентрация МТХ в сыворотке крови в этих группах никак не отличалась (табл. 2).
По полученным нами данным, концентрация МТХ в сыворотке крови находилась в диапозоне от 0,76 ммоль/л до 3,96 ммоль/л. Достоверных различий в зависимости от активности заболевания, вида артрита, длительности терапии МТХ получено не было. Таким образом, определение концентрации МТХ в сыворотке крови у больных ЮИА не позволяет прогнозировать эффективность проводимой терапии.
МТХ обладает хорошим профилем безопасности. Для снижения риска развития побочных эффектов больным назначают фолиевую кислоту (в дозе 1-5 мг) в те дни, когда МТХ не используется, так как при одновременном приеме фолиевая кислота может снижать эффективность МТХ [12]. Важной особенностью применения этого препарата является использование 1 раз в неделю.
Использование цитостатической терапии (МТХ) является препаратом выбора во всех странах при терапии различных форм ЮИА и является «золотым стандартом» лечения пациентов с этим заболеванием.
Литература
- Ravelli A., Martini A. Juvenile idiopathic arthritis // Lancet. 2007. 369, 767-778.
- Niehues T., Lankisch P. ations for the Use of Methotrexate in Juvenile Idiopathic Arthritis // Pediatric Drugs. 2006. P. 347-356.
- Алексеева Е. И., Бзарова Т. М. Ювенильный артрит: возможности медикаментозного и немедикаментозного лечения на современном этапе // Лечащий Врач. 2011. № 8.
- Khan Z. A., Tripathi R., Mishra B. Methotrexate: a detailed review on drug delivery and clinical aspects // Expert Opin. Drug Deliv. 2012. Vol. 9 (2). P. 151-169.
- Wallace C. A., Sherry D. D. Preliminary report of higher dose methotrexate treatment in juvenile rheumatoid arthritis // J Rheumatol. 1992. Vol. 19. P. 1604-1607.
- Ruperto N., Murray K. J., Gerloni V. et al. A randomized trial of parenteral methotrexate comparing an interte dose with a higher dose in children with juvenile idiopathic arthritis who failed to respond to standard doses of methotrexate // Arthritis Rheum. 2004. Vol. 50. P. 2191-2201.
- Becker M. L., Rose C., Cron R. et al. Effectiveness and Toxicity of Methotrexate in Juvenile Idiopathic Arthritis: Comparison of 2 Initial Dosing Regimens // J Rheumatol. 2010. P. 870-875.
- Beukelman T., Patkar N., Saag K. et al. 2011 American College of Rheumatology ations for the Treatment of Juvenile Idiopathic Arthritis: Initiation and Safety Monitoring of Therapeutic Agents for the Treatment of Arthritis and Systemic Features // Arthritis Care & Re. 2011. P. 465-482.
- Dueckers G., Guellac N., Arbogast M. Evidence and consensus based GKJR guidelines for the treatment of juvenile idiopathic arthritis // Clinical Immunology. 2012. 142. P. 176-193.
- Kahn P. Juvenile Idiopathic Arthritis Current and Future Therapies // Bulletin of the NYU Hospital for Joint Diseases. 2009, 67 (3). P. 291-302.
- Aaltonen K., Virkki L., Malmivaara A. et al. Systematic Review and -Analysis of the Efficacy and Safety of Existing TNF Blocking Agents in Treatment of Rheumatoid Arthritis // Plos ONE. 2012. Vol. 7, Issue 1. P. 1-14.
- Клинические рекомендации для педиатров: детская ревматология. Лекарственные средства, применяемые для лечения ревматических болезней у детей. Баранов А. А., Алексеева Е. И. 2011, с. 206-207.
- Wallace C. A. Current management of juvenile idiopathic arthritis // Best Practice & Re Clinical Rheumatology. 2006. P. 279-300.
Ф. В. Рохлина
Г. А. Новик, доктор медицинских наук, профессор
ГБОУ ВПО СПбГМПУ МЗ РФ, Санкт-Петербург
Контактная информация об авторах для переписки: faina.rokhlina@gmail.com
Источник
Программа лечения Врачи Цены Отзывы
В последнее время тактика лечения ревматоидного артрита значительно изменилась. Новое в лечении ревматоидного артрита — это отказ от выжидательной позиции и раннее назначение агрессивного курса терапии. Это привело к тому, что специалистами была признана обратимость патологического процесса на ранних стадиях заболевания при назначении активной терапии сразу после установления диагноза.
Врачи клиники «Парамита» используют самые современные методы и лекарственные препараты для помощи больным ревматоидным артритом, сочетая их назначение с методами восточной терапии.
Ревматоидный артрит в цифрах
По современным представлениям ревматоидный артрит (РА) — это сложное многофакторное, хроническое, неуклонно прогрессирующее, системное аутоиммунное заболевание, в основе которого лежит длительный воспалительный процесс в организме с язвенно-деструктивным поражением и разрушением суставов.
Причины ревматоидного поражения связывают в основном с генетической предрасположенностью, вирусными инфекциями и многочисленными внешними пусковыми факторами. Код серопозитивного РА по МКБ — 10 M05.0, серонегативного — 10 M06.0.
Поражение РА населения составляет около 1% всего населения земного шара. Болеют лица любого возраста, от младенцев до пожилых людей, чаще женщины. По статистике ревматоидный артрит был установлен на 1-м году заболевания у 57,9% пациентов, остальные лечились по поводу недифференцированного (неустановленного вида) артрита (НДА), а это значит, не получали необходимой терапии. Еще через год у 33% больных этой группы был выявлен РА, то есть, их лечение замедлилось еще почти на год.
Новейшие принципы лечения РА
В последние десятилетия сформировались основные принципы терапии ревматоидных поражений, их придерживаются специалисты всего мира.
Принцип первый — ранее выявление
Лечить ревматоидные процессы непросто, результат во многом зависит от результатов обследования, установленного диагноза и предполагаемого прогноза болезни. Выявить ревматоидную патологию на ранней стадии сложно, так как похожие симптомы наблюдаются и при других заболеваниях. Поэтому очень большое значение придается выявлению РА и установлению развернутого диагноза, позволяющего сделать прогноз течения болезни у данного больного и назначить ему адекватные лечебные мероприятия.
 Диагностика ревматроидного артрита
Диагностика ревматроидного артрита
Диагноз ревматоидного артрита ставится на основании:
- Характерных симптомов болезни.
- Данных лабораторных исследований, подтверждающих наличие РА:
- низкий гемоглобин или снижение числа эритроцитов — анемия;
- ускоренная СОЭ, высокие показатели СРБ — признак воспаления;
- наличие/отсутствие ревматоидного фактора (РФ положительный или отрицательный);
- наличие/отсутствие антител к цитруллину (АЦЦП);
- наличие в крови цитокинов, поддерживающих воспаление (ФНО альфа, ИЛ-1 и др.).
- Данных инструментальных исследований, подтверждающих диагноз:
- рентгенография — выявляется рентгенологическая стадия суставных поражений;
- МРТ — самый точный метод, позволяющий выявить нарушения, еще незаметные на рентгене;
- УЗИ — выявляются изменения суставных и околосуставных тканей.
В диагнозе обязательно отражается активность патологического процесса, она очень важна для прогноза заболевания. Индекс активности ревматоидного артрита — DAS-28 рассчитывается позволяет оценить состояние пораженных суставов и общее состояние здоровья.
ФК (функциональный класс) ревматоидного процесса позволяет оценить сохранность трудовых навыков. По степени их нарушения выделяют 4 ФК.
Диагноз должен включать в себя клиническую и рентгенологическую стадии заболевания, активность патологического процесса, наличие/отсутствие РФ и системных поражений. Это позволит подобрать больному наиболее подходящую схему лечения.
Принцип второй — раннее назначение медикаментозной терапии
Схемы лечения ревматоидного артрита нового поколения учитывают клинически подтвержденный факт, что при раннем назначении активных лечебных мероприятий патологический процесс можно остановить и даже повернуть вспять. Поэтому главной целью является раннее выявление заболевания с назначением адекватного лечения, а непосредственными задачами:
- устранение болевого синдрома;
- подавление прогрессирования заболевания болезни;
- достижение состояния стойкой ремиссии;
- предупреждение двигательных нарушений;
- повышение качества жизни больного.
Современная тактика ведения ревматоидных поражений — это агрессивная тактика, когда больному назначается комплексное лечение с максимальными дозировками основных (базисных) противовоспалительных препаратов (БПВП). При этом противовоспалительные средства подбираются по результатам обследования. Раз в квартал проводится текущее обследование с целью проверки результативности проводимой базисной терапии. В состав медикаментозной терапии обязательно вводятся биологические препараты.
 Раннее назначение агрессивной медикаментозной терапии
Раннее назначение агрессивной медикаментозной терапии
Принцип третий — сокращение симптоматической терапии
Новое в лечении ревматоидного артрита — это еще и подход к симптоматической терапии. Сейчас отказались от стандартных схем применения обезболивающих и общих противовоспалительных средств. Их назначают строго индивидуально при наличии воспалительной боли и обязательно сочетают с приемом базисных медицинских препаратов.
Допускается даже нерегулярный прием лекарств из группы нестероидных противовоспалительных препаратов (НПВП) — их принимают по мере необходимости максимально короткими курами или одноразово, используя только один препарат этой группы. Это связано с побочными эффектами НПВП — они вызывают эрозивно-язвенные поражения желудочно-кишечного тракта (ЖКТ). Еще одна опасность применения этой группы препаратов в том, что на ранних стадиях заболевания они быстро снимают все симптомы заболевания и создают иллюзию полного выздоровления. Это часто приводит к отказу больного от дальнейших лечебных мероприятий и прогрессированию ревматоидного процесса.
Еще одна группа препаратов для лечения ревматоидных поражений — глюкокортикостероиды (ГКС). Они оказывают, как симптоматическое, так (частично) и патогенетическое действие, подавляя процесс разрастания соединительной ткани в суставах, деструкцию хрящевой и костной ткани. На первых начальных стадиях ревматоидного процесса их назначают только при наличии выраженного болевого синдрома воспалительного характера — ГКС отлично снимают воспаление и боль, после чего их отменяют.
Но есть категории больных, в основном это лица преклонного возраста, которым не подходят препараты базисной терапии. В таких случаях эту роль берут на себя ГКС, назначаемые продолжительными курсами в низких дозировках. Иногда их вводят в суставы. Назначение их требует регулярного обследования больного из-за возможных побочек: остеопороза, язвенных процессов в ЖКТ и т.д.
В последние годы препараты этой группы все чаще назначают короткими курсами в высоких дозировках (пульс-терапия). Показаниями для таких процедур лечения являются тяжелые системные поражения (сердца, печени, почек).
Принцип четвертый — двигательная активность
Она необходима для профилактики контрактур и анкилозов (снижение объема движений в суставе или его полная неподвижность), а также мышечных атрофий необходима даже в период обострений — назначается щадящий комплекс лечебной физкультур — ЛФК. По мере улучшения состояния больного нагрузки увеличиваются.
Одновременно назначаются курсы лечебного массажа и физиотерапевтических процедур, усиливающих эффект ЛФК. Для сохранения нормального положения конечности назначают ношение ортезов, но только по нескольку часов в день — постоянное ношение ортезов считается неприемлемым. Двигательная активность значительно улучшает качество жизни больных с ревматоидными поражениями.
Препараты для медикаментозного лечения
Все препараты от ревматоидного артрита делятся на симптоматические и базисные. Симптоматические — это НПВП и ГКС, а базисные — синтетические и биологические.
НПВП
Лекарственные средства этой группы угнетают образование фермента циклооксигеназы (ЦОГ). ЦОГ делится на два вида: ЦОГ-2, участвующую в синтезе простагландинов, поддерживающих воспаление и боль, и ЦОГ-1, поддерживающую синтез простагландинов, стимулирующих секрецию слизи в органах пищеварения и защищающих стенки органов от различных воздействий.
Первые препараты группы НПВП — Диклофенак, Кетанов, Ибупрофен и др. эффективно подавляли оба вида ЦОГ, поэтому давали много побочных эффектов со стороны ЖКТ. Но Диклофенак и сегодня считается очень эффективным лекарством, его назначают короткими курсами для снятия боли и воспалительного процесса. Для мазей с НПВП ограничений в применении нет.
 Симптоматические препараты для медикаментозного лечения
Симптоматические препараты для медикаментозного лечения
НПВП, подавляющие только ЦОГ-2 (Нимесулид, Мелоксикам), — это лекарства нового поколения. Они обладают селективным (избирательным) действием и почти не имеют побочного действия на ЖКТ при правильном применении. Они также применяются в современной практике.
Глюкокортикоидные гормоны
Глюкокортикоиды (Преднизолон, Дексаметазон, Метипред) назначаются при тяжелом течении ревматоидных процессов, сильных болях и поражении внутренних органов. В зависимости от состояния пациента эти препараты назначают или достаточно длительно малыми дозами (например, пожилым больным с противопоказаниями для базисной терапии), или короткими курсами очень большими дозами (пульс-терапия). Введение гормональных препаратов в полость сустава может приостановить его воспаление и формирование контрактуры.
Синтетические базисные противовоспалительные препараты
Синтетические базисные препараты применяются достаточно давно, но не потеряли своей актуальности. Курс начинается с назначения одного препарата этой группы. При высокой активности РА лечение начинают с Метатрексата, при средней и небольшой — с Сульфасалазина или Плаквенила. За эффективностью терапии тщательно наблюдают и если эффект есть, но недостаточный, присоединяют еще один базисный препарат (синтетический или биологический). Если эффекта нет, препарат меняют.
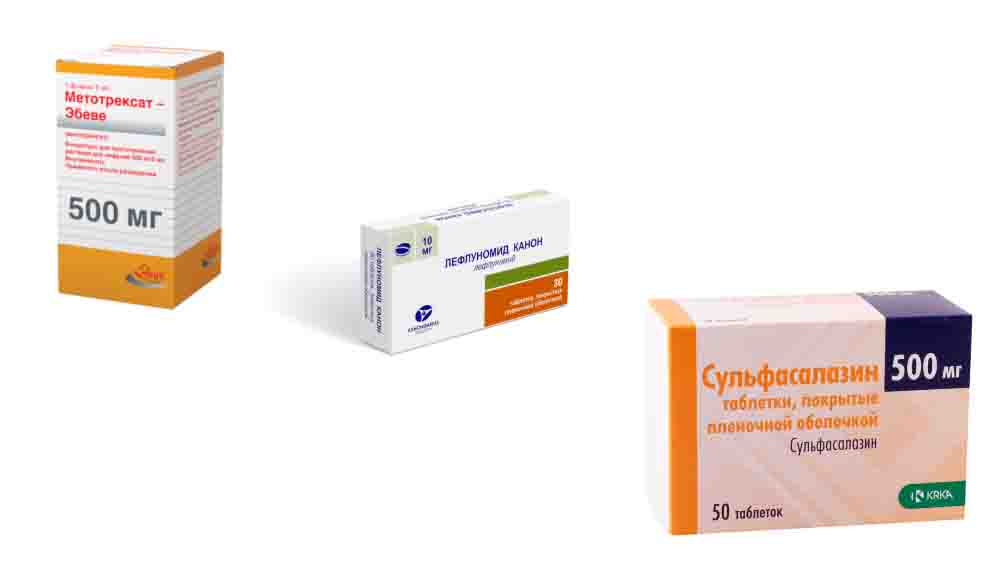
- БПВП первого ряда — назначаются в первую очередь:
- Метотрексат — считается «золотым стандартом» лечения РА базисными средствами; оптимальное сочетание лечебного действия и побочных эффектов; механизм действия связан с подавлением иммунных и воспалительных процессов, а также разрастания клеток соединительной ткани в синовиальной оболочке и разрушения хрящевой ткани; назначается длительными курсами до 4 — 5 лет; хорошо сочетается с Сульфасалазином, а еще лучше с Лефлуномидом;
- Сульфасалазин — таблетки с противовоспалительным и противомикробным действием;
- Лефлуномид — лекарство нового поколения этой группы; препарат тормозит активацию иммунной системы, оказывает противовоспалительное действие, подавляет процесс разрушения суставов.
- БПВП второго ряда — назначаются, если не подходят препараты 1-го ряда или в сочетании с ними. Это препараты:
- Плаквенил;
- Тауредон (соли золота);
- Циклоспорин А;
- Азатиоприн;
- Циклофосфамид.
 БПВП первого ряда для лечения ревматроидного артрита
БПВП первого ряда для лечения ревматроидного артрита
Биологические (генно-инженерные) БПВП — биологические агенты
Это новый метод лечения ревматоидного артрита. Лекарства данной группы — препараты нового поколения, оказывающие прицельное действие на провоспалительные (поддерживающие ревматоидное воспаление) цитокины (ИЛ-1, ФНО- альфа) или на рецепторы иммунных клеток лимфоцитов. Избирательность действия этих препаратов нового поколения позволяет свести к минимуму их побочные эффекты:
- Инфликсимаб (Ремикейд) — препарат содержит антитела к ФНО-альфа, оказывает противовоспалительное действие, тормозит развитие соединительной ткани и разрушение суставов; перспективным считается сочетание Инфликсимаба и Лефлуномида; аналогичным действием обладают препараты Адалимумаб и Этанерцепт;
- Анакинра — антитела к цитокинам ИЛ-1, оказывает противовоспалительное действие, предупреждает разрушение больных суставов;
- Тоцилизумаб — антитела к цитокинам ИЛ — 6 — аналогичное действие;
- Абатацепт — препарат содержит моноклональные антитела к рецепторам Т-лимфоцитов, отвечающих за клеточный иммунитет; отлично купирует аутоиммунные воспалительные процессы;
- Ритуксимаб — моноклональные антитела к рецепторам В-лимфоцитов, отвечающих за гуморальный иммунитет (образование антител).
Внутрисуставные инъекции гиалуроновой кислоты
Хондропротекторы что это как выбрать, насколько они эффективны
Сочетание синтетического базисного препарата Лефлуномида с биологическими препаратами (чаще всего с Инфликсимабом) отлично переносится больными и позволяет значительно улучшить результативность медикаментозной терапии ревматоидных поражений, особенно в случае неэффективности применения одного препарата (например, Метотрексата).
Дополнительные методы
Особенностью современных методов лечения ревматоидных поражений является назначение изотонических (статических) упражнений при высокой активности воспалительного процесса. Упражнения выполняются лежа с постепенным наращиванием нагрузки.
Физиопроцедуры используются на всех этапах лечебных мероприятий. В период ремиссии особенно эффективно санаторно-курортное лечение и особенно лечебные грязи.
 Физиопроцедуры используются на всех этапах лечения ревматроидного артрита
Физиопроцедуры используются на всех этапах лечения ревматроидного артрита
Для профилактики деформаций конечностей активно используются ортезы — приспособления, удерживающие конечность в правильном положении. Ношение ортеза сочетают с ЛФК, массажем и плаванием в бассейне.
Назначение индивидуально подобранной медикаментозной терапии в сочетании с дополнительными методами на ранних сроках ревматоидных поражений (в первые 3 месяца от начала заболевания) позволяет подавить прогрессирование патологического процесса и добиться стойкой ремиссии. Применение этих методов на поздних стадиях значительно улучшает качество жизни больного.
Подход к лечению ревматоидного артрита в нашей клинике
Специалисты клиники «Парамита» проходили подготовку в лучших европейских клиниках, а также в клиниках Китая и Тибета. Это позволяет значительно расширить спектр методов лечения ревматоидного артрита, сочетая передовые западные методики с проверенными столетиями восточными методиками. Обязательным условием назначения лечебных процедур является предварительное обследование и постановка развернутого диагноза. Наши специалисты используют следующие методы:
- медикаментозная терапия — применяются новейшие схемы назначения современных лекарственных препаратов; подбор схем и препаратов производится так, чтобы они идеально сочетались с другими лечебными мероприятиями;
- фитотерапия, народные способы, гомеопатия — все это входит в общую схему лечения для усиления эффективности и снижения лекарственной нагрузки;
- кинезитерапия, тейпирование, курсы ЛФК — все подбирается индивидуально для каждого пациента;
- физиопроцедуры — назначаются строго в соответствии со стадией заболевания;
- PRP-терапия — современный метод, позволяющий восстанавливать измененные ткани; основан на введении пациенту собственных тромбоцитов, обработанных по особой методике;
- рефлексотерапия (РТ) — древнекитайский метод; используя его, опытный врач может вылечить практически любое заболевание или просто остановить его прогрессирование;
- фармакопунктура — введение современных лекарств в акупунктурные точки — высокоэффективное сочетание восточных и западных методов.
Такой широкий выбор методик позволяет специалистам клиники «Парамита» в Москве быстро и эффективно справляться с болями и воспалением, характерных для ревматоидного артрита, а также предупреждать разрушающее воздействие болезни на суставы. Врачи нашей клиники не проходят мимо новых методов лечения РА и новых препаратов, не забывая старые методы, поэтому смогут помочь больному на любой стадии заболевания!
Литература:
- Яременко О.Б. Глюкокортикоиды в ревматологии: современная номенклатура дозовых режимов и рациональное применение // Укр. ревматол. журн. — 2002. — № 3. — С. 20-26.
- Яременко О.Б. Ранний ревматоидный артрит: диагностика и лечение // Мистецтво лікування. — 2004. — № 3. — С. 38-45.
- Ahmed K., Emery P. A case for early aggressive therapy. In: Bird H.A., Snaith M.L. (Еds.) Challenges in Rheumatoid Arthritis. Blackwell Science, Oxford, England, 1999. — Р. 106-115.
- Albers J.M., Paimela L., Kurki P. et al. Treatment strategy, disease activity, and outcome in four cohorts of patients with early rheumatoid arthritis // Ann Rheum Dis. — 2001. — Vol. 60. — P. 453-458.
Источник
