Интенсивная терапия при ревматоидном артрите
Е. А. Асеева
С. К. Соловьев, доктор медицинских наук
Ю. В. Суханов, кандидат медицинских наук
Институт ревматологии РАМН, Москва
Ревматоидный артрит (РА) является одним из наиболее распространенных хронических воспалительных заболеваний суставов, частота которого в популяции составляет от 0,3 до 1,5%. Существует ряд причин, обусловливающих высокую медицинскую и социальную значимость РА.
Постоянные боли, прогрессирование деструкции суставов и нарушение функции приводят к ухудшению качества жизни и ранней инвалидизации. В ряде случаев развивается злокачественный вариант течения заболевания с быстрым и множественным поражением суставов, развитием резистентности к проводимой терапии и тяжелыми нарушениями функций внутренних органов. Ревматоидным артритом заболевают лица преимущественно молодого трудоспособного возраста, что является одной из причин существенного экономического ущерба.
Генерализованное аутоиммунное воспаление, свойственное РА, приводит к развитию синовита, разрушению хряща и катаболических нарушений (например, генерализованного остеопороза). При тяжелых формах РА, при неадекватной терапии или при длительном течении иммунокомплексный васкулит вызывает развитие внесуставных или системных проявлений заболевания. К системным проявлениям РА относятся подкожные ревматоидные узелки, лимфаденопатия, сетчатое ливедо, гепатоспленомегалия, полинейропатия, язвы голеней и др. Системные проявления ревматоидного артрита и множественное поражение суставов предопределяют использование всего арсенала противоревматических препаратов и методов терапии. Традиционным подходом к терапии РА является сочетание противовоспалительных препаратов (НПВП или глюкокортикостероидов) и базисных или иммуномодулирующих/иммуносупрессивных агентов (соли золота, сульфасалазин, D-пеницилламин, антималярийные, цитостатические: азатиоприн, хлорбутин, метотрексат, циклофосфан). В последние годы широко используется комбинированная терапия, которая предполагает применение одновременно нескольких базисных препаратов. Но даже самые современные терапевтических программы, включая применение антицитокиновых антител и комбинированной терапии, эффективны не более чем у 50–70% пациентов. Эффект лечения, как правило, не стоек, а ремиссия достигается менее чем у 10% пациентов с серопозитивным РА. Вследствие этого одной из актуальных проблем ревматологии остается разработка новых способов лечения РА, особенно у больных с высокой клиниколабораторной активностью, когда требуется быстрое подавление воспалительного процесса при прогрессировании эрозивных изменений суставов и резистентности к проводимому лечению. Особую, трудноразрешимую проблему представляет собой кортикостероидная зависимость, непереносимость БП и развитие васкулита. Поэтому в последние годы большое внимание уделяется интенсивным методам лечения: различным видам аферезов, большим дозам метотрексата и пульс-терапии (рис. 1).
Одним из перспективных методов лечения больных с рефрактерным РА может быть комбинированное применение плазмафереза и высоких доз метотрексата и метипреда. В этой связи нам представилось целесообразным разработать оптимальную схему синхронной интенсивной терапии (СИТ) для лечения больных с рефрактерным РА, включающую ПФ, высокие дозы метипреда и МТ.
Работа проводилась в клинике Института ревматологии РАМН в 1999-2000 годах. В исследование были включены 19 больных РА, строго соответствующих критериям АСR. У всех 19 больных отмечалась высокая клинико-лабораторная активность, прогрессирование рентгенологических изменений и непереносимость или неэффективность предшествующей базисной терапии; преднизолон до включения в программу получали 7 пациентов в дозе 20-5 мг в сутки, с малым эффектом. Во всех случаях применялись ежемесячно внутрисуставные инъекции кортикостероидов.
У 14 пациентов выявлялись такие системные проявления, как, ревматоидные узелки, лимфаденопатия, лихорадка, сетчатое ливедо, гепатоспленомегалия.
Синхронная программная интенсивная терапия осуществлялась в два этапа. В течение первого этапа пациентам проводили три сеанса плазмафереза с интервалом между процедурами в два-три дня с эксфузией 1200-1500 мл плазмы и синхронным введением 40 мг метотрексата и 250 мг метипреда. Второй этап терапии заключался в проведении плазмафереза с синхронным введением 250 мг метипреда и 40 мг метотрексата один раз в неделю в течение трех последующих недель. После окончания второго этапа агрессивной терапии всем больным назначался метотрексат в дозе 20 мг внутримышечно.
Для оценки клинико-лаборатоных изменений, а также регистрации побочных реакций больным проводилось обследование: до начала терапии, через неделю, через месяц, два месяца, четыре месяца и через год.
Через неделю и месяц терапии у 19 пациентов отмечено быстрое клиническое улучшение, уменьшение выраженности артралгий, исчезновение артритов.
Демонстративными стали изменения показателей воспалительной акстивности: СОЭ и СРБ. У 6 больных уже после недели лечения полностью нормализовалось СОЭ, которое сохранялось в пределах нормы и после месяца проведения терапии. У 7 пациентов показатели СОЭ плавно снижались в течение месяца. Во всей группе наблюдалось и снижение уровня СРБ от высоких показателей в начале исследования до нормальных через неделю и месяц.
Особый интерес представляла динамика системных проявлений. Исчезновение лихорадки и лимфаденопатии отмечено во всех случаях уже через неделю после начала лечения. Ревматоидные узелки исчезли через месяц у 6 больных, уменьшились в размерах у 4. Ливедо сохранялось у 2 больных через неделю и месяц от начала проведения терапии, однако интенсивность его значительно уменьшилась. Определенная положительная динамика наблюдалась у больных с кортикостероидной зависимостью — в течение месяца на фоне интенсивной терапии преднизолон был полностью отменен у 2 пациентов, у 5 суточная доза была снижена. Все больные продолжали получать НПВП, однако их ежедневная доза была уменьшена.
Оценка отдаленных результатов интенсивной терапии проводилась на различных этапах исследования. Годовую контрольную точку миновали 4 больных (3 мужчины и 1 женщина). На момент последнего обследования у этих пациентов наблюдается клинико-лабораторная ремиссия без развития побочных эффектов терапии, больные продолжают получать метотрексат в дозе 20 мг в неделю.
Контрольную точку четыре месяца прошли 9 человек. У 7 пациентов сохранялась положительная динамика суставного синдрома и лабораторных показателей. Отмена МТ из-за развития аллергической реакции зафиксирована у 1 больного. Контрольную точку два месяца миновали 12 больных. Во всех случаях наблюдался отчетливый эффект от проведения терапии.
Несмотря на агрессивность проводимой терапии, побочные эффекты были минимальны и встречались в основном на первом этапе лечения.
В одном случае при проведении плазмафереза возникал озноб, который легко купировался медикаментозными средствами.
В одном случае после внутривенного введения 40 мг метотрексата отмечались явления диспепсии и афтозный стоматит, печеночные ферменты при этом не менялись.
В четырех случаях после процедур отмечалась тошнота, которая проходила к концу дня.
У 5 пациентов через несколько часов или на следующий день наблюдалась кратковременная гиперемия лица и тахикардия.
В одном случае после пятого внутривенного введения метотрексата развился аллергический дерматит. Увеличение трансаминаз наблюдалось у 2 пациенток через два месяца после начала лечения.
Современные варианты лечения РА
В настоящее время по-прежнему идут дискуссии о целесообразности применения ПФ при РА. В середине 70-х годов после публикаций G. Jaffe проводились многочисленные попытки использования ПФ у больных с РА. Применение ПФ не было стандартизовано, обычно проводилось от двух до шести сеансов с удалением как небольшого количества плазмы (600-800 мл), так и значительной ее части (6000 мл) за сеанс. В большинстве случаев эффект наступал быстро, но стойко держался не более одной-трех недель с постепенным развитием обострения. Впоследствии было выявлено, что волна обострения заболевания обусловлена развитием так называемого синдрома рикошета, возникающего в результате увеличения продукции аутоантител в ответ на удаление из циркуляции большого количества иммуноглобулинов, и в их числе ревматоидного фактора и иммунных комплексов.
Проблема развития синдрома рикошета привела исследователей к мысли о необходимости синхронизации (сочетания) ПФ с глюкокортикостероидами или цитостатиками в различных комбинациях. Так, одни исследователи применяли 4 мг дексазона до процедуры, другие вводили внутривенно до 600 мг циклофосфана после каждой процедуры. L. Lepore и др. (1987) проводили три-четыре сеанса плазмафереза при ювениальном РА с системными проявлениями при последующем назначении азатиоприна в течение шести месяцев. Идея синхронного применения ПФ и пульс-терапии ЦТ и КС нашла свое отражение в исследованиях J. O. Schroder и H. H. Euler, которые использовали комбинацию ПФ и циклофосфана у больных СКВ. Единичные случаи успешного сочетания ПФ и ПТ описаны у больных «злокачественным» РА.
Другим направлением стало совершенствование способов экстракорпоральной терапи; создавались фильтрационные системы, обладающие избирательной проницаемостью, способные селективно удалять патологические субстанции. В последние годы для лечения РА широко используется гранулоцитоферез (G 1 column), лейкоцитоферез (Cell sorba), а также различные иммуносорбенты (Prosorba column), что патогенетически обосновано, учитывая активную роль в развитии РА различных цитокинов и других различных медиаторов воспаления и ревматоидного фактора.
Наши данные свидетельствуют о достижении быстрого терапевтического эффекта синхронной иммунотерапии у больных с рефрактерным РА. Так, плазмаферез способствовал подавлению системных проявлений РА, которые обычно обусловлены иммунокомплексным васкулитом, путем выведения из циркуляции ИК, в то время как пульс-терапия метотрексатом и введение метипреда подавляли выработку антител, снижали активность лимфоидных клеток. Наше лечение позволило достичь быстрого и статистически достоверного положительного эффекта. Дальнейшее исследование покажет его длительность, хотя у двоих из десяти пациентов, находящихся под нашим наблюдением в течение года, отмечается клинико-лабораторная ремиссия.
Таким образом, синхронную программную интенсивную терапию можно считать эффективным методом лечения РА, позволяющим добиться быстрого клинического улучшения, особенно при тяжелых вариантах течения болезни с системными проявлениями, резистентностью к основным базисным средствам, кортикостероидной зависимостью. Возможно, применение этой схемы терапии позволит у ряда больных достичь ремиссии заболевания. Поскольку программа находится в процессе разработки, дальнейшее совершенствование ее техники будет способствовать существенному повышению эффективности методов интенсивной терапии.
Показания к назначению интенсивной терапии у больных РА
- Наличие системных проявлений (подкожные ревматоидные узелки, лимфаденопатия, сетчатое ливедо, гепатоспленомегалия, полинейропатия, язвы голеней и др.)
- Для уменьшения стероидозависимости и улучшения качества жизни
- При торпидном течении, неэффективности основных базисных препаратов
- Синдром Стилла, синдром Фелти
Источник
Статья посвящена ревматоидный артриту — клиническим ситуацииям и алгоритмам лечения

Ревматоидный артрит (РА) – хроническое системное иммуновоспалительное заболевание неизвестной этиологии, сопровождающееся развитием симметричного прогрессирующего эрозивно-деструктивного полиартрита и внесуставными проявлениями [1]. РА ассоциирован с высоким риском кардиоваскулярных событий, остеопоротических переломов, ранней инвалидизацией и преждевременной смертностью пациентов. Улучшить прогноз и исходы болезни способны только своевременная диагностика и раннее активное лечение больных РА.
Течение болезни складывается из нескольких последовательных стадий: ранней, развернутой и поздней, каждая из них имеет свои клинические особенности и подходы к терапии.
Базовые принципы терапии РА («Treat to target» или «Лечение до достижения цели») [2, 3]:
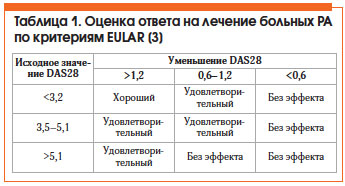
1. Достижение ремиссии (DAS28 (суммарный индекс (включает упрощенный счет из 28 суставов), позволяет многократно оценивать активность РА и может быть использован для контроля его активности в повседневной практике) <2,6) или как минимум низкой активности заболевания (DAS28 <3,2).
2. Ранняя активная терапия базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), не позднее первых 3 мес. от начала болезни.
3. Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ и последующим изменением (при необходимости) схемы лечения в течение 3 мес. до достижения ремиссии (или низкой активности) болезни.
4. Тщательный контроль изменений активности заболевания и коррекция терапии не реже 1 раза в 3 мес. или ежемесячно у больных с высокой и умеренной активностью РА.
5. В случае недостаточной эффективности стандартной терапии БПВП показано назначение генно-инженерных биологических препаратов (ГИБП).
6. Определение тактики терапии должно быть согласовано с пациентом.
К факторам неблагоприятного прогноза (ФНП) у больных РА относятся [4]:
– молодой возраст;
– женский пол;
– высокие титры ревматоидного фактора (РФ) и/или антитела к циклическому цитруллиновому пептиду (АЦЦП);
– эрозивный процесс в суставах по данным рентгенографического исследования или магнитно-резонансной томографии (МРТ);
– повышение уровней острофазовых показателей: скорости оседания эритроцитов (СОЭ) или С-реактивного белка (СРБ);
– высокая активность заболевания согласно индексам DAS28, SDAI (Simplified Disease Activity Index) или CDAI (Clinical Disease Activity Index);
– внесуставные проявления (синдром Шегрена, поражение легких и т. д.).
Оценка эффективности лечения РА по критериям Европейской антиревматической лиги (EULAR) представлена в таблице 1. Общепризнанным методом оценки активности РА является расчет индекса DAS28, который можно автоматически произвести на сайте www.das-score.nl.
Критерии эффективности терапии РА [5]:
• хороший клинический ответ (≈ ACR 70) (критерии Американской коллегии ревматологов);
• низкая активность болезни (DAS28 ≤ 3,2) или ремиссия (DAS28 ≤ 2,6);
• улучшение функции (HAQ (Health Assessment Questionare, опросник состояния здоровья, позволяющий оценить функциональные способности больных РА) <1,5) и качества жизни;
• предотвращение прогрессирования деструкции:
– замедление нарастания рентгенологических индексов (Sharp, Larsen);
– отсутствие появления новых эрозий;
– стабилизация или улучшение состояния по данным МРТ.
У пациентов, находящихся в состоянии ремиссии более 1 года после отмены глюкокортикостероидов (ГКС), следует рассмотреть вопрос о возможности прекращения лечения ГИБП, особенно если они применялись в комбинации с БПВП. Важное значение при определении тактики лечения имеет выбор пациентов.
Рассмотрим отдельные клинические ситуации и подходы к терапии при РА.
I. Пациент с впервые установленным ранним РА
Ранняя стадия РА – условно выделенная, клинико-патогенетическая стадия заболевания с длительностью активного синовита до 1 года, характеризуется преобладанием экссудативных изменений в пораженных суставах, частым атипичным течением и хорошим ответом на лечение. Выделение понятия «ранний РА» связано со сложившимися представлениями о патогенезе болезни и необходимости проведения ранней активной терапии РА. Ранний РА может дебютировать как недифференцированный артрит, что требует динамического наблюдения за больными и проведения тщательного дифференциально-диагностического поиска. На ранней стадии РА наиболее информативными являются диагностические критерии Американского и Европейского ревматологических сообществ, предложенные в 2010 г. (табл. 2).

Диагноз РА может быть установлен при общем счете не менее 6 баллов.
Доказано, что адекватная базисная терапия на ранней стадии РА позволяет предотвратить структурные повреждения, что способствует сохранению функциональной активности пациентов и улучшает отдаленный прогноз. БПВП необходимо назначать не позднее 3 мес. от начала РА с быстрой эскалацией дозы для достижения оптимального эффекта (DAS <2,4) и последующей заменой препарата в течение 3–6 мес. при его неэффективности [1]. Терапию БПВП следует продолжать даже при снижении активности заболевания и достижении ремиссии.
К БПВП первого ряда отнесены МТ, лефлуномид (ЛФ) и сульфасалазин (СС) (табл. 3), т. к. доказана их эффективность в отношении предотвращения деструктивных изменений суставов (уровень доказательности А). Препараты «второй линии» (гидроксихлорохин, препараты золота и др.) применяются при неэффективности препаратов первого ряда либо в комбинации с ними.
МТ – «золотой стандарт» терапии активного РА. При необходимости назначения МТ в дозе > 15 мг/нед. рекомендуется использовать парентеральный путь введения (в/м или п/к). Также с целью минимизации побочных явлений необходимо назначение фолиевой кислоты 1 мг/cут (5 мг/нед.), исключая дни приема МТ.

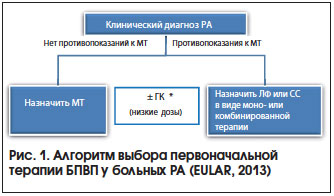
Основные стратегии лечения раннего РА (рис. 1) [7]:
1. Монотерапия МТ c последующей заменой на другие БПВП (ЛФ, СС) через 3–6 мес. в случае неэффективности или плохой переносимости).
2. Комбинированная базисная терапия, в т. ч. в сочетании с высокой дозой ГК. Используются комбинации БПВП как первого ряда (МТ + СС или МТ + ЛФ), так и второго ряда (МТ + Плаквенил) и т. д.
3. Комбинированная терапия синтетическими БПВП + ГИБП (в первую очередь ингибиторы фактора некроза опухоли (ФНО) при сохраняющейся > 3–6 мес. высокой активности РА, а также при наличии ФНП. Например, МТ 25 мг/нед. + Инфликсимаб 3 мг/кг массы тела.

II. Пациент с развернутым РА, не отвечающий на традиционные БПВП
Развернутая стадия РА – заболевание с отчетливо выраженной симптоматикой и длительностью болезни более 1 года. Суставной синдром имеет стойкий, симметричный и полиартикулярный характер с преимущественным поражением суставов кистей и стоп, выявляются признаки высокой или умеренной лабораторной активности, серопозитивность по РФ, эрозивный процесс в суставах по данным рентгенографии. Если диагноз устанавливается впервые, то стратегия ведения больного та же, что и при раннем РА. В случае уже проводившегося лечения с недостаточным эффектом или непереносимостью синтетических БПВП (как в виде монотерапии, так и при комбинированном их использовании), а также наличием ФНП прибегают к назначению ГИБП (рис. 2). Использование ГИБП позволяет максимально избирательно воздействовать на отдельные звенья иммунопатогенеза РА и существенно улучшить состояние больных РА, резистентных к стандартным БПВП и ГК [8]. Установлено, что комбинация традиционных БПВП с ГИБП более эффективна, чем монотерапия.
Назначение ГИБП показано:
– при длительно сохраняющейся (> 3–6 мес.) высокой активности РА;
– при высокой активности заболевания < 3 мес., только при наличии у больных ФНП.
Препаратами первого ряда среди ГИБП являются ингибиторы ФНО-α. Другие ГИБП назначаются больным РА с неадекватным ответом на блокаторы ФНО-α или при невозможности их применения (табл. 4).

Противопоказания к назначению ГИБП: отсутствие лечения одним или более БПВП (в первую очередь МТ) в полной терапевтической дозе; купирование обострений; тяжелые инфекционные заболевания (сепсис, септический артрит, пиелонефрит, остеомиелит, туберкулезная и грибковая инфекции, вирус иммунодефицита человека), злокачественные новообразования; беременность и лактация.
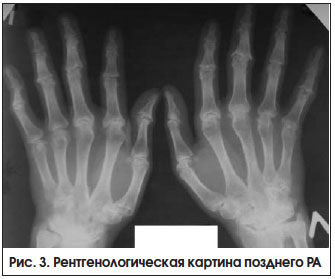
III. Пациент с поздним РА и остеопоротическими переломами
Поздняя стадия РА определяется как стадия необратимых структурных изменений (деформаций, подвывихов) суставов при длительности болезни > 2-х лет, с выраженными признаками активного воспаления или без них (рис. 3). Неуклонное прогрессирование болезни приводит к формированию различных видов подвывихов и контрактур суставов, в связи с чем возрастает роль реабилитационных и ортопедических мероприятий.
Развитие остеопороза (ОП) и ассоциированных с ним переломов является одним из наиболее тяжелых осложнений РА, определяющим неблагоприятное течение и прогноз болезни. Частота остеопоротических переломов среди больных РА в 1,5–2,5 раза выше, чем в общей популяции [9]. Предполагается, что развитие ОП и суставной деструкции при РА имеет единые патогенетические механизмы, в основе которых лежит цитокин-зависимая активация остеокластогенеза, приводящая к повышению костной резорбции [10]. Развитие ОП при РА определяется множеством общих и специфических, ассоциированных с заболеванием и лечением, факторов риска.
РА-ассоциированные факторы риска ОП и переломов [11]:
– активность воспалительного процесса,
– рентгенологическая стадия,
– тяжесть функциональных нарушений (HAQ > 1,25),
– длительность болезни,
– прием ГК,
– высокий риск падений.
У больных РА прием ГК в 4–5 раз повышает риск вертебральных переломов и удваивает риск переломов бедра. При этом доказано, что не существует безопасной дозы ГК. Также следует помнить, что развитие переломов у больных, получающих ГК, происходит при более высоких значениях минеральной плотности ткани (МПК), чем при первичном ОП, поэтому антиостеопоротическую терапию следует начинать при значениях Т-критерия < -1,5 стандартного отклонения от референсных значений.
Программа ведения больных РА и с остеопоротическими переломами включает контроль активности РА, коррекцию модифицируемых факторов риска ОП и переломов, предупреждение падений, антиостеопоротическую терапию, диету и физические упражнения. Всем больным РА необходимы проведение расчета абсолютного риска переломов (FRAX-алгоритм) (fracture risk assessment tool, 10-летний абсолютный риск перелома – инструмент оценки риска перелома ВОЗ) и профилактическое назначение препаратов кальция и витамина D. Назначение антиостеопоротической терапии без учета данных МПК проводится у пациентов в возрасте 65 лет и старше при наличии в анамнезе переломов при минимальной травме. Препаратами первой линии в лечении ОП у больных РА являются бисфосфонаты (БФ) и антитела к RANKL (лиганду рецептора активатора ядерного фактора каппа бета), обладающие антирезорбтивным действием (табл. 5). Привлекательность БФ при РА заключается еще и в том, что, по данным экспериментальных исследований, они могут оказывать благоприятное влияние на течение болезни. Установлено, что БФ способны ингибировать cинтез провоспалительных цитокинов и развитие костных эрозий при РА [12]. У пациентов с ранним артритом БФ в комбинации с МТ эффективно предотвращают развитие костной деструкции [13].

IV. Пожилой пациент с РА и НПВП-гастропатией
РА у лиц пожилого возраста характеризуется активным быстропрогрессирующим течением, высоким уровнем коморбидности и неблагоприятными исходами. Особое значение в структуре коморбидных состояний при РА имеют кардиоваскулярная и гастроинтестинальная патологии. По данным многочисленных исследований, сердечно-сосудистая заболеваемость и смертность у больных РА в 2–4 раза выше, чем в общей популяции, что диктует необходимость своевременного выявления и коррекции факторов кардиоваскулярного риска.
Рекомендации по снижению кардиоваскулярного риска у больных РА [14]:
• АСК следует принимать за ≥2 ч до приема нестероидных противовоcпалительных препаратов (НПВП).
• Не использовать НПВП в течение 3–6 мес. после острого сердечно-сосудистого события или процедуры.
• Регулярно контролировать артериальное давление.
• Использовать НПВП в низких дозах с коротким периодом полураспада (избегать назначения НПВП с пролонгированным высвобождением).
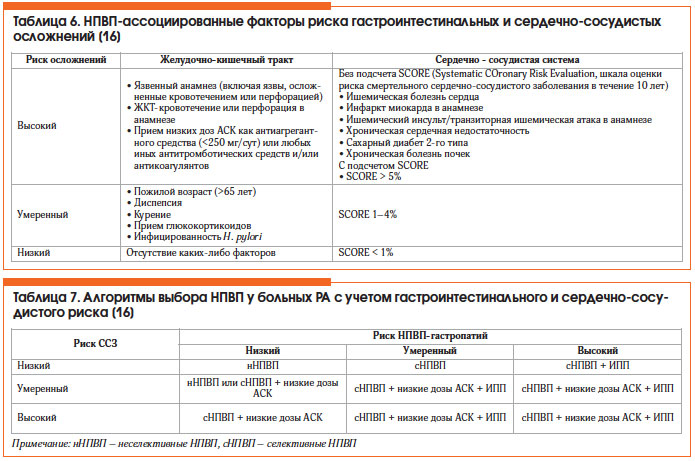
НПВП-гастропатия – одно из наиболее частых осложнений длительного приема НПВП, проявляющееся в виде эрозивного или язвенного поражения верхних отделов желудочно-кишечного тракта (ЖКТ) (преимущественно антральный и препилорический отделы желудка). Прием НПВП не влияет на прогрессирование РА, однако позволяет лучше контролировать симптомы заболевания на фоне терапии БПВП и ГИБП. НПВП-ассоциированные факторы риска гастроинтестинальных и сердечно-сосудистых осложнений представлены в таблице 6.
Экспертами EULAR разработан «калькулятор» для индивидуального подбора НПВП в зависимости от наличия факторов риска в отношении ЖКТ и сердечно-сосудистой системы [15]. К НПВП с наименьшим кардиоваскулярным риском отнесены напроксен, целекоксиб, кетопрофен, низкие дозы ибупрофена (<1200 мг/сут). Основные лекарственные средства, которые используют для лечения НПВП-индуцированных гастропатий, — ингибиторы протонной помпы (ИПП), Н2-блокаторы и мизопростол (синтетический аналог ПГ Е2). Алгоритмы выбора НПВП у больных РА с учетом гастроинтестинального и сердечно-сосудистого риска представлены в таблице 7 [16].
Не так давно появилась новая генерация НПВП, которые повышают активность оксида азота (NO) в слизистой желудка (NO-НПВП). Как известно, NO обладает гастропротективными свойствами: стимулирует секрецию слизи, бикарбоната, улучшает микроциркуляцию, ингибирует адгезию лейкоцитов к эндотелию, что и определяет фармакологические преимущества данной группы НПВП. Одним из представителей NO-НПВП является препарат Найзилат (амтолметин гуацил), который наряду с высокой анальгетической и противовоспалительной активностью обладает гастропротективными свойствами. В рандомизированных клинических исследованиях были продемонстрированы более низкие частота и тяжесть повреждений слизистой оболочки желудка после применения амтолметин гуацила по сравнению с таковыми других неселективных НПВП (диклофенак, индометацин, пироксикам), при сопоставимой противовоспалительной и анальгетической их эффективности [17]. Сравнительное исследование амтолметин гуацила 1200 мг/сут и целекоксиба 400 мг/сут у больных РА показало равнозначные эффективность и безопасность препаратов [18]. Терапевтическая доза амтолметин гуацила (Найзилат) составляет 600 мг 2 р./сут натощак, поддерживающая – 600 мг/сут.
Заключение
РА является гетерогенным заболеванием, исходы которого во многом определяются своевременной диагностикой болезни и правильно выбранной тактикой лечения. Ранняя стадия РА, особенно первые 3 мес. от начала заболевания, наиболее благоприятны для проведения эффективной базисной терапии. Основой ведения больных РА является тщательное мониторирование активности заболевания (не реже 1 р./3 мес.) с последующей коррекцией терапии при необходимости. Выбор терапии определяется стадией РА, активностью болезни, наличием ФНП, сосуществующими коморбидными состояниями, а также эффективностью предшествующего лечения.
Источник
